Плато потенциала действия кардиомиоцитов (КМЦ) сердца (фаза 2 ПД)
Во время фазы плато, которая может длиться несколько сотен миллисекунд, мембранная проводимость по отношению ко всем ионам падает до очень низких значений.
Для того чтобы в МП произошли те же изменения, при меньшем изменении тока требуются уровни, близкие к плато, но не к потенциалу покоя. Уровень плато поддерживается за счет конкурентных токов: выходящих из клетки ионов К+ и Cl- и входящих ионов Са2+, движущихся через открытые Са2+-каналы L-типа, а также Na+, который меняется на Са2+ посредством Na+/Са2+-обмена.
После деполяризации проведение калия падает до уровня плато в результате выпрямления входящего тока, несмотря на большую электрохимическую движущую силу ионов К+.
Выпрямление — это изменение проводимости мембраны в зависимости от потенциала. В частности, выпрямление входящего тока означает, что при отрицательных потенциалах К+-каналы открываются, а при менее отрицательном или положительном напряжении — закрываются.
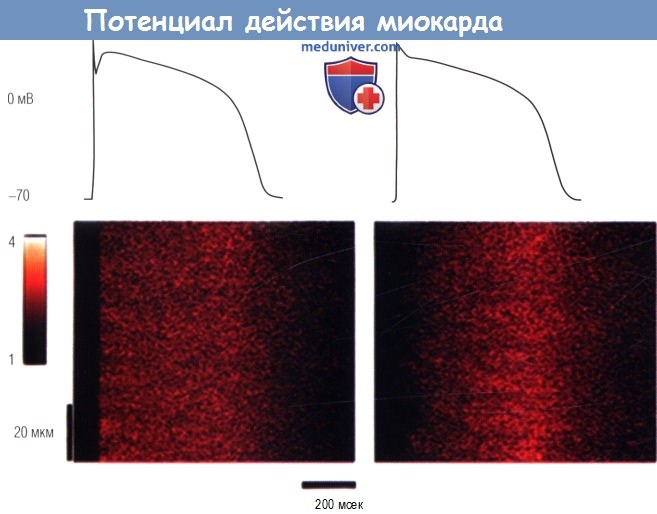
Нормальные КМЦ были фиксированы с профилями ПД с формой волны здорового сердца или с хронической СН, местные изменения внутриклеточного кальция записывались одновременно.
Когда КМЦ были фиксированы с нормальным ПД, возникало углубление реполяризации ранней фазы 1 (слева) и отмечался постоянный выход Са2+.
При использовании профиля ПД при хронической СН без быстрой реполяризации фазы 1 выброс Са2+ был асинхронным.
Диссинхронизация вызывает замедление скорости увеличения тока Са2+ и потерю пространственной и временной однородности выброса.
F/F0 — флуоресценция кальциевого индикатора, нормализованного до базового уровня флуоресценциию.
Полагают, что в основе выпрямления входящих токов в кардиальных каналах IKI лежит индуцированный деполяризацией внутренний мембранный блок. Механизмом, обусловливающим выпрямление быстрого компонента задержанного выпрямления тока К+ (IKR) в клетках миокарда, является инактивация, которой за короткое время подвергаются каналы во время деполяризационных импульсов. Большое количество каналов IKR достигают инактивированного состояния стойкой деполяризации, что и обусловливает выпрямление входящих токов.
Этот быстрый механизм инактивации чувствителен к изменениям входящего тока К+ в физиологических пределах, и инактивация происходит при низкой внутриклеточной концентрации К+. Так, гипокалиемия способствует уменьшению выходящего тока IKR, при этом удлиняется ПД.
Выход К+ из клетки осуществляется медленным компонентом задержанного выпрямления тока К+ (IKS), что также имеет отношение к длительности фазы плато: (1) показано, что плотность IKS коррелирует с длительностью ПД; (2) изолированные дефекты, обнаруженные в субъединице KvLQTl, которая в комбинации с субъединицей IsK (minK) восстанавливает ток IKS, ассоциированы с аномально длительной желудочковой реполяризацией (СУ QT, тип 1).
Ток IKS активируется медленно по сравнению с длительностью ПД и медленно инактивируется. Повышение ЧСС может обусловливать активацию, чтобы потенциал действия накопился во время периода последующей деполяризации, а накопленная активация может определять зависимость от реполяризации токов К+, которые активируются в период фазы плато. В условиях снижения внутриклеточной концентрации АТФ (гипоксия, ишемия) ток K+ через активированные каналы КATP повышается, таким образом укорачивая фазу плато ПД.
Другие ионные механизмы, которые контролируют длительность и потенциал плато, влияют на кинетику инактивации тока Са2+ через каналы L-типа. Результатом сниженной активности свободного внутриклеточного Са2+ в отношении запуска Са2+-зависимой инактивации, как, например, в КМЦ гипертрофированного сердца, может стать поздняя реполяризация. Установившиеся компоненты токов INa и ICa.L («оконный» поток) могут изменить форму фазы плато.
Na+/К+-АТФаза генерирует суммарный выходящий ток за счет «выкачивания» наружу 3 ионов Na+ в обмен на 2 иона К+. Неинактивируемые токи Cl-, такие как ICl.swell и ICl.cAMP, при определенных обстоятельствах могут обеспечивать значительные выходящие потоки в период фазы плато, при этом значительно укорачивая ПД.
Было показано, что неселективный свеллингиндуцированный катионный поток способствует удлинению ПД в КМЦ поврежденных желудочков.
Видео физиология фаз потенциала действия кардиомиоцитов
- Читать "Фаза конечной быстрой реполяризации кардиомиоцитов (КМЦ) сердца (фаза 3 ПД)"
Оглавление темы "Фазы потенциала действия кардиомиоцитов сердца":- Строение щелевого соединения вставочных дисков сердца и его функции
- Фазы потенциала действия кардиомиоцитов (КМЦ) сердца
- Мембранный потенциал покоя кардиомиоцитов (КМЦ) сердца (фаза 4 потенциала действия)
- Фаза возбуждения кардиомиоцитов (КМЦ) сердца (фаза 0 потенциала действия)
- Фаза ранней быстрой реполяризации кардиомиоцитов (КМЦ) сердца (фаза 1 потенциала действия)
- Плато потенциала действия кардиомиоцитов (КМЦ) сердца (фаза 2 ПД)
- Фаза конечной быстрой реполяризации кардиомиоцитов (КМЦ) сердца (фаза 3 ПД)
- Фаза диастолической деполяризации кардиомиоцитов (КМЦ) сердца (фаза 4 ПД)
- Механизмы автоматизма синусового узла сердца
- Потеря мембранного потенциала клеткой как причина аритмий
