Радионуклидная визуализация и сцинтиграфия околощитовидных желез
Среди методов топической диагностики измененных околощитовидных желез в последние годы наибольшую значимость обоснованно приобрели методы радионуклидного исследования (МРНИ). Будучи методами, регистрирующими распределение введенных в организм радиофармацевтических препаратов (РФП), они позволяют выявлять аденомы и гиперплазию ОЩЖ практически при любой их локализации. МРНИ являются наиболее достоверными методами тонической диагностики измененных ОЩЖ. При гиперпаратиреозе они существенно превосходят по объему и точности диагностической информации большинство других методов (Калинин А.П. и др., Котова И.В., Черенько С.М., Erbil Y., Barbaras U.).
Современные сцинтилляционные гамма-камеры сконструированы таким образом, что позволяют регистрировать, хранить и обрабатывать изображения в различных режимах: статическом, динамическом, пленарном и томографическом. Эти методы, кроме топографических особенностей, позволяют визуализировать функциональную и метаболическую активность ткани ОЩЖ, что особенно важно, так как имеется возможность «картировать» только функционирующую ткань.
С целью выявления измененных околощитовидных желез применяют РФП, которые обладают повышенной тропностью к опухолевым клеткам. Серьезным доводом для выбора именно туморотропных препаратов является тот факт, что в 85-90% случаев причиной ПГПТ является солитарная аденома ОЩЖ. Для рака ОЩЖ также характерны интенсивный захват и задержка РФП. Это не означает, что применяемые в настоящее время РФП отвечают требованиям, предъявляемым к ним специалистами. На протяжении многих лет ведется поиск РФП, который был бы избирательно специфичен для ткани ОЩЖ. К сожалению, такой идеальный препарат для ОЩЖ еще не создан (Mariani G. et al.).
С первого применения радионуклидов для диагностики патологии околощитовидных желез исследователи столкнулись с несколькими проблемами. Основную сложность при сцинтиграфии желез представляет непосредственная близость ЩЖ, ткань которой сама отличается высоким уровнем метаболизма (даже при отсутствии патологии) и способностью хорошо накапливать наиболее используемые РФП. Выход был найден в конце 60-х годов XX века. Было предложено использовать последовательно два РФП, которые обладают различной способностью накапливаться и выводиться из ЩЖ и ОЩЖ (двухизотопиая методика). Первой попыткой визуализации ОЩЖ при помощи двух радионуклидов была субтракционная сцинтиграфия с использованием 75Se-метионина (Di Guilio W., Beierweltes W., Di Giulio W., Morales J.) в сочетании с другими РФП (125I,131I).
Вначале удалось получить обнадеживающие результаты, но затем было признано, что сцинтиграфия с 75Se-метионином недостаточно чувствительна и в результате получено большое количество ложноотрицательных результатов (Colella A.C., Pigorini F.). Метод оказался эффективным лишь в 57%, а его специфичность составила всего 18,2%. Кроме того, были установлены высокая лабильность показателей и низкая воспроизводимость в динамике, так как на накопление 75Sc-метионина в ткани ОЩЖ существенное влияние оказывают постоянно изменяющиеся особенности кровотока как в самой ОЩЖ, так и в близлежащих тканях. Поэтому начали использовать другие радионуклиды: l17Cs, l34Cs и 67Ga (Ferlin G.et al., Bekerman С. et al.).
Сцинтиграфия с этими РФП обладала большей информативностью, но были отмечены серьезные недостатки этих методик: длительный период полураспада радионуклида, существенная лучевая нагрузка, которой подвергается больной, и невысокая чувствительность метода. Это заставило специалистов прибегнуть к РФП с другими характеристиками.
М. Fukunaga в 1979 г. опубликовал данные о первом опыте применения изотопа таллия у пациента с аденомой околощитовидных желез. Четыре года спустя G. Ferlin и соавт. сообщили о клиническом применении 201Т1-хлорида с технецием. Несмотря на полученные положительные результаты (низкий риск облучения, небольшой уровень радиации, низкая оператор-зависимость) используемого РФП, с самого начала исследования разные авторы неоднозначно оценивали его возможности: одни отмечали его высокую чувствительность — 82—90% (Hauty M. et al., Gonzales J.R., Paricio P.P.), другие сообщали о низких показателях чувствительности - 55% (Price D.C.) и даже 27% (Miller D.L. et al.).
По мнению многих исследователей, несмотря на высокую диагностическую точность в выявлении опухолей грудной клетки, сцинтиграфия с 201Т1 имеет ряд ограничений, связанных с физическими характеристиками препарата. Большой период полураспада — 3 сут и высокая энергия фотона ограничивают дозу введения 201Т1 в дозировке 3—5 мКи (110—185 МБк). Низкая статистика счета приводит к более низкому разрешению как для планарных, так и для ОФЭКТ-изображений.
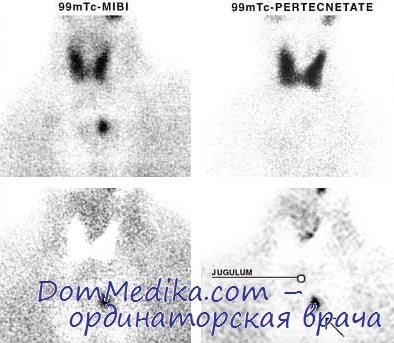
A.J. Coakley и соавт. в 1989 г. сообщили о возможности использования при сцинтиграфии околощитовидных желез нового препарата технеция — 99mTc-sestamibi. При выполнении сцинтиграфии миокарда они случайно обнаружили, что измененные ОЩЖ способны интенсивно накапливать и удерживать препарат. Как показали дальнейшие исследования (O'Doherty et al.), 99mTc-sestamibi более интенсивно, чем 201Tl, накапливается в измененной паратиреоидной ткани. В последующем большинство ученых подтвердили, что сцинтиграфия с 99mTc-sestamibi является наиболее информативной при выявлении патологически измененных ОЩЖ. Продолжение исследований в этом направлении привело к появлению интересных данных о том, что клиренс препарата в ЩЖ и ОЩЖ различен.
При использовании мононуклидной технологии были, к всеобщему удивлению исследователей, получены хорошие результаты, что в последующем позволило R. Tallerfer и соавт разработать новую двухфазную технологию сцинтиграфии с 99mTc-sestamibi.
За прошедшие 20 лет методика сцинтиграфии измененных околощитовидных желез была усовершенствована. На основе принципов сцинтиграфии с радионуклидами и компьютерных технологий были созданы ОФЭКТ и ПЭТ. Можно с уверенностью сказать, что заложенный в основу сцинтиграфии принцип функциональной и анатомической детерминации тканей имеет в эндокринной хирургии хорошие перспективы. Он позволяет выявлять и устранять (удалять, разрушать, испарять, замораживать, лишать кровоснабжения и т. д.) очаги чрезмерной секреции ПТГ с минимальным повреждением окружающих тканей. Вероятно, в будущем именно на базе таких методик будут создаваться автоматизированные хирургические технологии, гарантирующие прицельное дозированное воздействие на патологический очаг в эндокринном органе без воздействия на организм в целом.
Оглавление темы "Обследование околощитовидных желез":- Радионуклидная визуализация и сцинтиграфия околощитовидных желез
- Показания к сцинтиграфии околощитовидных желез - радионуклидной визуализации
- Субтракционная двухизотопная (бинуклидная) сцинтиграфия околощитовидных желез
- Двухизотопная сцинтиграция технецием и таллием околощитовидных желез
- Технеций sestamibi в сцинтиграфии околощитовидных желез
- Техника бинуклидной сцинтиграфии околощитовидных желез
- Техника двухфазной сцинтиграфии околощитовидных желез
- Оценка результатов сцинтиграфии (сцинтиграмм) околощитовидных желез
- Недостатки сцинтиграфии околощитовидных желез
- Однофотонная эмиссионная компьютерная томография (ОФЭКТ) околощитовидных желез
