Механизмы активации клеток при ВИЧ
Поскольку активация клетки повышает риск ее апоптоза, необходимо рассмотреть факторы, вызывающие активацию клетки. Уменьшение количества CD4+-Т-клеток (инфицированных и неинфицированных) и прогрессирование заболевания коррелирует со степенью активации иммунной системы.
Гибель CD4+-клеток может происходить в результате активации через «рецепторы смерти» (внешний путь) или автономной гибели Т-клеток, происходящей с помощью внутреннего пути активации с участием Bcl-2. Снижение экспрессии Вс1-2 приводит к апоптозу клетки.
Неинфицированные CD4+-Т-клетки могут погибать за счет неспецифической активации. Этот процесс связан с активацией клетки без вовлечения с Т-клеточного рецептора (TCR). Растворимые цитокины (например, интерфероны а или у), а также мембраносвязанные молекулы и рецепторы, помимо TCR, способны приводить к такой гибели клетки.
В ранние сроки после инфицирования высокая степень активации иммунной системы (о чем свидетельствует уровень экспрессии CD38 на лимфоцитах) коррелирует с выраженной гибелью CD4+-клеток. Роль таких кофакторов, как другие инфекции, в усилении гибели CD4+-клеток бывает связана с активацией иммунной системы под действием этих инфекций, в особенности в кишечнике.
Для активации лимфоцитов необходимы два сигнала, что позволяет отличить чужеродные антигены от собственных. Первый сигнал связан с распознаванием антигена, а второй является дополнительным стимулом, который опосредован мембранными молекулами семейства В7.

отдела иммунологии и инфекционных болезней Гарвардской медицинской школы и руководитель отдела иммунологии и инфекционных болезней Гарвардской медицинской школы.
Др. Эссекс является одним из первых исследователей, определивших, что ретровирус служит причиной развития СПИДа.
Гибель клетки в результате активации характерна для ранее активированных клеток и может быть связана с повторяющимся действием антигена. Таким образом, при высокой степени активации Т-клеток при ВИЧ-инфекции дальнейшее стимулирование может вызывать апоптоз и уменьшение количества CD84-клеток.
Этот процесс связан с повышением чувствительности к апоптозу за счет действия Fas-лиганда при повышении экспрессии Fas на поверхности клетки или действия TNF через TNFR (или TRAIL/APO-2). По-видимому, более медленное прогрессирование патологии при инфекции ВИЧ-2 по сравнению с ВИЧ-1 связано с меньшей степенью активации иммунной системы ВИЧ-2, особенно на фоне антиген-специфических реакций CD8+-Т-клеток.
Как отмечали выше, апоптоз, являющийся результатом активации, может быть связан с уменьшением экспрессии антиапоптозного белка Bcl-2 и увеличения проапоптозного белка Bim.
CD38 представляет собой поверхностный гликопротеин 2 типа с мол. весом 45 кДа, который был впервые индентифицирован более 25 лет назад. Этот белок играет роль в адгезии клеток эндотелия человека через мембранные молекулы CD31. Его экспрессия на Т-клетках связана с активацией.
Возможность измерения экспрессии CD38 для выявления степени активации иммунной системы и скорости прогрессирования СПИДа впервые была установлена Джорджи (J.V. Giorgi) с коллегами. Большее количество активированных CD8/CD38+-клеток позволяет предсказать скорую гибель CD4+-клеток. Кроме того, увеличение чувствительности ВИЧ-специфических CD8+-клеток к апоптозу, возможно, связано с усилением экспрессии CD38 на их поверхности.
CD38 обнаруживают как на инфицированных, так и на неинфицированных клетках. В последних усиление его экспрессии скорее всего связано с действием провоспалительных цитокинов. Концентрация растворимых молекул CD8 в крови и экспрессия CD38, в особенности на CD8+-клетках памяти (CD45RO+), представляют собой достоверные маркеры активации Т-клеток. Неиммунные покоящиеся Т-клетки (CD8+ CD45RA+ Т-клетки) могут в нормальных условиях экспрессировать CD38. К другим маркерам активации относят CD69 и HLA-DR.
Наконец, острая ВИЧ-инфекция может вызвать активацию и уже далеко зашедших в своей дифференцировке Т-лимфоцитов, причем как CD4+, так и CD8+-T-клеток. Активация этих «старых» клеток также приводит к их гибели в связи с тем, что они уже утратили фермент теломеразу и по этой причине не могут пройти нормальный митоз, но гибнут при попытке деления. Потеря дифференцированных иммунных Т-лимфоцитов вносит существенный вклад в развитие синдрома иммунодефицита у ВИЧ-инфицированных пациентов.
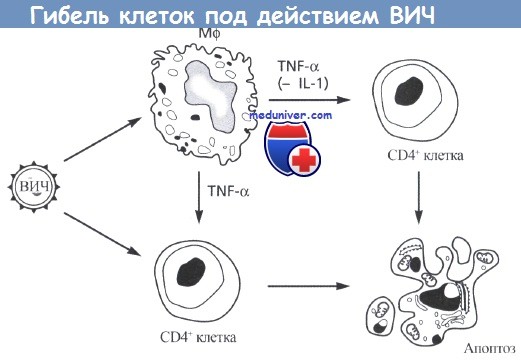
Представлен предполагаемый механизм непрямой гибели CD4+-клеток.
Инфицирование макрофагов ВИЧ-1 может вызывать выработку цитокинов (например, фактора некроза опухоли альфа - TNF),
которые могут индуцировать запрограммированную гибель (апоптоз) CD4+-клеток (инфицированных или неинфицированных). Кроме того, уменьшение продукции интерлейкина-1 (IL-1) инфицированными макрофагами может привести к апоптозу CD4+-клеток, особенно в присутствии антигена.
В некоторых случаях инфицирование CD4+-клеток может привести к активации процесса запрограммированной гибели клетки.
- Вернуться в оглавление раздела "Инфекционные болезни"
Оглавление темы "Цитотоксическое действие ВИЧ":- Взаимодействие клетки с белками оболочки ВИЧ - gp120 и gp41
- Повреждение мембраны и гибель клетки под действием белков ВИЧ
- Апоптоз клеток под действием ВИЧ
- Механизмы индукции апоптоза при ВИЧ-инфекции
- Типы клеток подвергающихся апоптозу при ВИЧ-инфекции
- Значение цитокинов в апоптозе при ВИЧ-инфекции
- Значение белков ВИЧ в апоптозе клеток
- Апоптоз клеток приматов при ВИЧ
- Основные моменты по апоптозу клеток при ВИЧ
- Механизмы активации клеток при ВИЧ
