Лабораторная диагностика туляремии
Непосредственное выделение возбудителя туляремии от больного трудно осуществимо, поэтому для бактериологического подтверждения диагноза ставят биопробу на животных (на белых мышах и морских свинках). Материалом для заражения животных служат: кровь, пунктат из бубонов, мокрота, отделяемое кожных язв, а также со слизистых оболочек. Материал нужно забирать по возможности в ранние сроки, до начала лечения антибиотиками. Материал вводится подкожно.
Белые мыши погибают в период между 3 и 9 сутками, а морские свинки — между 4 и 15 сутками после заражения. Из органов павших животных (лимфатические узлы, селезенка, печень, легкие) делают мазки-отпечатки и производят посевы на яичную среду Мак-Коя или агар Д с кровью и желтком. При идентификации микробной культуры большое значение имеет люминесцентная микроскопия и РА с туляремийной диагностической сывороткой.
Иммунологические методы диагностики туляремии получили широкое распространение. В медицинской практике их значение намного важнее бактериологического метода. В группе серологических реакций основное значение для диагностики заболевания и определения иммунитета у переболевших и привитых имеет реакция агглютинации.
Она ставится по типу реакции Видаля и в упрощенном варианте, на предметном стекле. В пробирочном варианте исследуемую сыворотку разводят от 1:25 до 1:400 и выше. Агглютинины появляются к 10-му дню заболевания, диагностическим считается титр 1:100 и выше. Для дифференциации иммунологической реакции у заболевшего от возможной реакции у привитого, реакцию агглютинации следует повторить через 7—10 дней для установления нарастания титров, что весьма выражено у больных.
В сомнительных случаях реакцию агглютинации можно повторить через месяц от начала заболевания.
На предметном стекле ставят так называемую кровяно-капельную пробу. Этот упрощенный вариант реакции агглютинации носит качественный характер. На каплю цельной крови пациента наносят каплю дистиллированной воды и каплю неразведенного диагностикума. Все три капли размешивают стеклянной палочкой; в положительных случаях немедленно наступает агглютинация. Если агглютинация на стекле наступает в течение 2—3 минут, ее диагностическое значение сомнительно.
Для обеих реакций применяется туляремийный диагностикум из вакцинного штамма, содержащий 5 млрд микробов в 1 мл. Для использования его в пробирочной реакции диагностикум разводят в 5 раз, для кровяно-капельной реакции — применяют в цельном виде. Агглютинины сохраняются в крови переболевших в течение многих лет.

Высокой чувствительностью обладает реакция непрямой гемагглютинации с сенсибилизированными эритроцитами полисахаридными фракциями туляремийного микроба. РНГА при туляремии достаточна специфична, обнаруживая некоторый перекрест с бруцеллезными сыворотками, однако титры с гомологичным антигеном намного выше.
У больных титр на 2-й неделе заболевания достигает 1:10000—1:40000, пик его образуется к концу месяца и снижается к 8 месяцам. (1:640). Через год этот титр (в среднем 1:640) сохраняется. При ретроспективном обследовании гемагглютинационные титры равны 1:50—1:100.
Реакция связывания комплемента при туляремии, будучи более громоздкой, не имеет преимуществ перед реакциями агглютинации и не получила практического применения.
Для выявления антигена туляремийного микроба в органах павших животных пользуются реакцией преципитации. Реакцию ставят аналогично реакции Асколи при сибирской язве с термоэкстрактом из органов и с агглютинирующей туляремийной сывороткой высокого титра (1:6000—1:8000). Реакция преципитации должна быть в последующем подтверждена выделением культуры.
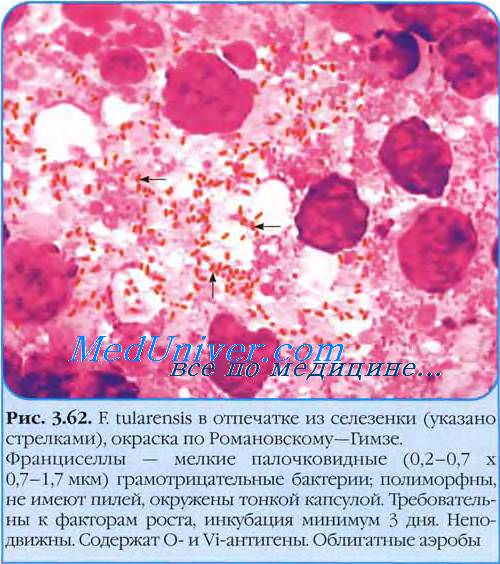
Для лабораторной экспресс-диагностики и обнаружения возбудителя туляремии в мазках из культур, отпечатках органов и тканей животных, гистологических срезах, смывах с объектов внешней среды и при наличии не менее 1 млн микробных клеток в 1 мл субстрата можно использовать иммунофлуоресцентный метод. Пользуются прямым методом флуоресцирующих антител.
Признанным и эффективным методом иммунологического исследования больного, переболевшего или привитого человека считается применение тулярина для внутрикожной пробы. Эта проба ставится, как обычно, в дозе 0,1 мл внутрикожно с 3—5-го дня заболевания. Учет производится через 24—48 часов. Положительная реакция оценивается при наличии выраженной гиперемии и отека (иногда болезненного) на месте введения тулярина не менее 5 мм, обычно от 10 и до 30 мм и более.
Во избежание очень выраженных реакций, больным ставят пробу с тулярином для накожного применения по типу реакции Пирке. Учет — через 48 часов; определяется гиперемия и отек более 5 мм в диаметре по ходу насечек, что считается положительной реакцией.
У больных кожно-аллергическая проба с тулярином — простой метод ранней и ретроспективной (до 30 и более лет) диагностики заболевания.
В итоге для иммунодиагностики туляремии у людей вполне достаточно постановки реакции агглютинации (пробирочной), дополняемой РНГА и туляриновой кожной пробы.
- Читать "Профилактика туляремии и противоэпидемические меры"
Оглавление темы "Туляремия. Лихорадка Ку":- Туляремия - история, география, возбудитель
- Источник туляремии и его резервуар
- Клиника туляремии у животных и человека
- Лабораторная диагностика туляремии
- Профилактика туляремии и противоэпидемические меры
- Лихорадка Ку - история, география, возбудитель
- Источник лихорадки Ку и его резервуар
- Клиника лихорадки Ку у животных и человека
- Лабораторная диагностика лихорадки Ку
- Профилактика лихорадки Ку и противоэпидемические меры
