Этапы репликации ВИЧ внутри клетки
До настоящего момента мы обсуждали события, происходящие на ранней стадии взаимодействия ВИЧ с клеткой. Это взаимодействие зависит от участвующего в нем типа вируса, экспрессируемых клеточных рецепторов и свойств инфицируемых клеток. После того как вирус проникнет в клетку, различные биологические свойства вирусных белков и нуклеиновых кислот определяют его способность к репликации. На инфекционный цикл ВИЧ также влияют внутриклеточные белки, которые у различных типов клеток могут различаться.
Таким образом, само по себе проникновение вируса не обязательно приведет к развитию продуктивной инфекции. В отдельных статьях на сайте мы рассматриваем внутриклеточные механизмы взаимодействия вируса с клеткой. Более подробное описание событий, происходящих на молекулярном уровне, можно найти в последних обзорах.
После попадания ВИЧ в клетку нуклеокапсида ВИЧ происходит запуск определенных внутриклеточных процессов, которые приводят к интеграции провирусной ДНК в хромосомы клетки. На раннем этапе вырусная геномная РНК высвобождается из вирусного капсида с помощью белка оболочки нуклеоида р24, связанного с клеточным белком циклофилином. Циклофилин А (СурА) представляет собой фермент пептидил-пролил изомеразу, которая связывается с белком капсида (СА) и способствует репликации ВИЧ.
Он включается в состав вирионов ВИЧ в результате прямого взаимодействия с белком Gag во время сборки вириона. Его активирующее влияние на продуцирование вируса зависит от его присутствия в клетке-мишени. Этот процесс может быть заблокирован циклоспорином.
Все еще находясь в связанном состоянии с белками нуклеоида (в основном с матриксным белком р17), вирусная РНК подвергается процессу обратной транскрипции под действием вирусной РНК-(или ДНК)-зависимой ДНК полимеразы и РНКазы Н2, по окончании которой образуется двухцепочечная ДНК-реплика вирусного генома (или провирусная ДНК).
Для осуществления эффективной обратной транскрипции белок нуклеокапсида (NC) р7, по-видимому, выступает в качестве белка-шаперона. Он способствует сохранности транскриптов ДНК, образующихся в результате обратной транскрипции и позже, перед отпочкованием дочерних вирионов, участвует в правильной упаковке (фолдинге) геномной РНК вирусов. Этот уникальный для ретровирусов белок NC содержит два цинковых пальца, которые необходимы для осуществления его функций.
Образующаяся реплика ДНК входит в состав преинтеграционного комплекса (PIC), который содержит вирусный белок р17, белок Vpr и интегразу(IN).
Белок р17, возможно, не является необходимым компонентом PIC. Кроме того, Vpr в составе PIC может содействовать проникновению PIC в ядро, но также не является обязательным компонентом. Интеграза (IN) имеет короткую сигнальную последовательность аминокислот «для локализации в ядре», которая необходима для проникновения PIC в ядро, но не влияет на ферментную активность белков. PIC транспортируется в ядро в составе комплекса ядерной поры. После этого линейная вирусная ДНК встраивается в хромосомы клетки с помощью интегразы и факторов клетки хозяина.
Недавно проведенные исследования показали, что эмерин, интегральный белок внутренней оболочки мембраны ядра, возможно вносит необходимый вклад в возможность репликации ВИЧ в клетке. При отсутствии эмерина провирусная ДНК не может взаимодействовать с хроматином и встраиваться в хромосому.
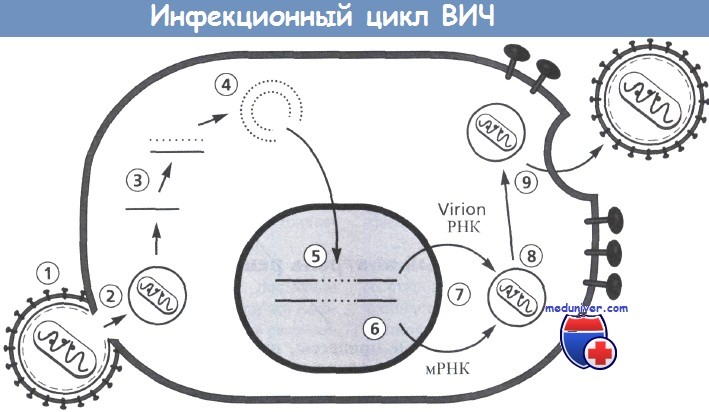
Включает следующие этапы: 1 - прикрепление; 2 - декапсидация; 3 - обратная транскрипция;
4 - образование кольцевых форм; 5 - интеграция; 6 - транскрипция; 7 - трансляция;
8 - сборка вирусной сердцевины; 9 - окончательная сборка и отпочкование вирионов.
На этапах от 3 до 5 некоторые белки вирусной сердцевины связываются с вирусным геномом ( РНК, ДНК).
Двухцепочечные циркулярные формы ДНК могут быть связаны ковалентно и нековалентно.
Последние представляют собой формы, которые интегрируются в хромосому клетки. Противовирусная терапия может быть направлена на каждый этап и потенциально способна нарушать репликацию и распространение вируса.
Рисунок предоставлен Н. Kessler.
Интеграция провируса ВИЧ, по-видимому, происходит преимущественно в транскрипционно активных областях генома клетки, особенно в тех, которые были активированы под действием самого ВИЧ. Интеграция может проходить с участием специфического молекулярного комплекса, локализованного в ядре и состоящего состоящего из вирусной интегразы и фактора роста/коактиватора транскрипции, идентифицированного как продукт, секретируемый эпителиальными клетками хрусталика человека и имеющего мол. вес 75 кДа - р75 (LEDGE/p75 - lens epithelium-derived growth factor/transcription coactivator p75).
LEDGE/p75 представляет собой клеточный белок, связанный с хроматином, который, по-видимому, защищает клетку от стресс-индуцированного апоптоза и является главным фактором, связывающим интегразу вируса с хроматином клетки. LEDGE/ р75, по видимому, обеспечивает интеграцию ВИЧ в транскрипционно активных участках клеточной ДНК, в особенности обогащенных G-C последовательностями нуклеотидов. Однако до сих пор неизвестно, насколько связывание интегразы с хроматином через LEDGE/p75 определяет выбор участка действия для интергразы.
Транспорт PIC в ядро может зависеть от взаимодействия вирусных белков р17 и Vpr с клеточным кариофериновым комплексом, содержащим циклофилины. Как отмечали выше, клеточный белок циклофилин А, связанный с Gag внутри вириона, участвует в ранних стадиях репликативного цикла ВИЧ-1. Однако такое участие, по-видимому, не является необходимым, поскольку Gag-белки других реплицирующихся ретровирусов, в том числе ВИЧ-2, SIV и изолятов ВИЧ-1 группы О, не связываются с СурА.
Кроме того, некоторые исследователи, используя вирусные частицы, помеченные зеленым флуоресцентным белком (GFP), смогли показать, что ВИЧ после проникновения связывается с компонентами цитоскелета в цитоплазме и, возможно, переносится на сеть микротрубочек, где и происходит обратная транскрипция еще до удаления капсидного белка. Затем, после образования PIC, он перемещается к ядерной оболочке и проникает внутрь через ядерные поры. Обычно активация клетки усиливает ВИЧ-инфекцию, облегчая проникновение PIC в ядро.
После интеграции вируса первые вирусные информационные РНК, которые синтезируются в инфицированной клетке, представляют собой дважды сплайсированные транскрипты, кодирующие большинство регуляторных белков, в частности tat, rev и nef. Большую часть (80%) таких мРНК составляет мРНК nef, хотя неизвестно, какой из вирусных белков синтезируется первым.
До сих пор точно не выяснено, может ли образовываться инфекционный ВИЧ без интеграции провируса в хромосомы клетки. В нескольких исследованиях была показана необходимость интеграции ВИЧ для эффективной продукции дочерних вирусов. В одном исследовании, проведенном с использованием SIV, мутантных по области генома int/nef, наблюдали существенное снижение репликации вируса, несмотря на то, что небольшая экспрессия вирусных антигенов все же происходила. В настоящее время интеграцию провирусной ДНК в геном клетки-хозяина считают необходимой для продукции дочерних вирусов, но экспрессия отдельных белков ВИЧ (например, Nef или Gag) может происходить и без такой интеграции.
Регуляторные белки вируса необходимы на первых этапах развития инфекции в покоящейся клетке и, таким образом, их ранняя транскрипция играет важную роль и может объяснять, почему эпитопы именно белков Nef и Tat преимущественно распознаются цитотоксическими Т-лимфоцитами в ранние сроки острой инфекции. Предположительно, пребывание ВИЧ в продуктивном или латентном состоянии может определяться интенсивностью продукции вирусных белков. Высокий уровень экспрессии Tat приводит к выраженной активации продукции вирусных частиц.
Nef играет плейотропную роль и обычно увеличивает репликацию вируса, но функциональные преференции Nef зависят от типа инфицированной клетки и конкретной нуклеотидной последовательности гена nef.
Белок Rev, по-видимому, обеспечивает поддержание равновесия между экспрессией регуляторных и структурных белков ВИЧ. Rev способствует транспорту в цитоплазму больших молекул несплайсированной вирусной РНК, отвечающей за трансляцию белков со структурных генов вируса, включая ферменты, а также несплайсированная вирусная РНК становится геномом дочерних вирионов. В результате образуются инфекционные вирусные частицы.
Реализация функций вирусного белка Rev зависит от определенных клеточных факторов (например, CRM-1 и hRIP). Ранние исследования обезьяньего вируса Мэйсона-Пфайзера позволили идентифицировать вирусный ген, который может заменять Rev, взаимодействуя с клеточным фактором, участвующим в транспорте вирусной РНК. На поздних стадиях цикла репликации вируса Rev способен угнетать свою собственную продукцию, вызывая уменьшение образования дочерних вирусов и, возможно, обеспечивая переход вируса в латентное состояние.
В клетках, не способных поддерживать полноценную репликацию ВИЧ, уровень относительной экспрессии регуляторных белков может быть различным, что, в свою очередь определяет судьбу вирусной инфекции: будет она в абортивной форме, будет персистировать на низком уровне или разовьется латентное состояние вирусной инфекции.
Сборка вируса происходит на мембране клетки, где вирусная РНК встраивается в оболочку нуклеоида, после чего вирусная частица отпочковывается от поверхности клетки, захватывая в составе клеточной мембраны вирусные оболочечные белки. Встраивание gp120 и gp41 в оболочку вириона происходит с помощью связывания цитоплазматического хвоста gp41 с большим транслятом Gag (р55). Существует две основных модели механизма отпочкования ВИЧ-1. Одна основана на участии липидных «плотов» (lipid rafts) на плазматической мембране, обогащенных сфинголипидами и холестеролом.
Большие белки-предшественники Gag и Gag/Pol локализованы в этих рафтах, и отпочкование вирусных частиц происходит преимущественно в этих областях. Такое прикрепление вириона к липидным рафтам обеспечивается за счет большого количества холестерола и, по-видимому, является необходимым для сборки и высвобождения вируса. Nef может влиять на усиление синтеза холестерола в клетке и его встраивание в участки мембраны, используемые вирионами.
Вторая модель носит название «гипотезы Троянских экзосом». Она, по-видимому, чаще реализуется в макрофагах и связана со сборкой ВИЧ в мультивезикулярных тельцах, от которых отпочковывается вирус. Эти тельца подходят к поверхности клетки и сливаются с плазматической мембраной, высвобождая вирус в виде экзосомы.
При отпочковании вируса мембрана клетки разрывается, а затем восстанавливается с образованием отдельной вирусной и клеточной мембран. В отпочковывании вируса участвуют и определенные клеточные белки. Например, точкий докинга для большого транслята Gag, который организует весь процесс сборки дочернего вириона, является белок р6, который называют «поздним доменом Gag (late domain)». Основное действие Gag-белка как организатора сборки вирионов реализуется на самых последних стадиях продукции вирусов в клетке.
Одним из клеточных белков, участвующих в разрыве клеточной мембраны при высвобождении вируса, является продукт гена чувствительности человека к опухолям №101 (Tsg101 - tumor susceptibility gene 101). Он связан с убиквитин-конъюгированными ферментами с одной стороны и связывает вирусный белок р6 с другой стороны. Этот клеточный белок способствует отпочкованию вируса, направляя большой транслят Gag к мембране клетки и помогая созреванию вирусных частиц и высвобождению вируса из клетки. Tsg101 также может предотвращать полиубиквитинирование и деградацию Gag.
Зрелый нуклеоид ВИЧ к моменту отпочкования напоминает конус фуллерена. Окончательное созревание белков вириона, то есть нарезание больших транслятов на дефинитивные белки вируса под действием вирусных протеаз происходит внутри отпочковывающейся частицы. Белок р2 капсида, также как и Vpu, участвуют в последних этапах сборки вирусной частицы. Как отмечали выше, у многих изолятов ВИЧ-1 важную роль в процессе сборки вирионов также могут играть циклофилины, которые связываются с белком капсида р24.
- Читать "Влияние внутриклеточных факторов на репликацию ВИЧ"
Оглавление темы "Репликация ВИЧ":- Этапы репликации ВИЧ внутри клетки
- Влияние внутриклеточных факторов на репликацию ВИЧ
- Особенности репликации ВИЧ в Т-клетках
- Особенности репликации ВИЧ в моноцитах и макрофагах
- Белок APOBEC3G как механизм резистентности к ВИЧ
- Аналоги белка APOBEC3G у животных
- Природные функции белков APOBEC
- Белок TRIM5a как механизм резистентности к ВИЧ
- Влияние цитокинов на репликацию ВИЧ
- Влияние белков ВИЧ на клетку
