Результаты испытания на человеке белков ВИЧ и векторов на основе осповируса
На людях были проведены испытания I—III фаз вакцин на основе очищенных гликопротеинов оболочки ВИЧ gp120 и gp160 или вирусных белков, экспрессированных вирусом коровьей оспы. Кроме того, начата I стадия испытания Tat-вакцины. Эти исследования, в которых приняли участие свыше 10000 добровольцев, показали отсутствие тяжелых клинических последствий.
В ранних исследованиях была продемонстрирована индукция образования низкой концентрации антител и некоторая активация клеточных иммунных реакций с использованием очищенных белков вирусной оболочки. Реакции ЦТЛ и, возможно, выработка противовирусного фактора CD8+-клеток вызывались у сероотрицательных добровольцев при иммунизации рекомбинантным белком gp160 HIV-1SF2. Низкая доза нереплицирующегося вектора вируса оспы канареек, экспрессирующего белок, сходный с белком оболочки ВИЧ-1MN, вызывала активацию ЦТЛ у сероотрицательных добровольцев.
Кроме того, исследования вакцины на основе мурамилтрипептида фосфатидилэтаноламина, содержащей гликозилированный gp120 штамма ВИЧ-1SF2, показали появление высокой концентрации нейтрализующих антител и активацию клеточных иммунных реакций у испытуемых добровольцев. Наконец, перспективные результаты были получены у ВИЧ-инфицированных лиц, иммунизированных антигенами, связанными с дендритными клетками с целью доставки, как это было описано у животных. Зрелые дендритные клетки, инфицированные вектором вируса оспы канареек, вызывали развитие мощных реакций CD4+- и CD8+-Т-клеток. Этот подход, недавно использованный в терапевтических целях, может быть эффективен и для разработки стратегией профилактики заражения и заслуживает проведения дальнейших испытаний на человеке.
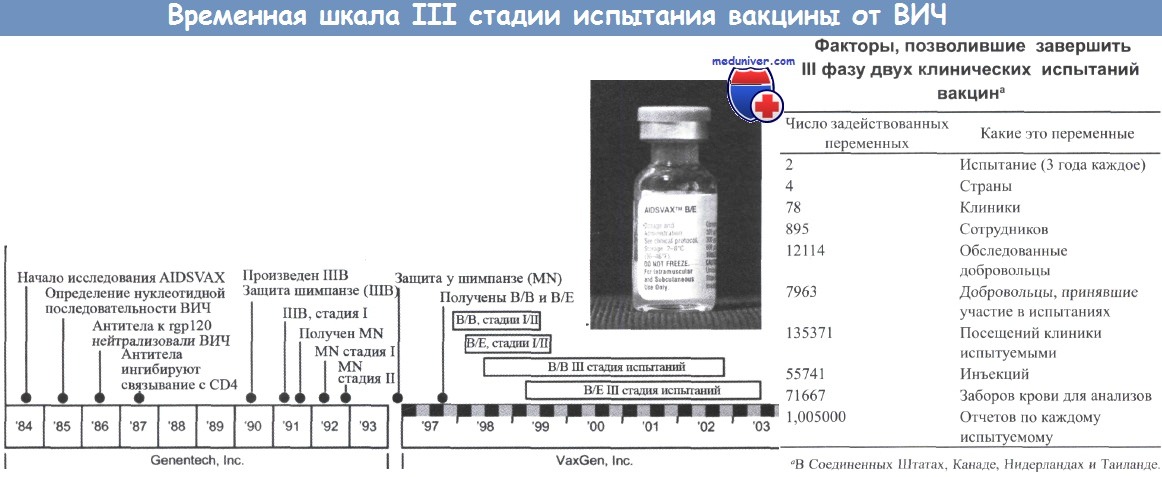
Важно отметить, что за последние 20 лет были завершены испытания III фазы только для двух вакцин (VAX003 и VAX004). Третье испытание вакцины, созданной на основе вируса оспы канареек, с последующей ревакцинацией gp120 ВИЧ субтипа В в настоящее время проходит в Таиланде. Кроме того, осуществляется тестирование идеи испытания эффективности HVTN/Merck, в котором используется вакцина на основе аденовируса, с таким же количеством предполагаемых конечных точек, как и в испытании, проводимом в Таиланде. Такое небольшое количество испытаний связано с тем, что для разработки эффективной вакцины требуется много времени.
Испытания вакцин VaxGen (VAX003 и VAX004) основаны на перспективных данных, полученных на шимпанзе, которые показали, что иммунизация рекомбинантным gp120 защищала животных от инфицирования ВИЧ-1. Факторы, которые привели к инициации и завершению этих исследований, отражают текущие требования к разработке вакцин.
III фаза первого исследования кандидатной вакцины была начата в январе 1998 г. (на примерно 5000 добровольцах в Соединенных Штатах) и не показала развития защиты при введении белка оболочки двух различных штаммов ВИЧ-1 субтипа В (Х4 лабораторного штамма и R5 клинического изолята). Несмотря на выработку нейтрализующих антител в организме людей, участвовавших в этой плацебоконтролируемой III стадии испытания, общего защитного эффекта получено не было. Вакцина не предотвращала инфицирования, которое произошло у 6,7% вакцинированных людей и 7% лиц, получивших плацебо. Между двумя группами не было обнаружено различий в концентрации вируса или в генетических характеристиках штаммов ВИЧ-1.
III стадия второго исследования, связанного с использованием бивалентного gp120 (от вирусов субтипов В и Е), была начата в Таиланде в марте 1999 г. на 2500 добровольцах. Результаты также показали отсутствие защиты от ВИЧ-инфекции. Более того, через 3 года наблюдений не было обнаружено влияния вакцины на клиническое течение заболевания у инфицированных людей. Признаков АЗУ также отмечено не было. Тем не менее III фазы этих первых испытаний позволили получить важную информацию относительно стратегий, которые необходимо использовать для проведения полного испытания эффективности вакцины против ВИЧ.
II фаза испытания другого метода вакцинации, связанного с использованием вектора на основе вируса оспы канареек (vCP205), экспрессирующего gp120, р55 и протеазу, была проведена на 435 добровольцах, которым затем проводили или не проводили ревакцинацию рекомбинантным gp120 вируса MN. Эти исследования были начаты на основании результатов ранних испытаний такого протокола иммунизации, которые показали индукцию перекрестной активности ЦТЛ.
У большинства добровольцев, получавших вакцину (94%), происходила выработка нейтрализующих антител к штамму MN, тогда как при введении одного вектора такая реакция наблюдалась только в 56% случаев. Примерно у одной трети добровольцев независимо от введения gp120 развивались реакции ЦТЛ, направленные против ВИЧ. Эти обнадеживающие результаты позволили начать III фазу испытаний в Кении в 2001 г., в которой был использован вектор другого осповируса, MVA, содержащего ген gag, а также гены множества эпитопов для ЦТЛ ВИЧ-1 субтипа А. Это испытание было остановлено в 2005 г. в связи с отсутствием индукции выраженного иммунного ответа.
Наконец, как отмечалось выше, в настоящее время в Таиланде проводится III стадия испытаний вакцины по схеме «прайм-буст» (vCP1521) с использованием рекомбинантного вектора вируса оспы канареек (ALVAC), экспрессирующего антигены gp120 ВИЧ-1 субтипа Е, связанные с трансмебранным заякоренным участком gp41 субтипа В, а также антигены gag и протеазы ВИЧ-1 субтипа В. Ревакцинация проводится с помощью бивалентной вакцины, созданной на основе гликопротеина gp120 оболочки ВИЧ-1 AIDSVAX gp120 В/Е (VaxGen), содержащей рекомбинантный gp120 субтипов В и Е.
Сколько времени требуется для разработки эффективных вакцин:
• Проведение I фазы клинических испытаний (1-2 года)
• Проведение II фазы клинических испытаний (1-2 года)
• Проведение III фазы клинических испытаний (3-4 года)
• Лицензирование, промышленное производство и распространение (1-2 года?)
• В лучшем случае: 6-10 лет от I стадии испытаний до распространения вакцины
- Вернуться в оглавление раздела "Инфекционные болезни"
Оглавление темы "Разработка вакцин от ВИЧ":- Эффективность усиления вакцин ВИЧ цитокинами
- Индукция иммунного ответа против ВИЧ на слизистых оболочках
- Синтетические адъюванты в вакцинах ВИЧ
- Эффективность лиганд для структур клеточной поверхности в вакцинах ВИЧ
- Эффективность аллоиммуногенов в вакцинах ВИЧ
- Антителозависимое усиление ВИЧ-инфекции (АЗУ) после вакцинации
- Клональная доминантность после вакцинации от ВИЧ
- Антагонизм Т-клеточных рецепторов после вакцинации от ВИЧ
- Методы проведения испытаний вакцины от ВИЧ на человеке
- Результаты испытания на человеке белков ВИЧ и векторов на основе осповируса
