Особенности репликации ВИЧ в моноцитах и макрофагах
Исследования моноцитов периферической крови показали, что внутриклеточные процессы также влияют на степень продуктивности инфекции. В этих клетках можно наблюдать специфическую внутриклеточную блокировку репликации определенных изолятов ВИЧ-1. Например, с помощью метода ПЦР было показано, что не обладающие сродством к макрофагам изоляты вируса (Х4) тем не менее проникают в макрофаги, но после этого практически их геномная РНК не подвергается обратной транскрипции. Происходит задержка обратной транскрипции и импорта преинтеграционного комплекса в ядро.
В случае моноцитов восприимчивость к ВИЧ-инфекции в большей степени зависит от их дифференцировки в макрофаги (например, под действием CD40-лиганда [CD40L]), чем от активации. Увеличение экспрессии CD4 и рецепторов к хемокинам также может влиять на восприимчивость моноцитов к инфекции ВИЧ. Недавно проведенные исследования показали, что внутриклеточная молекула APOBEC3G играет роль в этом процессе. В некультивированных свежевыделенных моноцитах крови не обнаруживают признаков обратной транскрипции после инокуляции ВИЧ-1.
Напротив, в тех же клетках, но культивированных в течение по крайней мере 24 часов, идет обратная транскрипция и появляются признаки интеграции провирусной ДНК в хромосомы клетки (4208).
Некоторые исследования позволяют предположить, что на чувствительность более дифференцированных моноцитов к восприимчивости к ВИЧ влияет взаимодействие компонентов NF-kB с транскрипционно активными гетеродимерами. В этих исследованиях представлены молекулярные доказательства того, что моноциты крови, даже экспрессирующие HLA-DR, непермиссивны в отношении ВИЧ-инфекции in vitro Так же и in vivo моноциты не чувствительны к инфицированию, пока не начнется их дифференцировка в макрофаги.
Большинство исследований показывают, что ВИЧ может инфицировать неделящиеся дифференцированные макрофаги, в которые он не только проникает, но и интегрируется в геном клетки. Полностью дифференцированные макрофаги, культивируемые в течение длительного времени, проявляют слабую чувствительность к ВИЧ-инфекции; причина этого неизвестна, но, возможно, связана с низкой экспрессией поверхностных клеточных рецепторов, облегчающих проникновение вируса в клетку.
В некоторых ранних исследованиях с помощью методов ПЦР было показано инфицирование моноцитов крови, но оно было обнаружено только в нескольких случаях и затрагивало небольшое количество клеток. С помощью вариантов метода ПЦР in situ показано, что большинство инфицированных моноцитов/макрофагов из циркулирующей крови не продуцируют вирус. Эти данные также указывают на то, что именно дифференцированные тканевые макрофаги являются преимущественным местом локализации ВИЧ-инфекции. В селезенке, например, в этих клетках безусловно происходит значимая репликация вируса.
С точки зрения цитотоксического действия вируса, макрофаги образовавшиеся из моноцитов под действием гранулоцит-макрофаг колониестимулирующего фактора (GM-CSF), проявляют чувствительность к инфекции вирусами ВИЧ биотипа R5, но процесс репликации вируса оказывается заторможенным на этапах после транскрипции. Напротив, макрофаги, дифференцировавшиеся из моноцитов под влиянием макрофаг-колониестимулирующего фактора (M-CSF), способны продуцировать большие количества ВИЧ. Такое различие зависит от относительных уровней экспрессии Scr-подобной тирозинкиназы - киназы кроветворных клеток человека Нск, которая оказалась способной связываться с вирусным белком Nef, тем самым активируя его.
Относительно слабая способность макрофагов поддерживать инфекцию ВИЧ-1, по-видимому, связана с низкими концентрациями в этих клетках киназы Нск и ССААТ-энхансер-связывающего белка бета (С/ЕВР Р). С/ЕВР b экспрессируется в клетке в виде двух изоформ большой и малой. Высокие концентрации Нск и большой изоформы С/ЕВР b обнаруживают в макрофагах, дифференцировавшихся из моноцитов под действием M-CSF В макрофагах, дифференцировавшихся из моноцитов под действием GM-CSF, как правило обнаруживают сочетание малой изоформы С/ЕВР b и низкой концентрации Нск, и в этих клетках репликация ВИЧ менее активна. Таким образом, в макрофагах большая форма С/ EBP b и достаточные концентрации киназы Нск усиливают продукцию вируса.

Необходимо отметить, что образование малой изоформы С/EBP b может происходить при инфицировании Mycobacterium tuberculosis и под действием бета-интерферона (IFN-P), что приводит к торможению репликации ВИЧ в макрофагах. Эти наблюдения говорят в поддержку ранее полученных данных о том, что присутствие в среде М-CSF во время ВИЧ-инфицирования макрофагов усиливает репликацию ВИЧ, тогда как присутствие GM-CSF подавляет продукцию ВИЧ макрофагами.
Конкретный клеточный фактор (клеточные факторы) макрофагов, отвечающий(е) за остановку репликации вируса биотипа Х4 в макрофагах, до сих пор неизвестен(ы). Некоторые вирусы, в особенности обладающие двойным сродством (X4/R5), по-видимому, могут инфицировать макрофаги и достаточно интенсивно реплицироваться в них.
Эти наблюдения говорят в поддержку того, что вирусы биотипов R5 и R5/X4 в основном не зависят от действия механизмов внутриклеточной регуляции, влияющих на Х4-вирусы. Возможно, преинтеграционные комплексы вируса биотипа Х4 после попадания в клетку оказываются в составе такой структуры, которая плохо проникает в ядро.
Макрофаги, подвергающиеся действию липополисахаридов грамотрицательных бактерий или других компонентов бактериальной стенки, становятся восприимчивыми к инфекции Х4-вирусам. Это отчасти связано с усилением экспрессии под действием микробных продуктов рецептора к хемокинам CXCR4 и с выработкой b-хемокинов, которые уменьшают инфицирование R5-вирусами.
Эксперименты с инфицированием макрофагов обезьяньим вирусом SIV выявили другие потенциальные возможности влияния оболочечных белков вириона на будущую репликацию вируса, помимо взаимодействия с поверхностными рецепторами клетки.
Было показано, что искусственно сконструированные мутантные вирусы с рекомбинантными белками оболочки, которые плохо реплицируются в макрофагах, проникают в клетки не менее эффективно, чем вирусы «дикого типа». Это указывает на то, что измененные мутацией белки оболочки вируса не влияют на нормальное сродство к макрофагам на этапах связывания с клеткой и проникновения вирусного вещества внутрь, но каким-то образом влияют на последующие этапы вживления вируса и его репликацию.
Это, возможно, связано с индукцией цитокинов, процессами трансдукции сигналов (например, после взаимодействия белков вирусной оболочки со структурами мембраны клетки) или с процессингом белка-предшественника Env. В некоторых исследованиях изолятов вирусов, обладающих сродством к макрофагам (R5) и не обладающих сродством к макрофагам (Х4), процессинг белков-предшественников Env и Gag химерного вируса был заблокирован. С другой стороны, белки-предшественники оболочки некоторых вирусов могут подвергаться неправильному процессингу. Сходные результаты, указывающие на блокировку обратной транскрипции, были получены при инфицировании Т-клеточной линии R5-изолятом ВИЧ-1, обладающим сродством к макрофагам.
После острой ВИЧ-инфекции тканевые макрофаги в свою очередь могут передавать вирус Т-лимфоцитам, но только после активации лимфоцитов. Покоящиеся CD4+-клетки, находящиеся в G0/G1-фазе и не экспрессирующие HLA-DR, не подвергаются инфицированию при совместном культивировании с макрофагами, продуцирующими вирус (S.B. Tang и J.A. Levy, неопубликованные данные).
Кроме того, для эффективной передачи вируса между клетками необходим прямой межклеточный контакт. Сходным образом индукция дифференцировки моноцитов в макрофаги, приводящая к усилению репликации ВИЧ, может зависеть от контакта моноцита с CD44-лимфоцитом, скорее всего скорее всего через взаимодействие «CD40 - CD40L». Эти данные говорят о том, что в тканях, особенно в лимфоидных органах, макрофаги могут являться основной мишенью и резервуаром ВИЧ и способствуют распространению ВИЧ в организме хозяина.
Однако эта теория не объясняет причины того, что до настоящего момента исследования, проведенные с помощью метода ПЦР in situ, не выявили присутствия большого количества инфицированных макрофагов в лимфоидной ткани.
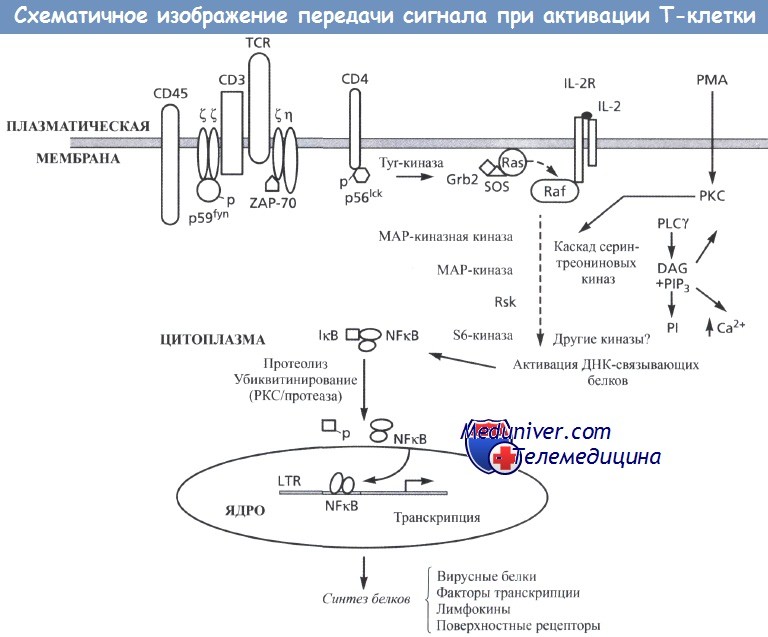
Активация начинается с генерации сигнала на плазматической мембране (верхняя часть рисунка),
опосредованной взаимодействием рецептора с лигандом, например рецептора интерлейкина-2 (IL-2R) + IL-2,
взаимодействием рецептора Т-лимфоцитов для антигена (TCR) + CD4 или поступлением молекул, способных проникать через мембрану (например, форбол миристат ацетат [РМА]).
В случае с TCR стимуляция приводит к активации тирозинкиназ (верхняя левая часть рисунка), в частности Fyn (p59fyn), ZAP-70 и Lck (p56lck).
Эти процессы, возможно, регулируется тирозин-фосфатазами, например молекулой CD45.
Активированные тирозинкиназы фосфорилируют различные цитоплазматические субстраты, которые инициируют цепь процессов по проведению сигнала.
Например, Ras (верхняя средняя часть рисунка) может активироваться после связывания с Grb2 и SOS. Это приводит к активации цитоплазматических сериновых киназ, например Raf, что вызывает активацию каскада серин-треониновых киназ (например, МАР-киназной киназы, МАР-киназы, Rsk и S6-киназ), таким образом усиливая активационный сигнал.
Каскад серин-треониновых киназ приводит к активации ДНК-связывающих белков и факторов транскрипции, которые регулируют экспрессию генов. Фосфорилирование и/или протеолиз IкВ в цитоплазме (нижняя левая часть рисунка) приводит к его диссоциации от NF-кВ и позволяет NF-кВ проникать через ядерную мембрану, а затем связываться с ДНК и активировать транскрипцию и синтез белка. Такой процесс трансдукции сигнала также может инициироваться при активации протеинкиназы С (РКС) эфирами форбола (например, РМА) (верхняя правая часть рисунка).
Активированная РКС вызывает активацию фосфолипазы Су (PLCy) с образованием вторичных мессенджеров - диацилглицерола (DAG) и фосфоинозитолтрифосфата (PIP3), что приводит к мобилизации внутриклеточного кальция (Са2+) и высвобождению фосфоинозитола (PI).
- Читать "Белок APOBEC3G как механизм резистентности к ВИЧ"
Оглавление темы "Репликация ВИЧ":- Этапы репликации ВИЧ внутри клетки
- Влияние внутриклеточных факторов на репликацию ВИЧ
- Особенности репликации ВИЧ в Т-клетках
- Особенности репликации ВИЧ в моноцитах и макрофагах
- Белок APOBEC3G как механизм резистентности к ВИЧ
- Аналоги белка APOBEC3G у животных
- Природные функции белков APOBEC
- Белок TRIM5a как механизм резистентности к ВИЧ
- Влияние цитокинов на репликацию ВИЧ
- Влияние белков ВИЧ на клетку
