Кодирование спектрина. Анкирин клеточных мембран
Stankewich et al. (1998) идентифицировали ген (11q13), кодирующий еще одну форму Р-спектрина. Синтезирующийся из этого гена 2,391 аминокислотный белок высоко гомологичен известному Р-спектрину и содержит постоянные актин-, белок4.1-, и анкиринсвязывающие домены, мембран-ассоциированные домены 1 и 2, сайтдимерной самоассоциации спектрина. Эта форма Р-спектрина мигрирует на электрофорезе в ПААГ в область 220kD с рассчитанной молекулярной массой 271,294 Da.
В отличие от своего цитоскелетного аналога эта форма бета-спектрина взаимосвязана с аппаратом Гольджи и другими органеллами клетки и представлена различным уровнем во множестве тканей организма. В большей степени белок обнаруживается в мозговой ткани, в меньшей степени - в почках, печени, яичках, гипофизе, надпочечниках, слюнных железах.
Анкирин. Этот белок после спектрина является наиболее представленным в структуре цитоскелета эритроцита и присутствует в количестве около 100000 копий на клетку (Bennett V. С соавт., 1980). С помощью анкирина сеть цитоскелетных белков прикрепляется к плазматической мембране, посредством чего регулируется деформируемость эритроцита. Активная форма анкирина способна оказывать влияние на подвижность АТБ в липидном матриксе и регулировать активность анионного транспорта.
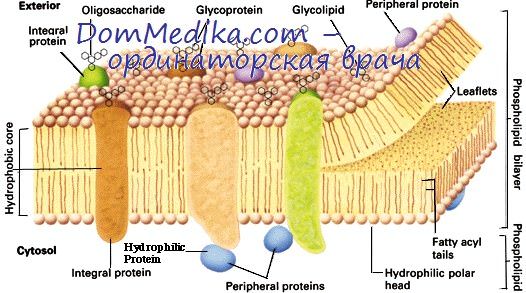
Этот процесс может представлять собой один из механизмов, посредством которых информация, кодируемая периферическими белками цитоскелета, может передаваться во внеклеточное пространство посредством модуляции трансмембранных белковых структур.
Эритроцитарный анкирин представляет собой крупную сфероподобную биполярную молекулу размером 9x10 nm и Mw=200kD. Он состоит из двух различных доменов: нейтрального спектрин-связывающего (Mw=89kD) и фосфорилированного белок 3-связывающего (Mw=62kD). На С-конце анкирина есть регуляторная область (регуляторньгё домен с Mw=55kD), содержащая несколько доменов, которые модулируют взаимосвязи анкирина со спектрином и АТБ.
Удаление домена (Mw=29kD), расположенного в N-части регуляторной области, приводит к образованию активной формы анкирина - белка 2.2 (Mw=186kD), ограни чивающего взаимодействие 2.1 анкирина с АТБ и р-спектрином. Регуляторный домен содержит аминокислотную последовательность, которая образуется альтернативным сплайсингом из 2.2 анкирина. Протеолитическое отщепление одного из доменов в регуляторной области С-концевой части под действием кальпаина-1 приводит к образованию анкирин. (белок 2.3) с низкой способностью для свызывания с АТБ.
Удаление протеолизом терминальных доменов анкирина, по-видимому, играет определенную физиологическую роль в эритроцитах, особенно при удалении старых клеток из кровеносного русла (Peter Agre, John С. Parker, 1989). Модифицированные лротеолизом формы анкирина конкурируют с белксами 2.1 за связывающие сайты на АТБ и подавляют прикрепление спектрино-актиновой сети к трансмембранным белкам. Накопление низкой молекулярной формы анкирина (белка 2.2) в мембране приводит к замещению высокоаффинных связывающих участков на цитоплазматических доменах белка 3. Удаление анкирина из цитоскелета приводит к потере способности клетки изменять форму.
- Читать далее "Содержание анкирина в клеточных мембранах. Анкирин в эритроцитах"
Оглавление темы "Структура клеточных мембран":1. Клеточные мембраны. Плазматические мембраны
2. Виды биологических мембран. Разновидности клеточных липидов
3. Мембранные белки. Структура мембранных белков клеток
4. Строение и функции белков клеточных мембран. Белки клеточных мембран эритроцитов
5. Периферические белки клеточных мембран. Спектрин клеточных мембран
6. Структура спектрина. Свойства спектрина клеточных мембран
7. Кодирование спектрина. Анкирин клеточных мембран
8. Содержание анкирина в клеточных мембранах. Анкирин в эритроцитах
9. Эритроцитарный анкириновый ген. Белок 4.1 клеточных мембран
10. Структура белка 4.1. Строение и кодирование белка 4.1
