Функции актинового цитоскелета и фокальных контактов нормальных клеток
Очевидно, что в распластывании клеток ключевую роль играет формирование адгезионных структур, обеспечивающих прикрепление концов образующихся псевдоподий к внеклеточному матриксу. Среди нескольких вариантов таких структур наиболее распространенными, встречающимися во всех типах клеток являются фокальные комплексы и фокальные контакты (последние называют также фокальными адгезия ми).
Фокальные комплексы — точечные (в диаметре менее 1 мкм) контакты на краях ламеллоподий или на концах филоподий. Эти адгезионные структуры — короткоживущие, они быстро исчезают или преобразуются в фокальные контакты.
Фокальные контакты — овальной или палочковидной формы бляшки (2—7 мкм длины), связанные с пучками актиновых микрофиламентов. Эти специализированные адгезионные структуры обеспечивают стабильные контакты клетки с внеклеточным матриксом. Механическая связь этих контактов с ак-тиновыми микрофиламентами цитоскелета, обладающими контрактильными свойствами, создает центростремительное натяжение прикрепившихся псевдоподий. Это натяжение обеспечивает распластывание клетки, а также ее способность к передвижению — локомоции.
В распластанной клетке фокальные контакты представляют собой множественные дискретные участки прочного прикрепления клетки к внеклеточному матриксу, расположенные на базальной клеточной поверхности, преимущественно на периферии клетки вблизи ее активных краев. В этих небольших участках формируются специализированные адгезионные структуры.
В фокальном контакте сосредоточены особые белки — интегрины, обладающие способностью специфически связываться с различными белковыми компонентами внеклеточного матрикса — коллагенами, фибронектином, ламинином и др. Интегрин состоит из а- и b-субъединиц, которые могут связываться в различных сочетаниях, формируя более 20 разных типов интегринов. Различные сочетания а- и b-субъединиц определяют специфичность связывания интегрина с тем или иным белком внеклеточного матрикса.
Некоторые из интегринов могут связываться лишь с каким-либо одним белком матрикса (например, интегрин а5b1 только с фибронектином, а интегрин a6b1 —только с ламинином), но большинство интегринов способно связываться сразу с несколькими белками матрикса.
Таким образом, интегрины выполняют роль рецепторов, механически связывающих клетку с соответствующими лигандами — белками внеклеточного матрикса. Перемещаясь в плоскости клеточной мембраны, интегриновые рецепторы образуют кластеры (скопления) в формирующихся фокальных контактах. Кластеризация, а также конформационные изменения интегриновых рецепторов, влияющие на их аффинность (способность связываться со своими лигандами), определяют стабильность интегринопосредованных контактов клетки с внеклеточным матриксом.
Интегриновый рецептор является трансмембранным белком: его молекула «прошивает» плазматическую мембрану клетки и, таким образом, обладает как внеклеточной, так и цитоплазматической частями (доменами). С белками матрикса связывается внеклеточный домен интегрина, тогда как его цито-плазматический домен ассоциирован с субмембранной бляшкой, состоящей из более чем 50 различных белков, упакованных в плотный комплекс. Среди этих белков есть как структурные элементы (белки винкулин, паксилин, талин и др.), так и сигнальные белки (например, киназа FAK). Эта белковая бляшка соединена с концом пучка актиновых микрофиламентов.
Тем самым интегриновые рецепторы, связавшиеся с белками матрикса, оказываются заякоренными изнутри клетки микрофиламентами, что обеспечивает структурную связь внеклеточного матрикса с актиновым цитоскелетом прикрепившейся клетки. Поскольку пучки микрофиламентов (их называют также стресс-фибриллами), заякоривающие интегриновые рецепторы, обладают сократимостью, клетка находится под воздействием центростремительных сил натяжения. Эти силы — необходимое условие для поддержания структуры фокального контакта: при значительном ослаблении сил натяжения (например, путем ингибирования сократимости актиновых микрофиламентов) фокальные контакты быстро разбираются.
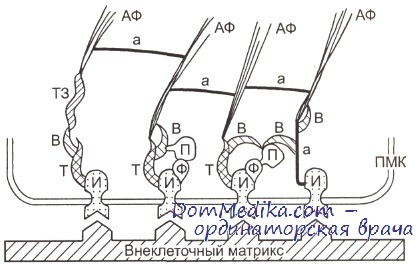
ПМК — плазматическая мембрана клетки; И — интегриновый рецептор; Т — талин; Ф — протеинкиназа фокального контакта; П — паксиллин; В — винкулин; ТЗ — тензин; а — а-актинин; АФ — пучки актиновых микрофиламентов.
Наоборот, при возрастании сил натяжения в клетке (например, при растягивании эластического внеклеточного матрикса, к которому прикреплены клетки, или при движении потока жидкой среды) размеры фокальных контактов увеличиваются.
Таким образом, индивидуальные фокальные контакты функционируют как механосенсоры: увеличиваются в размерах пропорционально приложенному к ним натяжению и распадаются, когда это напряжение ослабевает. Когда силы натяжения в каких-то слишком увеличившихся фокальных контактах становятся избыточными и грозят оторвать их от внеклеточного матрикса, клетка включает особый механизм: к этим фокальным контактам направляются плюс-концы растущих микротрубочек, приходят в соприкосновение (на расстояние 50 нм) с контактами и вызывают избирательное подавление сократимости тех стресс-фибрилл, которые связаны с этими контактами.
В результате фокальные контакты деградируют. По-видимому, по микротрубочкам транспортируются какие-то компоненты, которые локально ингибируют стресс-фибриллы чрезмерно увеличившихся фокальных контактов.
Крайне важно, что связь между распластанной клеткой и внеклеточным матриксом не только структурная, но и функциональная: связывание интегринового рецептора со своим лигандом «включает» цепь передани внутриклеточных сигналов, достигающих ядра и индуцирующих экспрессию определенных генов.
Передача сигналов в клетке представляет собой прямое взаимодействие специфических белков в строго определенной последовательности. Основными участниками являются разные типы киназ — ферментов, катализирующих перенос фосфата от молекулы АТФ на аминокислотные остатки (тирозин, серии или треонин) различных белков. Механизм передачи сигнала базируется на специфической ассоциации белков и их фосфорилировании (или дефосфорилировании). Фосфорилирование белков-мишеней ведет к мгновенному изменению их конфигурации и свойств. Результатом является последовательная активация белков сигнальной цепи, обеспечивающая передачу сигнала от рецептора клеточной поверхности внутрь клетки до ее генетического аппарата в ядре.
Связывание интегринового рецептора с его белковым лигандом во внеклеточном матриксе вызывает аутофосфорилирование и активацию тирозинкиназы фокальных контактов — FAK (Focal Adhesion Kinase), прямо связанной с цитоплазматическим доменом (3-субъединицы интегрина. Активированная FAK ассоциируется с подмембранной тирозинкиназой Src, инициируя ее киназную активность и кооперируясь с ней в фосфорилировании белков фокального контакта — паксиллина и тензина. Сигнал от FAK передается также на белки семейства Ras, приводя их в активированное состояние. Последние стимулируют активность цитоплазматических киназ семейства Raf, которые в свою очередь активируют каскад MAP (mitogen activated protein)-киназ.
МАР-киназы являются ключевыми регуляторами клеточного цикла. Конечные продукты МАР-киназного каскада переходят из цитоплазмы в ядро клетки, где они фосфорилируют и активируют целый ряд транскрипционных факторов (ядерных белков, которые, связываясь с определенными генами, регулируют их активность), стимулирующих экспрессию ряда генов, включая те, которые побуждают клетку к делению.
Таким образом, результатом проведения сигналов от интегриновых рецепторов, связанных со своими лигандами во внеклеточном матриксе, по Ras — Raf— МАР-киназной сигнальной цепи является экспрессия специфических генов, стимулирующих пролиферацию клеток.
Помимо митогенной сигнальной цепи Ras — Raf — МАР-киназный каскад, задействованные интегриновые рецепторы «включают» сигнальную цепь, которую условно можно назвать «морфогенной». Она передает сигнал от активированного Ras на G-белки семейства Rho, изменение активности которых приводит к реорганизации цитоскелетных структур (влияя, в частности, на полимеризацию актина и сократимость актиновых микрофиламентов), опосредованно влияя таким образом на сборку/разборку фокальных контактов.
Митогенная сигнальная цепь обеспечивает проведение сигнала не только от задействованных интегриновых рецепторов, но также от специфических цито-кинов — растворимых факторов роста (growth factors). Последние, связываясь со своими рецепторами на поверхности клеток, вызывают аутофосфорилирование и активацию цитоплазматического домена рецептора, что индуцирует митогенный сигнал с последующим его прохождением по цепи Ras—Raf — МАР-киназный каскад до клеточного ядра. Однако реализация этого сигнала осуществляется только в клетках, прикрепившихся к внеклеточному матриксу: в случае открепления клетки митогенный сигнал от рецепторов факторов роста блокируется на одной из промежуточных киназ МАР-киназного каскада и клетка не может пролиферировать.
Таким образом, связывание интегринов с внеклеточным матриксом не только продуцирует митогенный сигнал, но также является необходимым условием для митогенного действия растворимых факторов роста. Кроме того, в клетках, открепившихся от матрикса, аккумулируется продукт гена — опухолевого супрессора К1Р1, блокирующий вхождение клеток в S-фазу клеточного цикла.
Утрата контактов с внеклеточным матриксом не только лишает клетки способности пролиферировать. Многие открепившиеся клетки подвергаются апоптозу (который в данном случае называется аноикисом). Аноикис возникает в результате активации гена — опухолевого супрессора ТР53. Последний осуществляет одновременно активацию гена — супрессора ВАХ (индуцирующего апоптоз) и ингибирование протоонкогена BCL2 (блокирующего апоптоз). В результате активация ТР53, вызванная откреплением клеток от матрикса, генерирует мощный апоптогенный сигнал. Может быть и другая причина аноикиса. В клетках, прикрепленных к матриксу, одна из сигнальных цепей (от активированного Ras) активирует киназу Akt, которая предохраняет клетки от апоптоза. Открепление клеток от матрикса выключает эту сигнальную цепь.
Описанные механизмы лежат в основе феномена, называемого субстратной зависимостью размножения, присущей нормальным клеткам: последние могут выживать и размножаться, только будучи прикрепившимися и достаточно распластанными на поверхности внеклеточного матрикса; в полужидкой среде суспендированные клетки не размножаются и могут подвергнуться аноикису.
Таким образом, фокальные контакты являются не только адгезионными структурами, механически связывающими клетки с внеклеточным матриксом, но также трансдукторами разнообразных внутриклеточных сигналов, обеспечивающих сохранение клетками способности к выживанию и их пролиферативной активности.
Полностью распластавшаяся клетка постоянно испытывает изометрическое напряжение, которое является результатом взаимодействия двух сил: центростремительного натяжения стресс-фибрилл, заякоренных в фокальных контактах, и противодействующей этому натяжению силы адгезии клетки к внеклеточному матриксу. Этот баланс механических сил определяет не только степень распластывания клетки, но также ее функциональную и проли-феративную активность. Так, например, в условиях дефицита или неравномерного («островкового») распределения во внеклеточном матриксе белковых компонентов, необходимых для адгезии клеток данного типа, последние не в состоянии достигнуть полного распластывания, и в них соответственно падает изометрическое напряжение. Это приводит к торможению пролиферации и в некоторых случаях даже к аноикису клеток.
Нарушаются также синтетические процессы, например, у эпителиоцитов возрастает синтез некоторых протеаз и т. д. Усиление изометрического напряжения клеток, вызываемое периодическими сгибаниями или растягиванием эластического матрикса, к которому клетки прикреплены, стимулирует не только рост фокальных контактов, но также пролиферацию клеток, активацию в них ферментных систем и трансмембранных ионных каналов.
Клетки реагируют не только на деформации, возникающие в матриксе, но даже на его механическую жесткость — своего рода «сопротивление материала». Например, фибробласты на особо ригидном внеклеточном матриксе могут начать синтезировать особую форму актина — гладкомышечный актин, несколько отличающийся от типичного для фибробластов немышечного актина. Такие фибробласты называют миофибробластами. Гладкомышечный актин в составе пучков микрофиламентов придает последним более сильную контрактильность, а заякоренность таких стресс-фибрилл в фокальных контактах повышает напряжение клетки, распластавшейся на матриксе.
Все эти реакции опосредуются задействованными интегриновыми рецепторами, поэтому последние рассматриваются как трансдукторы не только биохимических, но и механических сигналов от внеклеточного матрикса. Возможно, что деформации или механические свойства матрикса изменяют конформацию цитоплазматических доменов интегринов, инициируя этим внутриклеточную передачу сигналов.
Клетки в свою очередь оказывают механическое воздействие на внеклеточный матрикс. Центростремительное натяжение стресс-фибрилл через фокальные контакты передается на матрикс, который в результате этого претерпевает реорганизацию в виде образования тонких складок, ориентации волокон и т. п. Такая реорганизация происходит при регенеративных процессах (заживлении ран), формировании костной ткани и др.. Особо сильное ремоделирующее воздействие на матрикс оказывают миофибробласты в связи с большим напряжением, развиваемым этими клетками.
Таким образом, изометрическое напряжение, испытываемое клетками, распластавшимися на внеклеточном матриксе, служит мощным регулятором формы и функциональной активности клеток, а также влияет на организацию самого матрикса.
- Читать "Актиновый цитоскелет и фокальные контакты трансформированных опухолевых клеток"
Оглавление темы "Адгезия клеток":- Микротрубочки - структура, функции
- Стадии распластывания нормальных клеток - механизмы
- Особенности распластывания трансформированных опухолевых клеток - механизмы
- Функции актинового цитоскелета и фокальных контактов нормальных клеток
- Актиновый цитоскелет и фокальные контакты трансформированных опухолевых клеток
- Локомоция клеток - стадии, механизмы
- Особенности локомоции трансформированных опухолевых клеток
- Топографические реакции клеток - виды
- Особенности топографических реакций трансформированных опухолевых клеток
- Адгезионные взаимодействия клеток друг с другом - механизмы
