Супрессоры опухолевого роста - антионкогены. Классификация
Деление клетки находится под сложным контролем систем позитивных и негативных регуляторов. Известно немногим более 30 антионкогенов, нарушения же в них обнаруживают примерно в 90 % опухолей человека. Спектр генетических изменений в каждой конкретной опухоли индивидуален, но тем не менее наблюдаются определенные закономерности в нарушениях отдельных генов или их кластеров, позволяющие связывать их с развитием или характером прогрессирования той или иной патологии.
Согласно современной классификации, гены — супрессоры опухолевого роста подразделяют на три группы: хранители клеточного цикла (ХКЦ), гены общего контроля (ГОК) и гены, поддерживающие «среду обитания» (ГСО).
Гены ХКЦ напрямую вовлечены в его регуляцию. Их белковые продукты способны сдерживать опухолевую прогрессию, ингибируя процессы, связанные с делением клетки.
Гены второй группы (ГОК) поддерживают стабильность генома, прямо или косвенно участвуя в репарации повреждений ДНК. ГОК можно разделить на две подгруппы: гены, непосредственно участвующие в образовании репарационных комплексов, и гены, продукты которых ответственны за организацию задержек клеточного цикла, необходимых для репарации ДНК.
Продукты генов первой подгруппы ГОК образуют многокомпонентные репарационные комплексы, в которые входят ДНК-связывающие белки, ДНК-хеликазы, эндонуклеазы и т. д. Мутации в этих генах приводят к развитию злокачественных новообразований по крайней мере в несколько этапов. Нарушение одного аллеля, как правило, не вызывает выраженных негативных проявлений.
Инактивация второго аллеля обусловливает дестабилизацию генома клетки при отсутствии явных признаков опухолевой трансформации. Однако все последующие мутации, в том числе генов, отвечающих за регуляцию клеточного цикла, накапливаются и провоцируют развитие злокачественного процесса.
Классификация антионкогенов
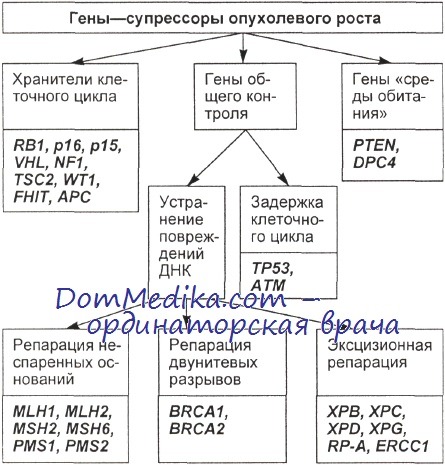
К генам второй подгруппы ГОК относится широко известный ген-супрессор ТР53, мутации или делеции которого наблюдают в опухолях практически всех типов, особенно в терминальных стадиях развития заболевания. Ген ATM принадлежит семейству фосфатидилинозитол-3-киназ и участвует в организации репарационной задержки клеточного цикла в ответ на неспецифические повреждения ДНК через активацию ТР53.
В случае повреждения обоих аллелей гена невозможна задержка клеточного деления между фазами G1/S, в S-фазе и фазе G2/M, в результате чего повышается уровень нестабильности генома и возникают хромосомные аберрации.
Предположение о существовании третьего типа генов-супрессоров опухолевого роста впервые возникло при сопоставлении гистологической картины опухолевого процесса и мутаций, которые были выявлены у пациентов с синдромом ювенильного полипоза. Начальные повреждения у этих больных происходят в клетках стромы, а не в клетках паренхимы, которые они окружают. Именно измененные клетки стромы и являются инициатором злокачественного процесса.
Потеря функции ГСО в клетках стромы, по-видимому, приводит к аномальному функционированию белков внеклеточного матрикса, поверхностных клеточных маркеров, адгезионных молекул и факторов роста. Такое измененное микроокружение создает условия для роста опухолевых клеток, что и обусловливает злокачественную трансформацию клеток паренхимы. Терминальные мутации генов этих трех групп (ХКЦ, ГОК, ГСО) вызывают развитие хорошо охарактеризованных синдромов или определенных форм опухолей, в то время как повреждение конкретного гена в различных тканях (соматическая мутация) может привести к развитию опухолей разных типов.
В настоящее время внимание клеточных онкобиологов приковано к исследованию генов так называемого клеточного хозяйства, многие из которых участвуют в супрессии опухолевого роста. Одними из таких генов-супрессоров являются представители семейства кавеолинов — основные компоненты кавеол, везикулярных мембранных структур, организующих в клетке белковый транспорт, а значит, и сигнальную трансдукцию. Основная изоформа, белок CAV-1, содержит специфические домены, при соединении с которыми транспортируемые сигнальные белки теряют активность.
Список ингибируемых кавеолином белков обширен. Среди них факторы роста и их рецепторы, тирозинкиназы (в частности, SRC/FYN, РКС) и другие G-белки. CAV-l обладает выраженными антипролиферативными и проапоптотическими свойствами. Это в немалой степени объясняется тем фактом, что его экспрессия оказывает негативное влияние на экспрессию гена сурвивина — одного из самых сильных антиапоптотических факторов, активно изучаемого в качестве одной из самых перспективных мишеней для действия химиотерапии.
В отдельных статьях на нашем сайте рассмотрены наиболее известные в настоящее время гены—супрессоры опухолевого роста, возможные механизмы их действия, участие в развитии пролиферативных процессов и гемобластозов.
- Читать "Характеристика гена PML (promyelocytic leukemia gene) - функции"
Оглавление темы "Интерфероны. Онкогены":- Антипролиферативное действие интерферонов - механизмы
- Влияние интерферона на дифференцировку клеток
- Побочные эффекты лечения интерферонами - осложнения
- Лечение заболеваний интерферонами - применение ИФН
- Общая характеристика онкогенов
- Онкогены в системе передачи сигналов стимулированных PDGF
- Тирозинкиназы и G-белки в системе передачи сигналов
- Ядерные протоонкогены и факторы транскрипции в системе передачи сигналов
- Супрессоры опухолевого роста - антионкогены. Классификация
- Характеристика гена PML (promyelocytic leukemia gene) - функции
