Белки теплового шока (HSPs — heat-shock proteins) в апоптозе (гибели) клеток
Белки теплового шока (HSPs — heat-shock proteins) сохранили свое исторически сложившееся название, хотя по сути являются стрессактивируемыми белками, а транскрипция генов теплового шока активируется разнообразными стрессорными воздействиями на клетки. Они чрезвычайно широко распространены в природе, и значительная структурная гомология этих белков, выделенных из клеток прокариот, растений и животных, свидетельствует об их консерватизме, связанном с важностью их функций для существования живых систем.
Вне клеточного стресса HSPs конститутивно присутствуют в клетках на некотором базальном уровне, достаточном для выполнения ими нескольких функций. Во-первых, HSPs обладают способностью образовывать гетеродимеры со многими внутриклеточными белками и осуществлять их адресный транспорт через мембраны. Так, большинство митохондриальных белков синтезируется на цитоплазматических полисомах и затем транспортируется в митохондрии при участии HSPs.
Второй, не менее важной, функцией HSPs является их участие в приобретении «молодым» белком корректной третичной структуры — фолдинг (сворачивание, от англ. —fold): HSPs образуют пространственную матрицу для «конформационного созревания» вновь синтезированных белков. Такое «попечительское» отношение к вновь синтезированным белковым молекулам дало белкам теплового шока название «шапероны» (от франц. chaperon — лицо, сопровождающее молодую особу). Как логическое продолжение этой функции — их участие в осуществлении рефолдинга поврежденных и денатурированных белков.
За счет собственной АТР-азной активности HSPs способны изменять свою конформацию. Процесс рефолдинга начинается со связывания шаперона с поврежденной белковой молекулой и АТР-зависимого разворачивания последней до а-спиральной вторичной структуры с последующей попыткой ее рефолдинга и ренатурации полноценного продукта. Если желаемого эффекта нет, поврежденная молекула направляется в протеасому, осуществляющую ее деградацию. Эта функция посттрансляционной репарации белков определяет роль HSPs в условиях клеточного стресса, при котором конформационные повреждения белковых молекул приобретают массовый характер.
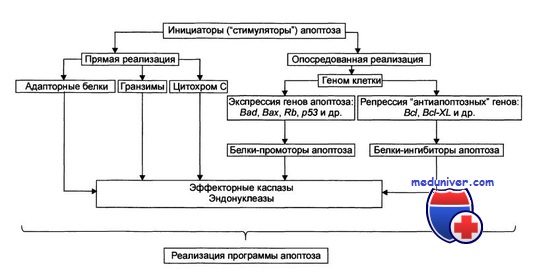
Кроме функций молекулярных шаперонов, белки теплового шока участвуют в выполнении еще по крайней мере двух внутриклеточных процессов: презентации антигенных пептидов на клеточной поверхности (трансмембранный перенос пептидов и CD91 -опосредованная рецепция) и регуляции активности некоторых цитозольных белков, в том числе проапоптогенных факторов. Осуществление последней из приведенных выше функций HSPs представляет особый интерес, поскольку модулирующее влияние HSPs на реализацию процессов апоптоза надежно документировано, однако механизм подобной защиты клеток от гибели окончательно не выяснен.
Существует несколько групп HSPs, различающихся по средней молекулярной массе и функциям — это HSP-10, -27, -40, -60, -70, -90, -110 и др. HSP-70 и -90 относят к шаперонам, а низкомолекулярные HSP-10, -27 и -40 — к кошаперонам — кофакторам, необходимым для функционирования шаперонов. Отдельного наименования «шаперонины» удостоены HSP-60: эти белки выполняют функцию шаперонов и характерны для прокариот, а в эукариотических клетках локализованы в митохондриях и растительных пластидах, имеющих, вероятно, исторически бактериальное происхождение.
Показано, что HSP-70 могут связывать цитоплазматический проапоптогенный фактор Apaf-1, блокируя процесс активации каспазы-9 на уровне формирования апоптосом, а взаимодействуя с высвобождающимся из пермеабилизованных митохондрий белком AIF, предотвращают каспазанезависимый апоптоз. Apaf-1-блокирующий эффект может осуществлять и HSP-90. Кроме того, HSP-27 способны дополнительно препятствовать сборке апоптосом, связывая поступающий в цитозоль цитохром с. Напротив, митохондриальный HSP-60 в цитозоле способен формировать шаперонный комплекс с HSP-10 и цитохромом с.
Этот комплекс может играть роль Apaf-1-независимой матрицы для альтернативного апоптосомам dATP-опосредованного процессинга прокаспазы-3 в активный фермент.
- Читать "Транскрипционные факторы NF-кВ и р53 в апоптозе (гибели) клеток"
Оглавление темы "Апоптоз клеток":- Роль каспаз в апоптозе клетки. Функции каспаз
- Рецепторы смерти клетки при апоптозе. Функции рецепторов смерти
- Роль митохондрий в апоптозе (гибели) клеток
- Роль факторов роста в апоптозе (гибели) клеток
- Роль гранзимов в апоптозе (гибели) клеток
- Белки теплового шока (HSPs — heat-shock proteins) в апоптозе (гибели) клеток
- Транскрипционные факторы NF-кВ и р53 в апоптозе (гибели) клеток
- Протеасомы в апоптозе (гибели) клеток
- Cигнальные системы гибели и выживания клетки при апоптозе
- Программированная гибель клеток (апоптоз) в цитостатической терапии
