Дифференциация стволовых кроветворных клеток - механизмы
Обязательное свойство стволовых кроветворных клеток (СКК) — способность к мультилинейным дифференцировкам. Выяснение этой их компетентности потребовало десятилетий очень упорных и разнообразных исследований. Действительно, определение, данное стволовым кроветворным клеткам (СКК), является чисто функциональным, основанным на ее биологических свойствах. Это связано с тем, что морфологические характеристики стволовых кроветворных клеток (СКК) крайне невыразительны, что объясняется незрелостью клеток, а внешне выражается в высоком ядерно-цитоплазматическом отношении, гомогенности хроматина и отсутствии четких признаков дифференцировки.
Морфологически эти клетки выглядят как недифференцированные бласты или малые лимфоциты с тонкой структурой хроматина. В костном мозге содержание последних измеряется процентами, тогда как доля стволовых кроветворных клеток (СКК) в сотни раз меньше. При отсутствии возможности прямого морфологического определения стволовых кроветворных клеток (СКК) доказательства допустимости у этой очень редкой клетки тех или иных направлений дифференцировки является сложной задачей. Всегда приходится принимать во внимание возможность существования моно-, ди-или олигопотентных стволовых кроветворных клеток (СКК), способных дифференцироваться только в одну, две или в несколько, но не все кроветворные линии клеток.
К настоящему времени дифференцировочный потенциал стволовых кроветворных клеток (СКК) окончательно доказан. На клонированных популяциях, т. е. происходящих из одной кроветворной клетки, была прослежена дифференцировка стволовых кроветворных клеток (СКК) в культуре по всем направлениям гемопоэза. Клетка, несущая индивидуальный маркер (например, вызванные радиацией хромосомные перестройки или искусственно введенный чужеродный ген), способна давать потомков, принадлежащих к миелоидным и лимфоидным линиям кроветворных клеток. Еще более убедительны данные восстановления мультилинейного кроветворения у мышей при введении только одной, индивидуально отобранной стволовыми кроветворными клетками (СКК). Аналогичные выводы сделаны и для человека.
Например, при хроническом миелолейкозе вся патологическая популяция клеток имеет клональное происхождение, что установлено по наличию во всех клетках только одной и той же материнской или отцовской Х-хромосомы. Между тем происходящие из этой единственной клетки потомки принадлежат ко всем линиям кроветворных дифференцировок. Из этих данных следует, что именно стволовые кроветворные клетки (СКК) могут являться основной мишенью для возникновения лейкозов, которые, как правило, представляют собой моноклональные заболевания.
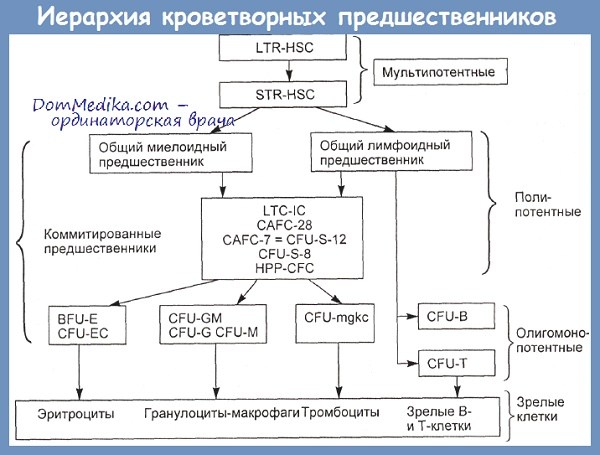
Современное представление о дифференцировке стволовой кроветворной клетки (СКК) приведено на схеме.

Кроветворная система имеет иерархическую структуру с одним исходным звеном. Последовательное созревание стволовых кроветворных клеток (СКК) под контролем дистантно действующих факторов/гормонов приводит к образованию всех зрелых клеток крови, однако механизм выбора стволовой клеткой направления дифференци-ровки остается неясным. Постепенно становятся известны молекулярные события, происходящие при дифференцировке. Самая ранняя СКК коэкспрессирует гены различных, в том числе некроветворных, линий дифференцировки. Решающую роль в этом играет структура хроматина, позволяющая РНК-полимеразе начать транскрипцию.
Такая открытая структура хроматина, видимо, сохраняется у стволовых кроветворных клеток (СКК) или последняя имеет возможность ремоделирования хроматина, необходимого для транскрибирования генетических программ. Коммитирование СКК зависит от последовательной активации ядерных факторов транскрипции, начиная с SCL/TAL-1 и LM02, с последующим включением более линейно-рестриктированных/направленных транскрипционных факторов GATA1 или PU.l. SCL при этом выполняет роль регулятора программ развития СКК. Блокирование этого гена останавливает кроветворную дифференцировку на уровне общего предшественника кроветворных и эндотелиальных клеток гемангиобласта.
Коэкспрессируемый с SCL антиген CD41 в эмбриогенезе является маркером расхождения линий дифференцировки дефинитивных (взрослых) гемопоэтических предшественников на стадии после гемангиобласта. По мере продвижения по иерархическому кроветворному дереву неизменно сужается набор экспрессируемых кроветворных генов, необходимых для широкого выбора допустимых путей дифференцировки. На основании изучения более 25 000 последовательностей ДНК было показано, что мультипотентный предшественник коэкспрессирует гены лимфоидных и миелоидных дифференцировок. Общий миелоидный предшественник коэкспрессирует миелоэритроидные гены, но не лимфоидные. Общий лимфоидный предшественник коэкспрессирует гены Т-, В-клеток и NK, но не миелоидные гены. Иными словами, постепенное снижение транскрипционной доступности генов, необходимых для мультилинейных дифференцировок, является основой прогрессивного коммитирования, ограничения выбора доступных для предшественников дифференцировок (более подробно транскрипционные факторы гемопоэза описаны далее).
Механизмы, ответственные за активацию факторов транскрипции, остаются неизвестными. Доказано, что коммитирование стволовых кроветворных клеток (СКК) необратимо. Изящные эксперименты с перекрестной сменой рецепторов у коммитированных предшественников показали, что интродукция гена рецептора эритропоэтина в ранний макрофагальный предшественник не меняет судьбу последнего: эритропоэтин вызывает макрофагальную дифференцировку. Наоборот, введение гена рецептора макрофагального ростового фактора (M-CSF) в эритроидный предшественник приводит к его эритроидной дифференцировке под влиянием цитокина чужой специфичности, M-CSF. Кроме того, рецепторы другого цитокина — фактора роста СКК могут фосфорилировать рецепторы эритропоэтина и вызывать тем самым пролиферацию и созревание КОЕ-Э. Эти данные доказывают не только необратимость коммитирования СКК, но и возможную неспецифичность внутриклеточных сигнальных систем.
Специфичность внешнего сигнала обеспечивается взаимодействующим с ним рецептором, тогда как внутренняя цепь может оказаться общей для разных рецепторов.
Существуют две основные модели механизма коммитирования стволовых кроветворных клеток (СКК). Согласно стохастической модели, случайный, нерегулируемый выбор осуществляется СКК в соответствии с ее внутренними свойствами, вне зависимости от потребности в данный момент организма в клетках той или иной линии дифференцировки. Детерминистическая модель основана на том, что выбор направления дифференцировки осуществляется в соответствии с внешним запросом на клетки соответствующего вида. Обе модели имеют как подтверждающие, так и противоречащие им данные.
Стохастическую модель подтверждает независимость выбора направления дифференцировки даже ранними полипотентными потомками стволовых кроветворных клеток (СКК). Так, в селезенке облученных мышей КОЕ-С способны образовывать колонии четырех основных типов: эритроидные, гранулоцитарные, мегакариоцитарные и смешанные. Распределение колоний по типу дифференцировок следующее: две трети колоний эритроидные, остальные миелоидные. Содержание ранних эритроидных предшественников — БОЕ-Э, малочувствительных к гормону терминальной дифференцировки эритропоэтину, оказывается одинаковым как в эритроидной колонии, в которой образуются только эритроциты, так и в миелоидной, в которой эритроциты не образуются вообще. То же верно и для миелоидных колоний. Частота БОЕ-Э в костном мозге не меняется ни у мышей с полицитемией, при которой эритропоэз практически полностью заблокирован, ни при фенилгидразиновой анемии, когда эритропоэз резко усилен. Эти данные служат убедительным доказательством независимости направления дифференцировки СКК от существующего запроса. В качестве аргумента против этой модели часто приводилась неэффективная работа кроветворной системы, продуцирующей неиспользуемые избытки клеток-предшественниц.
Легко понять, что это возражение не очень весомо. Ранних предшественников образуется очень немного, и экспансия их определяется запросом. Неиспользованные предшественники удаляются из системы либо путем апоптоза, либо в результате созревания без существенной амплификации.
Детерминистическая модель допускает, что и внешние факторы оказывают влияние на выбор дифференцировки стволовых кроветворных клеток (СКК). Доказано, что на СКК в минимальных количествах экспрессированы рецепторы основных цитокинов. Можно предполагать, что в зависимости от концентрации соответствующего фактора происходит выбор дальнейшей судьбы СКК, но исчерпывающих доказательств, верности детерминистической модели получить не удалось. К тому же существуют данные, которые косвенно ей противоречат. Например, для мобилизации СКК в циркуляцию используют огромные нефизиологические концентрации некоторых цитокинов, в том числе линейно специфичных, таких как гранулоцитарный колониестимулирующий фактор (G-CSF). Несмотря на это, никакого сдвига дифференцировок мобилизованных СКК в направлении гранулоцитопоэза не происходит. В целом следует учесть, что эти модели необязательно альтернативны, и, возможно, они обе реализуются при регуляции линейного коммитирования СКК.
Далее коротко анализируются основные направления дифференцировок уже необратимо коммитированных потомков стволовых кроветворных клеток (СКК).
- Читать "Механизмы эритропоэза и его регуляция"
Оглавление темы "Гемопоэз":- История изучения кроветворения - гемопоэза
- Стволовая кроветворная клетка (СКК) - история изучения, свойства
- Дифференциация стволовых кроветворных клеток - механизмы
- Механизмы эритропоэза и его регуляция
- Лейкопоэз (гранулоцитопоэз) - этапы, механизмы, регуляция
- Лимфоцитопоэз - этапы, механизмы, регуляция
- Факторы транскрипции гемопоэза - транскрипционный контроль
- Tal-1/SCL - функции фактора транскрипции гемопоэза
- Rbtn2/LMО2 - функции фактора транскрипции гемопоэза
- GATA1, GATA2 и GATA3 - функции факторов транскрипции гемопоэза
