Рецепторы смерти клетки при апоптозе. Функции рецепторов смерти
Для восприятия клеткой специфического внешнего сигнала смерти на ее поверхности имеются специальные рецепторы, относящиеся к суперсемейству TNF-подобных рецепторов (TNFRSF— Tumor Necrosis Factor Receptor Superfamily), которое к настоящему времени насчитывает более двух десятков членов: TNFR-1, TNFR-2, LTA-R, LTB-R, АРО-1, DR3, DR4, DR5, DR6, CD27, CD30, ОХ40 и др.
CD95 является трансмембранным гликопротеидом, состоит из одной полипептидной цепи, имеет мол. м. 45 000—52 000, содержит три экстрацеллюлярных цистеинобогащенных рецепторных домена, трансмембранный домен и цитоплазматический домен, называемый «доменом смерти» (DD — Death Domain).
CD95 в рамках суперсемейства отнесен к TNFRSF6. Его природный лиганд (CD95L, FasL, TNFSF6) является мембраноассоциированным белком, имеющим в качестве специфического участка связывания с рецептором гомотримерный сайт. Экспрессия CD95L на поверхности клеток не является конститутивной: экстернализация молекул лиганда осуществляется для выполнения киллерных функций и/или для аутокринной индукции апоптоза.
Мембраносвязанный лиганд достаточно быстро элиминируется с клеточной поверхности матриксными металлопротеиназами, значительно теряя активность в растворимой форме. Взаимодействуя с рецептором, CD95L вызывает его тримеризацию за счет одновременного связывания гомотримерного участка лиганда с экстрацеллюлярными доменами трех близко расположенных молекул CD95. Это приводит к кластеризации внутриклеточных доменов смерти.
В тримеризованном состоянии домены смерти рекрутируют находящийся в цитоплазме адаптор FADE) (Fas-Associated Death Domain protein) — белок, имеющий на одном конце молекулы домен смерти DD, а на другом—домен эффектора смерти DED (Death Effector Domain). Первый служит для связывания FADD с цитоплазматическим DD доменом CD95, а второй — для специфического связывания с аналогичным доменом цитозольного проэнзима прокаспазы-8. Так формируется надмолекулярный ассоциат состава CD95/FADD/прокаспаза-8, называемый апоптозным шапероном или «сигнальным комплексом, индуцирующим смерть» (DISC — Death Inducing Signaling Complex).
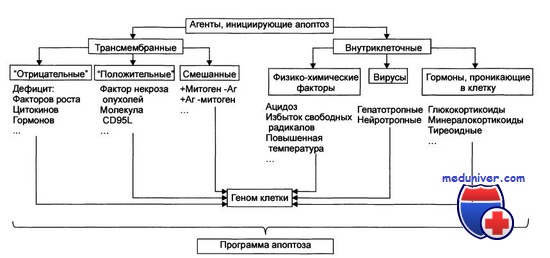
В составе этого комплекса прокаспаза-8 способна к аутопроцессированию, что приводит к отщеплению ее N-концевого регуляторного участка и разрезанию оставшейся части молекулы на две субъединицы с мол. м. около 18 000 и 16 000 D соответственно. Эти субъединицы образуют друг с другом гетеродимер с одним каталитическим центром, а два гетеродимера соединяются в тетрамерную конструкцию с двумя независимыми активными центрами — активную каспазу-8, освобождающуюся в цитозоль.
Замечательно, что активация каспаз является не единственным следствием сигналов, запускаемых рецепторами смерти. Так, помимо адаптера FADD, с DD активированного рецептора могут связываться другие DD-содержащие белки: ядерный белок DAXX с CD95; цитозольный RIP (Receptor Interacting Protein) c TNFR-1, DR4 и DR5. Активированный DAXX способен, как полагают, трансактивировать протеинкиназу ASK-1 (Apoptosis Stimulating Kinase — 1) и JNK1/2 (c-Jun N-terminal Kinases 1/2). Значение последнего сигнального пути неоднозначно: результаты, полученные на разных объектах, противоположны — от антиапоптогенного эффекта JNK (другое название — SAPK — Stress-Activated Protein Kinase) до проапоптогенного FADD-независимого сигнала.
ASK-1 может рекрутироваться в сигнальном пути, инициируемом рецептором TNFR-1, но в этом случае роль трансактиватора выполняет не DAXX, a ROS (Reactive Oxygen Species) или активные формы кислорода, апоптогенная роль которых будет рассмотрена ниже. Активация RIP трансактивирует TRAF (TNF Receptor Associated Factor), который в свою очередь активирует транскрипционные факторы (NF-kB — Nuclear Factor kappa В) антиапоптозных (JAPs — Inhibitor of Apoptosis proteins, Bcl-X) и провоспалительных генов. Адаптор FADD в составе комплекса с активированным рецептором также способен к переключению сигнала смерти на противоположный: вместо прокаспазы-8 он может связывать ее структурный гомолог — белок FLIP (FADD-like ICE inhibitory protein) с последующим рекрутированием TRAF и активацией NF-kB. Очевидно, одни и те же рецепторы смерти способны в различных условиях генерировать как про-, так и антиапоптогенные сигналы.
Удивительно, но разнонаправленные сигналы рецепторов могут генерироваться одновременно.
Недавно обнаружено, что связывание CD95 с лигандом или агонистическими моноклональными антителами сопровождаются транслокацией рецептора в состав липидных микродоменов мембраны (рафтов). Однако если связыванию CD95 с лигандом предшествует обработка клеточной мембраны метил b-циклодекстрином, нистатином или филипином, эффективно экстрагирующими холестерин из липидного бислоя, возбуждения рецептора и формирования апоптогенного сигнала не происходит. И напротив, гексадецилфосфохолин и другие эфиролипиды, в частности противоопухолевый препарат ЕТ-18-OCH3 (Edelfosine), индуцируют кластеризацию рецепторов CD95, их кэппинг (наблюдается латеральный дрейф рецепторов по мембране и их скопление на одном из полюсов клетки в виде шапочки, англ. — cap) и запуск программы клеточной гибели без участия лиганда смерти. Использование метил-р-циклодекстрина также предотвращает индукцию/трансдукцию сигнала клеточной гибели.
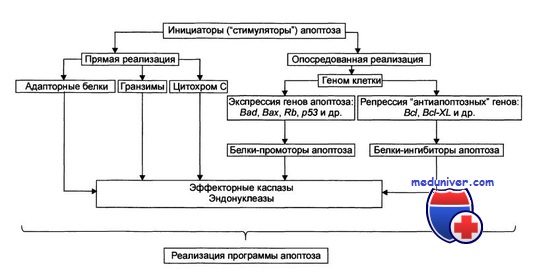
Молекулярный механизм подобной кластеризации рецепторов пока не выяснен, однако многие авторы связывают феномен кластеризации и транслокации рецепторов в состав липидных рафтов с действием кислой сфингомиелиназы (ASM), которая в течение от нескольких секунд до нескольких минут после возбуждения рецептора смерти транслоцируется во внешний слой клеточной мембраны, где расщепляет сфингомиелин с образованием церамидов, которые в свою очередь «кристаллизуют» липидный бислой мембраны с образованием рафтов. Механизм активации ASM также неизвестен, но регуляция ее активности может осуществляться обратимым гликозилированием фермента, а фосфатидилинозитол-3-киназа (PI-3-K) инактивирует ASM. Феномен кластеризации присущ не только рецепторам смерти: показано, что передаче соответствующего сигнала предшествует кластеризация Т- и В-клеточных рецепторов: TCR-CD3, BCR, CD2, CD44, интегринов, CD28 и др..
Таким образом, на клеточной поверхности могут присутствовать специфические рецепторы лигандов смерти, принадлежащие к обширному суперсемейству TNFRSF. В настоящее время обнаружено более двадцати рецепторов этого семейства, и, вероятно, это количество не останется окончательным. Наиболее распространенными среди клеток организма человека являются рецепторы CD95(Fas/APO-l), TNFR-1 и TNFR-2. Два рецептора DR4 и DR5 для TRAIL (TNF-Related Apoptosis Inducing Ligand) считают опухолеспецифичными, с чем связывают перспективу клинического использования рекомбинантного лиганда.
Рецепторы смерти неравномерно представлены на различных клетках даже в пределах одной ткани, что определяет индивидуальную судьбу каждой клетки. Экспрессия CD95 повышается при культивировании клеток с ИФН-у и ИЛ-2. Известен механизм посттрансляционной регуляции экспрессии CD95: нерецепторная тирозинфосфатаза FAP-1 (Fas-associated phosphatase-1) способна блокировать активность CD95, связываясь с С-концом его молекулы, а также препятствовать транслокации вновь синтезированных молекул рецептора на клеточную поверхность.
Помимо функционально полноценных рецепторов смерти, к суперсемейству относятся рецепторы-приманки (DcRl, DcR2), «растворимые» рецепторы (sFAS, OPG), рецептор фактора роста нервов NGFR и рецептор дифференцировки макрофагов RANK (Receptor-activator of NF-кВ). Назначение рецепторов-приманок и растворимых рецепторов — конкурентное связывание молекул лиганда в межклеточном пространстве для ослабления сигнала смерти. Например, снижение продукции остеобластами растворимого рецептора суперсемейства TNFRSF остеопротегерина приводит к избыточному образованию в костной ткани остекластов (они формируются из макрофагов под действием продуцируемого остебластами лиганда RANKL), что влечет развитие остеопороза.
Растворимая форма CD95 — не продукт протеолитического слущивания (шеддинга) экстрацеллюлярных доменов полноразмерного CD95, а результат альтернативного сплайсинга мРНК.
Примечательно, что, кроме специализированных рецепторов смерти суперсемейства TNFRSF, сигнал к индукции ПГК могут в определенных условиях формировать некоторые другие рецепторы: TCR-CD3, CD4, МНС-II.
- Читать "Роль митохондрий в апоптозе (гибели) клеток"
Оглавление темы "Апоптоз клеток":- Роль каспаз в апоптозе клетки. Функции каспаз
- Рецепторы смерти клетки при апоптозе. Функции рецепторов смерти
- Роль митохондрий в апоптозе (гибели) клеток
- Роль факторов роста в апоптозе (гибели) клеток
- Роль гранзимов в апоптозе (гибели) клеток
- Белки теплового шока (HSPs — heat-shock proteins) в апоптозе (гибели) клеток
- Транскрипционные факторы NF-кВ и р53 в апоптозе (гибели) клеток
- Протеасомы в апоптозе (гибели) клеток
- Cигнальные системы гибели и выживания клетки при апоптозе
- Программированная гибель клеток (апоптоз) в цитостатической терапии
