Структурное разнообразие иммуноглобулинов
Характерной особенностью иммуноглобулинов является исключительное структурное и функциональное разнообразие, обусловленное их вариабельностью и гетерогенностью. Вариабельность — характеристика иммуноглобулина, зависящая от строения активного центра (V-область) и соответственно антительной специфичности молекулы.
Гетерогенность связана со строением константной (С) части молекулы и проявляется существованием структурных вариантов (классы, подклассы и т. д.), а в функциональном отношении — разнообразием эффекторных свойств. При этом молекулы, имеющие один и тот же активный центр, могут быть гетерогенны по строению С-областей, а молекулы с идентичными С-областями вариабельны по строению и специфичности активных центров.
Активный центр антитела, который отвечает за распознавание и связывание комплементарного антигена, формируется за счет пространственного взаимодействия VH- и VL-доменов. Специфичность антитела при этом определяется аминокислотным строением полипептидной цепи V-доменов обеих цепей.
В структурном отношении все V-домены делятся на три группы, соответствующие трем основным видам полипептидных цепей иммуноглобулинов: Vk (присутствуют в L-цепях к-типа), Vh (для L-цепей Tirana) и VH (для всех классов Н-цепей).
Каждая группа в свою очередь состоит из нескольких подгрупп: трех Vk, семи Vh (в составе амилоида обнаружены преимущественно Vh VI) и четырех VH. Подгруппы выделены на основании степени структурной гомологии. Подгруппы V-областей являются аналогами классов и типов С-областей иммуноглобулинов. Для кодирования каждой V-подгруппы имеется собственный структурный ген.
Наконец, каждая подгруппа состоит из множества индивидуальных V-доменов, количество которых, например для всех четырех Vн-подгрупп, составляет несколько десятков тысяч.
Как показали сравнительные исследования первичной структуры V-областей разных иммуноглобулинов, вариабельность аминокислотных остатков не распространяется равномерно по всей V-области, а относится лишь к строго определенным ее участкам, получившим название гипервариабельных. Известны четыре таких участка в Н- и три в L-цепях. Протяженность гипервариабельных участков колеблется. Например, в Н-цепях человека это аминокислотные остатки 31—37, 51-68, 84-91 и 101-110. Количество гипервариабельных положений составляет суммарно 15—20 % от общего числа аминокислотных остатков V-домена.
Относительно инвариантные сегменты V-области, не включенные в гипервариабельные участки и составляющие 80—85 % от всего V-домена, обозначаются как каркасные участки.
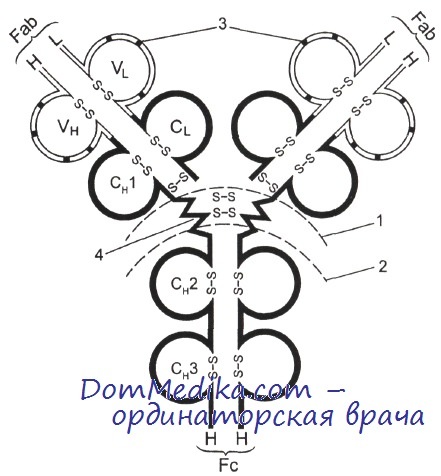
1 — место расщепления папаином; 2 — место расщепления пепсином; 3 — гипервариабельные участки V-доменов; 4 — шарнир.
При образовании пространственной структуры V-доменов гипервариабельные участки оказываются сближенными. Именно они участвуют в формировании активного центра молекулы — места связывания антигена.
Каркасные (инвариантные) участки ответственны за поддержание у всех антител в целом одинаковой пространственной структуры той области, которая непосредственно контактирует с антигеном. Кроме того, эти участки содержат последовательности, взаимодействующие с сопряженным V-доменом при образовании антигенсвязывающей области в целой молекуле иммуноглобулина.
Определенная структурная гетерогенность присуща и константным районам Н- и L-цепей. Она выражается в количестве и последовательности аминокислотных остатков, различии молекулярной массы, количестве доменов и межцепьевых дисульфидных мостиков, в олигосахаридном составе, строении шарнира.
У человека выявлено пять структурных вариантов константной части Н-цепей, которые обозначают буквами греческого алфавита у, а, u, q, е. Им соответствуют пять классов иммуноглобулинов: IgG, IgA, IgM, IgD и IgE. В пределах классов Н-цепей имеются меньшие структурные различия, которые обусловливают существование субклассов (подклассов). У человека хорошо изучены четыре субкласса IgG (IgG1, IgG2, IgG3 и IgG4) и два субкласса IgA (IgAl и IgA2).
Основные структурные различия Н-цепей разных классов и субклассов связаны главным образом с особенностями строения шарнира и Fc-области. У IgM и IgE шарнир отсутствует, а его функции выполняет дополнительный домен Н-цепей.
Легкие цепи представлены двумя структурно различными в С-области вариантами — к и h, которым соответствуют два типа иммуноглобулинов каждого класса. В каждой данной молекуле иммуноглобулина обе Н- и обе L-цепи идентичны; гибридных молекул in vivo не обнаружено.
Следующей причиной структурного разнообразия иммуноглобулинов является существование различных молекулярных форм. Так, если молекулы IgG, IgE и IgD присутствуют только в виде мономеров, то нормальный сывороточный IgM секретируется в форме пентамера (т. е. в его молекуле объединены пять субъединиц), а среди молекул сывороточного IgA имеются как мономерные, так и димерные (состоящие из двух субъединиц) формы.
Для полимерных молекул IgA и IgM характерно наличие дополнительного полипептида, ковалентно соединяющего субъединицы иммуноглобулина в районе Fc-фрагментов — так называемой J-цепи (от англ. joining — соединяющая). Кроме того, установлено существование секреторной формы — секреторного IgA, который представляет собой димер, связанный с белком эпителиального происхождения — секреторным компонентом.
Структурная гетерогенность иммуноглобулинов обусловливает дифференцировку эффекторных функций между иммуноглобулинами разных классов (субклассов), а также индивидуальные особенности и роль в иммунном ответе различных структурных форм.
Эффекторные функции иммуноглобулинов, направленные, как отмечалось, на инактивацию и удаление чужеродного антигена из организма, реализуются через взаимодействие с определенными клетками и растворимыми белками (главным образом белками системы комплемента). Структурные центры, обеспечивающие эти взаимодействия, находятся в С-области молекулы иммуноглобулинов — Fc-фрагменте. Одни эффекторные функции присущи интактным иммуноглобулинам, другие — иммуноглобулинам, связанным с антигеном.
В последнем случае происходит изменение конформации — пространственной структуры молекулы, в результате чего становятся доступными для взаимодействия центры, закрытые в интактной молекуле. Кроме того, при связывании антигена образуются агрегаты антител, оказывающие в ряде реакций более выраженное воздействие, чем мономерные субъединицы.
Взаимодействие с клетками осуществляется при участии группы поверхностных клеточных рецепторов, которые связываются с концевым Сн-доменом иммуноглобулинов. У человека имеется два хорошо изученных функциональных класса рецепторов для Fc-фрагмента иммуноглобулинов. Рецепторы одного класса присутствуют на клетках некоторых эпителиальных тканей и обеспечивают транспортировку иммуноглобулинов через гематотканевые барьеры. Рецепторы другого класса находятся на поверхности эффекторных клеток.
Их взаимодействие с комплексом антиген — антитело приводит к активации различных звеньев иммунного ответа, в частности усиливаются антителозависимая клеточная цитотоксичность, фагоцитоз, высвобождение медиаторов воспаления. Кроме того, эти взаимодействия имеют регуляторное значение в процессе дифференциации и пролиферации лимфоцитов. Необходимо добавить, что для каждого класса иммуноглобулинов имеются индивидуальные клеточные рецепторы.
- Читать "Биосинтез иммуноглобулинов"
Оглавление темы "Гематология":- Технологии получения дендритных клеток для создания вакцин
- Выбор антигена-мишени и введение его в дендритные клетки
- Способ введения вакцины дендритных клеток и их эффективность
- Результаты клинических испытаний вакцин на основе дендритных клеток
- Проблемы и дальнейшие перспективы использования дендритных клеток для иммунотерапии
- Строение молекулы иммуноглобулина
- Структурное разнообразие иммуноглобулинов
- Биосинтез иммуноглобулинов
- Генетика иммуноглобулинов - локализация генов
- Цитокины - рецепторы, функции
