Константа Михаэлиса. Влияние концентрации фермента на реакцию
Константа Михаэлиса Км — весьма удобный количественный параметр, помогающий установить, каким образом данный фермент будет реагировать при тех условиях, которые имеются в живой клетке.
Иными словами, Км представляет собой концентрацию субстрата, при которой скорость реакции равна половине максимальной. Если фермент характеризуется высоким значением Км, то это означает, что потребуется много субстрата для того, чтобы увеличить скорость катализируемой этим ферментом реакции до половины максимальной; низкая величина Км указывает на то, что для насыщения фермента достаточно небольшого количества субстрата. Из этих положений следует также, что фермент-субстратные пары с низким значением Км характеризуются высоким сродством друг к другу и наоборот.
Кроме того, величина Км помогает решить вопрос о том, какие из групп субстратов будут наиболее эффективно связываться с данным ферментом. Если фермент не обладает строгой специфич ностью, то в присутствии обычных концентраций реагентов, имею щихся в клетке, он будет предпочтительно катализировать реакцию, протекающую при участии того субстрата, для которого характерна наиболее низкая величина /См при взаимодействии с данным ферментом. Знание концентраций различных субстратов в клетке и величин /См при взаимодействии этих субстратов с ферментами позволяет оценить вклад отдельных реакций в процесс обмена веществ в организме в целом, а также установить, какая из этих реакций лимитирует скорость всего процесса. Выяснение этих вопросов совершенно необходимо для понимания воздействия физиологических регуляторных факторов, таких, как гормоны, на скорость метаболических реакций.
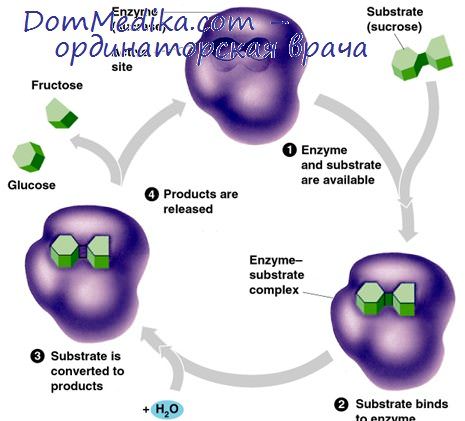
Влияние концентрации фермента на реакцию
Хотя величина Км характерна и постоянна для каждой фермент-субстратной пары, величина Vmax прямо пропорциональна количеству имеющегося в системе фермента. Действительно, можно показать алгебраически, что Vmаx=k [Е], где [Е] — концентрация фермента, a k — константа скорости для реакций, описанных выше при рассмотрении этапов (3) и (4). Измерение Vmax» или скорости ферментативной реакции в присутствии насыщающей концентрации субстрата, фактически служит мерой числа имеющихся в клетке молекул фермента. Хотя не всегда удается выразить [Е] в молях на литр, поскольку величина k не всегда известна, можно допустить, что измерение активности фермента при оптимальных условиях дает истинное представление об относительных количествах фермента.
В число условий, оптимальных для действия фермента, включают, кроме обеспечения достаточной для насыщения фермента концентрации субстрата, соответствующие физические параметры (температура, рН среды, степень ионизации), а также наличие любых дополнительных факторов, которые могли бы способствовать каталитическому процессу.
- Читать "Влияние температуры на реакцию. Оптимальная температура ферментной реакции"
Оглавление темы "Ферментативные реакции в организме":1. Ферментный катализ. Механизмы ферментного катализа
2. Соединение субстрата с ферментом. Конкурентное торможение
3. Концентрация субстрата. Влияние концентрации субстрата на ферментативную реакцию
4. Константа Михаэлиса. Влияние концентрации фермента на реакцию
5. Влияние температуры на реакцию. Оптимальная температура ферментной реакции
6. Оптимальная температура человека. Влияние pH на реакции в организме
7. Влияние ионов на химические реакции. Кофакторы и коферменты
8. Ингибиторы ферментов. Механизмы действия ингибиторов ферментов
9. Аллостерические модификаторы. Механизм действия модификаторов
10. Положительные модификаторы. Активация зимогенов
