Ингибиторы ферментов. Механизмы действия ингибиторов ферментов
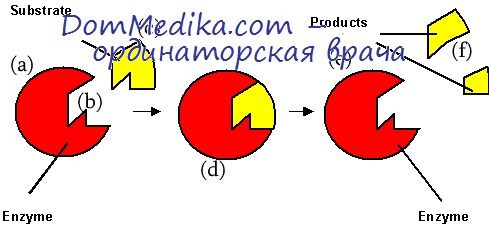
Ранее уже упоминалось о том, что ферментативному катализу могут препятствовать некоторые структурные аналоги субстрата. Такие вещества называют конкурентными ингибиторами. Феномен торможения активности ферментов, одним из примеров которого является конкурентное торможение, имеет существенное значение для понимания регуляции обмена веществ, а также действия многих лекарственных средств и ядов на организм. Как было отмечено выше, целый ряд физических факторов (включая высокие температуры, крайние значения рН и другие) могут вызывать инактивацию фермента в результате денатурации белка.
Физическая денатурация лежит в основе общего и неизбирательного типа торможения ферментативной активности, хотя чувствительность различных ферментов к таким воздействиям в какой-то мере варьирует. Существуют, однако, химические реагенты, действующие значительно более специфически в качестве ингибиторов активности определенных ферментов. Для этой группы реагентов типичны конкурентные ингибиторы, а также так называемые неконкурентные ингибиторы. Различие между ингибиторами этих двух типов основано на экспериментально наблюдаемом факте — преодолении конкурентного торможения повышенной концентрацией субстрата.
Таким образом, графики зависимости скорости ферментативной реакции u от [S] в присутствии постоянной концентрации конкурентного ингибитора дают такую же величину Vmax, как и в отсутствие ингибитора, так как большой избыток субстрата успешно конкурирует с ингибитором за места связывания в активном центре и в конечном счете субстрат вытесняет ингибитор. Величина Км в этом случае, однако, будет увеличена, поскольку для обеспечения скорости, равной половине максимальной, в присутствии ингибитора потребуется больше субстрата.
Отсюда следует, что конкурентный ингибитор помешал образованию фермент-субстратного комплекса и, таким образом, уменьшил «реальное» сродство фермента к субстрату; процесс же распада фермент-субстратного комплекса с образованием продуктов реакции при этом не изменился.
Когда график такого же типа зависимости v от [S] строят по материалам опыта, проведенного в присутствии неконкурентного ингибитора, то величину Vmах находят сниженной. В присутствии постоянной концентрации ингибитора субстрат, в каком бы количестве его ни добавляли, не может вытеснить ингибитор из его соединения с ферментом. Эти данные указывают на то, что субстрат и неконкурентный ингибитор должны связываться с активным центром фермента по-разному. Ингибитор воздействует только на собственно каталитическое действие фермента на стадии распада E-S- комплекса с образованием продуктов реакции, но не влияет на связывание субстрата и фермента при образовании Е-S-комплекса. Из этого последнего утверждения следует, что величина Лм в присутствии неконкурентного ингибитора не изменяется.
Ингибиторы — как конкурентного, так и неконкурентного типов — связываются с ферментом обратимо. Реагенты третьего типа, так называемые необратимые ингибиторы, образуют столь прочные комплексы с ферментом, что не могут быть легко отделены от него. Ингибиторы этого типа способны к образованию ковалентных связей с одним из аминокислотных остатков, входящих в активный центр фермента. Это ведет к предотвращению любого каталитического действия фермента.
- Читать "Аллостерические модификаторы. Механизм действия модификаторов"
Оглавление темы "Ферментативные реакции в организме":1. Ферментный катализ. Механизмы ферментного катализа
2. Соединение субстрата с ферментом. Конкурентное торможение
3. Концентрация субстрата. Влияние концентрации субстрата на ферментативную реакцию
4. Константа Михаэлиса. Влияние концентрации фермента на реакцию
5. Влияние температуры на реакцию. Оптимальная температура ферментной реакции
6. Оптимальная температура человека. Влияние pH на реакции в организме
7. Влияние ионов на химические реакции. Кофакторы и коферменты
8. Ингибиторы ферментов. Механизмы действия ингибиторов ферментов
9. Аллостерические модификаторы. Механизм действия модификаторов
10. Положительные модификаторы. Активация зимогенов
