Патогенез латентной рабической инфекции - механизмы развития
Уже давно в литературе описывались примеры, которые не могли быть истолкованы иначе как с позиций латентной рабической инфекции. Еще в 1882 г. Л. Пастер с соавт. описали случай, когда из группы здоровых собак, дважды покусанных бешеными собаками, несколько животных выжили и последующее экспериментальное введение таким собакам вируса бешенства не привело к развитию у них заболевания.
Еще более убедителен так называемый «случай в Фонтенбло» с собакой, покусавшей солдата: пойманную собаку долгое время держали в карантине и она все это время выглядела внешне здоровой, хотя солдат все же погиб от бешенства (Шт. Николау и др.).
Сорок лет назад было установлено, а затем неоднократно подтверждено, что летучие мыши-вампиры в Бразилии, Мексике и Аргентине могут быть носителями вируса бешенства в течение длительного времени, что они способны передавать инфекцию через укусы, сами при этом оставаясь внешне совершенно здоровыми (Pawan, Da Silva, Moreira, Da Silva). Тем не менее эти наблюдения долгое время объяснялись особенностями хозяев.
Понадобился немалый срок, чтобы преодолеть этот скепсис. Оказалось, что бессимптомными носителями вируса бешенства могут быть также насекомоядные летучие мыши. Инфекционный вирус был обнаружен в буром жире естественно зараженных мексиканских бесхвостых летучих мышей (Sulkin е. а.). Бурый жир может либо служить местом размножепия вируса (Sulkin е. а., Sulkin), либо быть инфицированным вследствие его центробежного распространения (Fischman, Schaeffer). Недавно был описан случай бешенства у летучей мыши на территории Польской Народной Республики (Komorowski е. а.) и на о. Куба (Silva, Herrada).
В 1968 г. в Тегеране на 8-м Международном конгрессе по тропической медицине было сделано сообщение, что повторные обследования в Индии и в Европе выявили существование среди собак здоровых вирусоносителей. При этом описаны случаи смертельных заболеваний лиц, укушенных такими внешне здоровыми животными, в слюне которых был обнаружен вирус бешенства.
Более того, лабораторные исследования в Иране показали, что собаки, зараженные малыми дозами вируса, остаются здоровыми, хотя в мозговой ткани у них содержится вирус (Bahmanyar).
Abdussalam инфекционный вирус успешно выделял в течение нескольких месяцев из слюны дикой собаки, доставленной из эндемического района. Fekadu также исследовал внешне здоровую собаку, у которой из слюны на протяжении 11 мес трижды изолировали вирус бешенства. Еще более интересный случай описали Veeraraghavan с соавт. с явно здоровой собакой, для которой был точно доказан случай передачи бешенства человеку. Эту собаку авторы исследовали в своей лаборатории на протяжении 37 мес. За все это время у собаки были взяты 913 проб слюны, из них в 14 заражением мышей-сосунков был выделен вирус бешенства.
Обследование 125 собак в энзоотических областях Ирана (Afshar е. а.) выявило, что у 3,2% животных содержатся антитела к вирусу бешенства. Было доказано присутствие рабического преципитирующего антигена в шести слюнных железах и в одной пробе слюны.
Анализ литературы не дает оснований ограничивать возможность формирования персистентной рабической инфекции только в организме летучих мышей и собак. Наиболее примечательными в этом отношении являются исследования вируса «дикования», проведенные Р. А. Канторовичем в районах Крайнего Севера за период с 1953 по 1956 г. Из головного мозга 117 внешне здоровых песцов автору удалось выделить 33 штамма вируса «дикования» (Р. А. Канторович).
Позднее в эпизоотические и межэпизоотические периоды было проведено специальное массовое вирусологическое обследование различных видов животных и птиц, забитых без признаков заболевания: песцов, лисиц, волков, собак, горностаев, мышевидных грызупов и сов. Вирус «дикования» удалось выделять из головного мозга здоровых песцов и лисиц. При этом у первых вирус выделялся в 50—75% случаев во время эпизоотического сезона и в 3—10% случаев в благополучные по заболеваемости годы. Полученные результаты позволили автору сделать вывод о ведущей роли полярных песцов в сохранении рабического возбудителя на территории Заполярья (Р. А. Канторович).
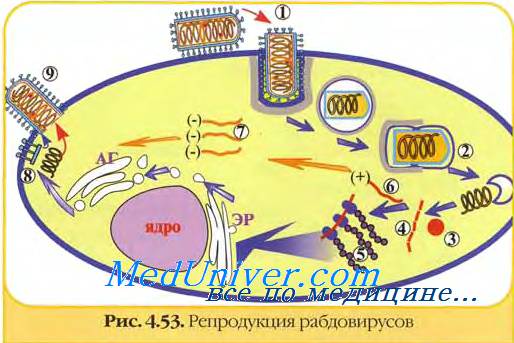
Не менее важными следует признать также открытия персистентной рабической инфекции у крыс в Таиланде (Smith е. а.) и у диких мышевидных грызунов в некоторых районах Центральной Европы (Schneider, Shoop). Необходимо подчеркнуть, что в последнем случае авторам удалось наблюдать хронически протекавшее заболевание, сопровождавшееся у животных признаками отставания в росте, что, например, имеет место у этих животных при такой медленной инфекции, как лимфоцитарный хориомешшгит.
В этой связи заслуживают внимания исследования эпизоотологических особенностей бешенства енотов во Флориде (США). Анализ данных за 20 лет (1953—1972) показал, что из общего числа бешеных животных, равного 1707, на долю енотов приходилось в период 1953—1956 гг. 17%, а в период 1969—1972 гг. уже 68%. Оказалось, что от 11 до 17% этих животных поддерживают персистентнуго инфекцию (Bigler е. а.).
Таким образом, латентная рабическая инфекция описана у разных животных в различных странах мира, что служит веским аргументом в пользу необходимости проведения дальнейших эколого-вирусологических исследований проблемы бешенства. Они помогут избежать в будущем столь неожиданных и, к сожалению, небезразличных встреч с разными представителями рабдовирусов, как это произошло, например в ФРГ и Югославии осенью 1967 г., когда среди лабораторных работников, занимающихся извлечением и обработкой почек зеленых африканских мартышек, произошла вспышка неизвестного ранее тяжелого заболевания.
Случаи заражения были описаны также среди персонала, ухаживающего за больными. Из 30 заболевших 7 погибли. Выделенный на животных и клеточных культурах возбудитель был отнесен к роду рабдовирусов (Kissling е. а.).
Так же как и для доказательства существования абортивного бешенства, в изучении персистентной рабической инфекции огромную роль сыграли модельные системы. Исследования в условиях in vitro впервые были предприняты в лаборатории X. Копровского (США) немногим более 10 лет назад, когда была обнаружена способность вируса бешенства персистировать в культуре диплоидных клеток человека или в культуре фибробластов эмбриона хомяка. Однако по мере культивирования таких систем внутри клеток происходило формирование больших по размерам телец включений, которые интерферировали с митотическим процессом и в конце концов приводили культуры к гибели (Wiktor е. а.).
Совершенно иная картина наблюдалась при заражении культуры клеток кроличьего эндотелия стандартным фиксированным вирусом бешенства (Fernandes е. а.). Начипая с 4-го пассажа все 100% клеток культуры содержали вирусоспецифический антиген, который сохранялся в культуре в течение 15 мес., что соответствовало 93 пассажам, хотя в клетках культуры тоже обнаруживались включения. Характерно, что количество инфекционного вируса, продуцируемого системой, постепенно снижалось и, начиная с 45—50-го пассажа, обнаружить инфекционный вирус не удавалось, хотя в клетках продолжали обнаруживать вирусспецифический антиген.
Такие культуры сохраняли ярко выраженную способность к интерференции, и обработка таких клеток антивирусной сывороткой не «вылечивала» их от вирусной инфекции. Авторы выдвинули концепцию о так называемом эндосимбиотическом взаимоотношении вируса и хозяина, главными отличительными чертами которого являются отсутствие признаков разрушения клеток, их полная инфицированность, персистенция вируса в культуре за счет его передачи «от клетки к клетке». Авторы предполагают возможность подобного эндосимбиотического взаимоотношения вируса бешенства с организмом животного или человека в процессе поддержания персистентной рабической инфекции, допуская, что нарушение эндосимбиотического состояния, видимо, повлечет за собой репродукцию большого количества вируса, «разрушающего» хозяина.
Столь же стабильной оказалась персистентная рабическая инфекция, вызванная фиксированным вирусом в культуре клеток животных (ВНК-21 и Nil-2) и рептилий (VSW) (Wiktor, Clark). Клетки могли пассироваться практически неограниченное время, в них не наблюдали развития признаков клеточной деструкции, но отмечали характерную цикличность в выделении вируса. Подобная же цикличность была обнаружена в отношении степени чувствительности персистентно инфицированных клеток к литическому действию антирабических антител в присутствии комплемента.
Авторы полагают, что при титре циркулирующих антител, остающихся на низком уровне, как это характерно для животных в инкубационном периоде, выход вируса не может привести к лизису клеток. Однако это будет продолжаться до тех пор, пока нецитопатическая клеточная инфекция будет прогрессировать до какого-то верхнего предела, при котором начнется выход больших количеств антигена. В последнем случае будет стимулирован синтез антител до такой высокой концентрации, которая будет достаточна для осуществления лизиса этих же самых антигенсодержащих клеток.
Стремясь подкрепить правомерность высказанного предположения, Wiktor и Clark указывают, что возможная критическая роль иммунолизиса в развитии бешенства обосновывается и тем, что вакцинированные против бешенства экспериментальные животные, не выдерживающие испытания стандартным вирулентным вирусом, часто погибают в более ранние сроки, чем зараженные, но предварительно не вакцинированные (контрольные) животные, которые к тому же имеют и более низкий титр циркулирующих антител по сравнению с животными первой группы (Sikes е. а., Baer, Cleary).
Что касается моделирования латентной рабической инфекции in vivo, то, по-видимому, первую удачную модель экспериментальной латентной инфекции получил Koprowski на сирийских хомяках: животным вводили иммунную антирабическую сыворотку, вслед за которой хомяков инокулировали уличным вирусом бешенства; на протяжении 5 мес животные не обнаруживали признаков заболевания, а повторное введение им уличного вируса бешенства демонстрировало их высокую устойчивость к суперинфекции.
Более обстоятельные исследования были выполнены в Институте вирусологии имени Д. И. Ивановского РАМН Р. М. Шен с соавт. Авторы исходили из хорошо известного факта, что из числа укушенных заведомо бешеными животными заболевают лишь от 30 до 40%. Поэтому авторы попытались получить бессимптомную рабическую инфекцию у восприимчивых животных в условиях заражения, приближающихся к естественным. Для этого уличным вирусом бешенства заражали белых мышей подкожно либо через пищеварительный тракт. В первом случае использовали разведение вируса (1:600), которое вызывало клиническое бешенство лишь у единичных животных из группы зараженных; во втором — для достижения желаемого эффекта использовали мышей в возрасте 3 нед и старше.
Через 45 дней исследовали 19 незаболевших мышей из группы зараженных подкожно. У 6 из них не обнаружено изменений в головном и спинном мозге, у остальных отмечены сосудистые поражения в области аммонова рога, среднего мозга, небольшие дегенеративные поражения нервных клеток, у некоторых — явления миелита, тельца Бабеша — Негри отсутствовали. Из мозговой ткани 4 таких мышей в биологических опытах выделен инфекционный вирус бешенства.
У животных, зараженных через рот, даже без признаков заболевания вирус в головном мозге обнаруживали до 21-го дня. На 36-й и 43-й день вирус не обнаруживался, но наблюдались остаточные воспалительные процессы вокруг сосудов головного и спинного мозга и дегенерация некоторого количества ганглиозпых клеток аммонова рога. Тельца Негри не обнаружены, вирус выделить не удалось. Вместе с тем на 43-й день в сыворотке крови таких животных содержались антирабические антитела, способные нейтрализовать 10—100 Dim уличного вируса бешенства (Р. М. Шен, И. А. Шумейкина).
В опытах на белых крысах И. А. Шумейкина, используя специально разработанную методику прижизненного удаления одной из слюнных желез, показала, что после заражения крыс per os у животных формируется латентная рабическая инфекция и вирус у них персистирует до 70-го дня от момента заражения. Это подтверждалось выделением вируса как из слюнных желез, так и из гомогенатов головного мозга. У крыс, зараженных подкожно, при полном отсутствии признаков заболевания из слюнных желез и головного мозга удавалось выделять инфекционный вирус бешенства до 78-го дня от момента заражения. Резюмируя результаты своих наблюдений, автор справедливо подчеркивает, что обнаруженный факт бессимптомного вирусоносительства в слюнных железах имеет важное эпидемиологическое значение (И. А. Шумейкина).
В 1958 г. С. Я. Гайдамович описала бессимптомную рабическую инфекцию петухов и голубей через 70 дней после одновременного заражения уличным вирусом бешенства в мозг и подкожно. В разных отделах мозга обнаруживались изменения более интенсивные, чем у перенесших абортивный тип бешенства. Обнаружение патоморфологических изменений в центральной нервной системе и вируснейтрализующих антител в сыворотке крови дали автору основание сделать вывод о наблюдавшейся бессимптомной инфекции у этих птиц.
Позднее было показано, что при внутрибрюшинпом заражении мышат-отъемышей линии ICR фиксированным вирусом в разведении Ю-2 и более выживают все 100% животных. В селезенке, печени и почках таких животных можно обнаружить вирус, по в мозговой ткани — никогда. Внутримозговое введение мышатам этой линии штамма HEP Флюри, наоборот, приводит к формированию бессимптомной инфекции с краткосрочным пребыванием вируса в мозговой ткани, что сопровождается развитием к 7-му дню после заражения картины менингоэнцефалита с накоплением лимфоцитов и плазматических клеток в зрительном бугре, с формированием фокусов поражения серого и белого вещества, наиболее выраженного в мозжечке и гиппокампе. Однако к 14-му дню изменения в мозговой ткани были значительно менее выражены, а к 60-му дню они уже отсутствовали (Fischman, Strandberg).
Kemp с соавт. описали экспериментальную инфекцию и передачу вируса Мокола у естественных хозяев — землероек. Штаммом ibAn 27377 подкожно, внутримышечно и перорально заражали 43 землеройки, из них у 13 была получена экспериментальная инфекция: у 11 животных отмечалось развитие типичной клинической картины заболевания, а у 2 — бессимптомная инфекция. У одной землеройки с бессимптомной инфекцией удалось выделить инфекционный вирус, у второй вирус выделить не удалось, но его персистенция доказана передачей через укус интактному животному.
- Читать "Иммунитет при бешенстве - механизмы защиты"
Оглавление темы "Вирусные инфекции":- Возбудитель бешенства - структура вируса
- Проявления бешенства у людей и животных - клиника
- Патогистология бешенства - морфология
- Патогенез бешенства - механизмы развития
- Патогенез латентной рабической инфекции - механизмы развития
- Иммунитет при бешенстве - механизмы защиты
- Эпидемиология бешенства - распространенность
- Вирус инфекционной анемии лошадей (ИАЛ) - строение, структура
- Клиника инфекционной анемии лошадей (ИАЛ) - проявления
- Патогистология инфекционной анемии лошадей (ИАЛ) - морфология
