Генная терапия болезней сердца и сердечной недостаточности
Генная терапия — новейший терапевтический подход к лечению сердечной недостаточности (СН). Развитие направлений и методологии передачи генов позволило рекомбинантным генам стабильно экспрессироваться в КМЦ. Более того, последние достижения в сфере интерференции рибонуклеиновой кислоты свидетельствуют, что можно использовать генную терапию для «отключения» ключевых генов, ответственных за патологию, или путей их активации в поврежденном сердце.
Для успешного клинического применения любого из генетических терапевтических подходов необходимы 3 условия. Во-первых, для доставки генетического материала необходим переносчик (вектор) или система упаковки. Только несколько из доступных сейчас вирусных векторов (аденовирусы, адено-ассоциированные вирусы и, возможно, лентивирусы) способны дать достаточную трансгенную экспрессию высокого уровня в постмитотических клетках, какими являются КМЦ. Рекомбинантные аденовирусы использовали наиболее часто из-за их способности «упаковывать» большие конструкции ДНК, а также способности к трансдукции нерепликационных клеток.
Однако стойкий иммунный ответ, который вызывают эти векторы, позволил предположить, что в клинике понадобятся другие векторы или более очищенные аденовирусные системы. Во-вторых, вектор необходимо точно доставить в поврежденную ткань. Возможность передачи кардиальных генов через вирусный вектор in vivo стабильно демонстрировалась в экспериментальных работах. На рисунке ниже показан ряд механических подходов, которые используют для передачи кардиальных генов. Путем интракоронарной катетерной доставки аденовируса, кодирующего ген бета-галактозидазы, была достигнута 30% передача КМЦ в бассейн артерии, через которую проводили введение.
Прямая инъекция аденовируса в стенку желудочка через эпикардиальный доступ продемонстрировала значительное увеличение генерируемых конструкций, однако экспрессия была фокальной, а укол иглой приводил к дополнительному повреждению миокарда. Интрамиокардиальную доставку аденовируса через внутрижелудочковый доступ путем ретроградной инфузии через коронарные вены широко использовали в экспериментах на крупных животных с целью определения зон регионарной трансдукции. Инъекция аденовируса, несущего b-галактозидазу в полость перикарда, вызывала трансдукцию только в перикардиальных клеточных слоях.
В-третьих, обязательным условием успешности геннотерапевтического подхода является определение соответствующей мишени, требующей коррекции.
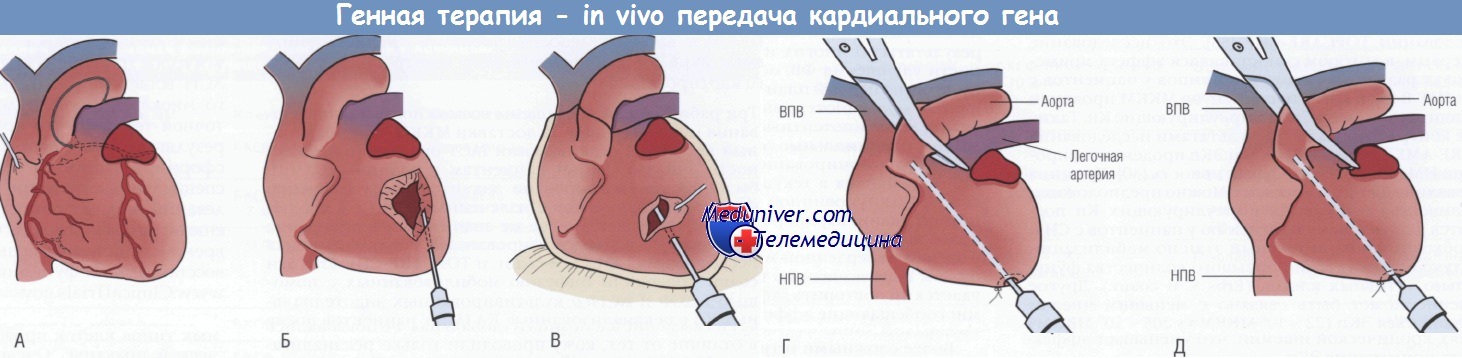
(А) Коронарная перфузия. (Б) Интрамиокардиальная инъекция.
(В) Перикардиальная инъекция. (Г) Пережатие аорты.
(Д) Перекрестное пережатие аорты и легочной артерии.
ВПВ — верхняя полая вена; НПВ — нижняя полая вена
В таблице ниже перечислены потенциальные мишени генной терапии при сердечной недостаточности (СН), определенные при экспериментальных исследованиях. Наиболее многообещающими мишенями для генной терапии служат гены, регулирующие сигнальные пути b-адренорецепторов (b-АР), и гены, управляющие транспортом кальция в сердце.
Сигнальные пути b-АР ответственны за модулирование миокардиальной сократимости. Исследования выявили, что повреждение миокардиальных b-АР может предшествовать, а также сопровождать развитие СН у людей, включая дисрегуляцию b-АР, функциональное разобщение b-АР от второй сигнальной системы и повышенные уровни ингибирующих G-белков, которые снижают передачу сигналов b-АР.
Действительно, трансгенные мыши с кардиорестриктивной гиперэкспрессией b2-АР обладают повышенной миокардиальной сократимостью. Однако, чрезмерная и/или постоянная стимуляция b-АР может также привести к активации мальадаптивных сигнальных путей в сердце (например, активации фетальной генетической программы), а также гибели миоцитов вследствие как некроза, так и апоптоза. Например, у трансгенных мышей, гиперэкспрессирующих b1-АР, развивается ДКМП. Эти экспериментальные исследования вызывают значительный интерес к использованию селективных генетических подходов для модулирования сигнальных путей b-АР в моделях СН. Пока в результате передачи генов человеческих b2-АР с помощью аденовирусов можно было наблюдать улучшение сократимости кардиомиоцитов (КМЦ), полученных от модели СН на кроликах, и КМЦ поврежденных сердец.
Подобным образом трансдукция с помощью аденовируса генов пептидного ингибитора b-АР киназы заканчивалась восстановлением передачи сигналов b-АР, повышением циклического аденозин-монофосфата и инверсией желудочковой дисфункции в модели СН на кроликах.

ПкА — протеинкиназа А; СР — саркоплазматический ретикулум.
Улучшение миокардиальной сократимости посредством воздействия на передачу сигналов через внутриклеточный кальций является целью генной терапии при сердечной недостаточности (СН). Отдельные исследования выявили, что функциональное подавление Са2+-АТФазной активности саркоплазматического ретикулума или абсолютное сокращение количества протеина SERCA2a может значительно изменять транспорт кальция и влиять на сократимость миокарда при его поражении. В экспериментальных моделях гипертрофии при перегрузке давлением, которая ведет к СН, гиперэкспрессия SERCA2a после генной трансдукции in vivo приводила к восстановлению систолической и диастолической функций до нормы.
Подобным образом гиперэкспрессия SERCA2a в результате генной терапии с использованием мишени приводила к нормализации объемов ЛЖ в моделях на животных, улучшая энергетику и увеличивая выживаемость при гипертрофии, обусловленной перегрузкой давлением. Недавно было показано, что повышенная экспрессия конструкции антисмыслового фосфоламбана или доминантнонегативной мутации фосфоламбана повышает активность SERCA2a. Это совпадает с прежними наблюдениями, когда функциональные нарушения в мышиных моделях ДКМП предотвращали с помощью генетической аблации этого фосфоламбана. Подобные положительные эффекты, связанные с сердечной сократимостью, включая нормализацию транспорта кальция и повышение активности SERCA2a, наблюдались в экспериментальных моделях сердечной недостаточности (СН) и у людей после трансдукции гена S100A1 (кальцийсвязывающего белка).
В дополнение к модуляции миокардиальной сократимости генные терапевтические подходы могут также быть нацелены на повышение жизнеспособности кардиомиоцитов (КМЦ) или фенотипирование фибробластов. Морфологические и биологические маркеры запрограммированной клеточной смерти, или апоптоза, были идентифицированы у человека при сердечной недостаточности (СН). Высказано предположение, что эти пути в каскадах реакций способствуют утрате КМЦ и развитию дисфункции сердца при сердечной недостаточности (СН). В связи с этим еще одной задачей продолжающихся исследований стало выявление потенциальной возможности блокирования апоптоза КМЦ методом передачи соматических генов.
Возможность модулирования фенотипа фибробластов изучали на экспериментальных моделях ИМ, когда для превращения сердечных фибробластов в функциональные скелетные мышечные клетки с целью уменьшения размера ИМ или распространения его на периинфарктные зоны использовали генноопосредованную передачу гена миогенного детерминирования MyoD.
Перспективы применения генной терапии
Стратегии передачи генов, которые приводят к изменению миокардиальной сократимости и/или ремоделирования сердца, в экспериментальных моделях СН оказались многообещающими. Однако следует подчеркнуть, что предстоит еще большая работа по улучшению векторных технологий и методов доставки кардиальных генов. Возможно, наиболее важно проведение клинических исследований пациентов с СН в целях выяснения, для каких генных мишеней это воздействие безопасно. В настоящее время отсутствуют клинические данные о применении генной терапии у пациентов с СН, однако уже запланированы небольшие клинические исследования с использованием SERCA2.
- Читать "Фармакогенетика терапии сердечной недостаточности"
Оглавление темы "Лечение сердечной недостаточности":- Эффективность стволовых клеток в лечении инфаркта миокарда
- Эффективность клеточной мобилизации в лечении инфаркта миокарда
- Эффективность стволовых клеток и клеточной мобилизации в лечении ХСН
- Перспективы применения стволовых клеток и клеточной терапии болезней сердца
- Генная терапия болезней сердца и сердечной недостаточности
- Фармакогенетика терапии сердечной недостаточности
- Мильдоний и другие метаболические средства в лечении сердечной недостаточности
- Иммуномодуляторы в лечении сердечной недостаточности - эффективность статинов
- История паллиативной помощи больным с неизлечимыми заболеваниями
- Смертность от сердечно-сосудистых заболеваний в США
