Хирургическое снижение сердечно-сосудистого риска перед операцией
Предполагается, что проведение коронарной реваскуляризации может уменьшить риск сердечно-сосудистых осложнений (ССО), обусловленных некардиохирургическим вмешательством. Выполненный ранее ретроспективный анализ показал, что предварительная реваскуляризация может снизить риск послеоперационных осложнений в 2-4 раза у больных, направленных на плановое вмешательство на сосудах. Наибольшее число доказательств было получено в исследовании CASS (Coronary Artery Surgery Study), в которое пациентов включали с 1978 по 1981 г.
Среди пациентов, которым до некардиохирургической операции выполняли КШ, летальность во время операции составила 0,9%, а среди больных, которым КШ не проводили, она была значительно выше (2,4%). Однако летальность, ассоциированная с самим КШ, составила 1,4%. Eagle и соавт. представили результаты наблюдений в течение 10 лет пациентов, включенных в исследование CASS. После вмешательства на КА больным были выполнены 3368 некардиохирургических операций. При выполнении вмешательств с промежуточным уровнем риска (на брюшной или грудной полости, эндартерэктомия) заболеваемость и смертность составляли вместе 1-5%, при этом у пациентов, которым ранее была выполнена коронарная реваскуляризация, отмечено небольшое, но достоверное улучшение исходов.
Наиболее значимое улучшение показателей выявлено у пациентов, которым проводили обширные вмешательства на сосудах, например реваскуляризацию нижних конечностей. Однако это наблюдательное исследование не было рандомизированным и его проводили в 1970-е и 1980-е гг., когда еще не было достигнуто значительных успехов в области фармакологического, хирургического и эндоваскулярного лечения ИБС. Landesberg и соавт. провели ретроспективный анализ отдаленных исходов у 578 пациентов, которым выполнили операции на сосудах.
При проведении многомерного анализа оказалось, что возраст, характер оперативного вмешательства, наличие диабета и ИМ в анамнезе, а также выявление умеренной или тяжелой ишемии (по данным обследования перед операцией) являются независимыми предикторами смерти, а выполнение коронарной реваскуляризации до операции — предиктором повышения выживаемости. Долгосрочная выживаемость после обширных хирургических вмешательств на сосудах была существенно выше, если больным с умеренной или выраженной ишемией, выявленной на дооперационном этапе, проводили плановую коронарную реваскуляризацию.
В нескольких когортных исследованиях оценивали эффект ЧКВ, выполненного перед некардиохирургическим вмешательством. Posner и соавт. использовали сведения о больных, которым было выполнено ЧКВ в штате Вашингтон. Исследователи сравнивали ССО у больных ИБС, которым проводили некардиохирургическое лечение, в зависимости от того, было ли до операции выполнено ЧКВ. В этом нерандомизированном исследовании была выявлена существенно меньшая частота осложнений в течение 30 дней после вмешательства у пациентов, которым за 90 дней и более до операции было проведено ЧКВ. Важно, что проведение ЧКВ менее чем за 90 дней до вмешательства не влияло на исходы.
Хотя объяснений этому феномену нет, такие результаты поддерживают мнение, что ЧКВ, выполненное с целью «перенести операцию», не улучшает прогноз, поскольку у больных со стабильным и/или бессимптомным течением ИБС осложнений обычно не бывает, а ЧКВ может дестабилизировать атеросклеротические бляшки в КА, тогда клинические проявления заболевания возникнут вскоре после некардиохирургического вмешательства. Более того, применение стентов с лекарственным покрытием и необходимостью длительной антитромбоцитарной терапии может спровоцировать кровотечение во время операции, а при отмене анти тромбоцитарной терапии перед вмешательством — привести к тромбозу стента.
В ряде рандомизированных исследований оценивали значение операций КШ и ЧКВ. McFalls и соавт. опубликовали результаты многоцентрового рандомизированного исследования Veterans Administration Health System, в котором пациенты с задокументированным по данным КАГ поражением КА (исключая больных с поражением ЛГКА и ФВ < 20%) были рандомизированы в группу с предварительным проведением КШ (59%) или ЧКВ (41%), затем было выполнено сравнение с группой, получавшей лекарственную терапию.
Через 2,7 года после рандомизации оказалось, что смертность в группе с реваскуляризацией практически не отличалась от таковой во второй группе (22% vs 23% соответственно). В течение 30 дней после некардиохирургической операции частота ИМ, диагностированного по уровню тропонина, составила 12% среди больных после реваскуляризации и 14% — во второй группе (р = 0,37).
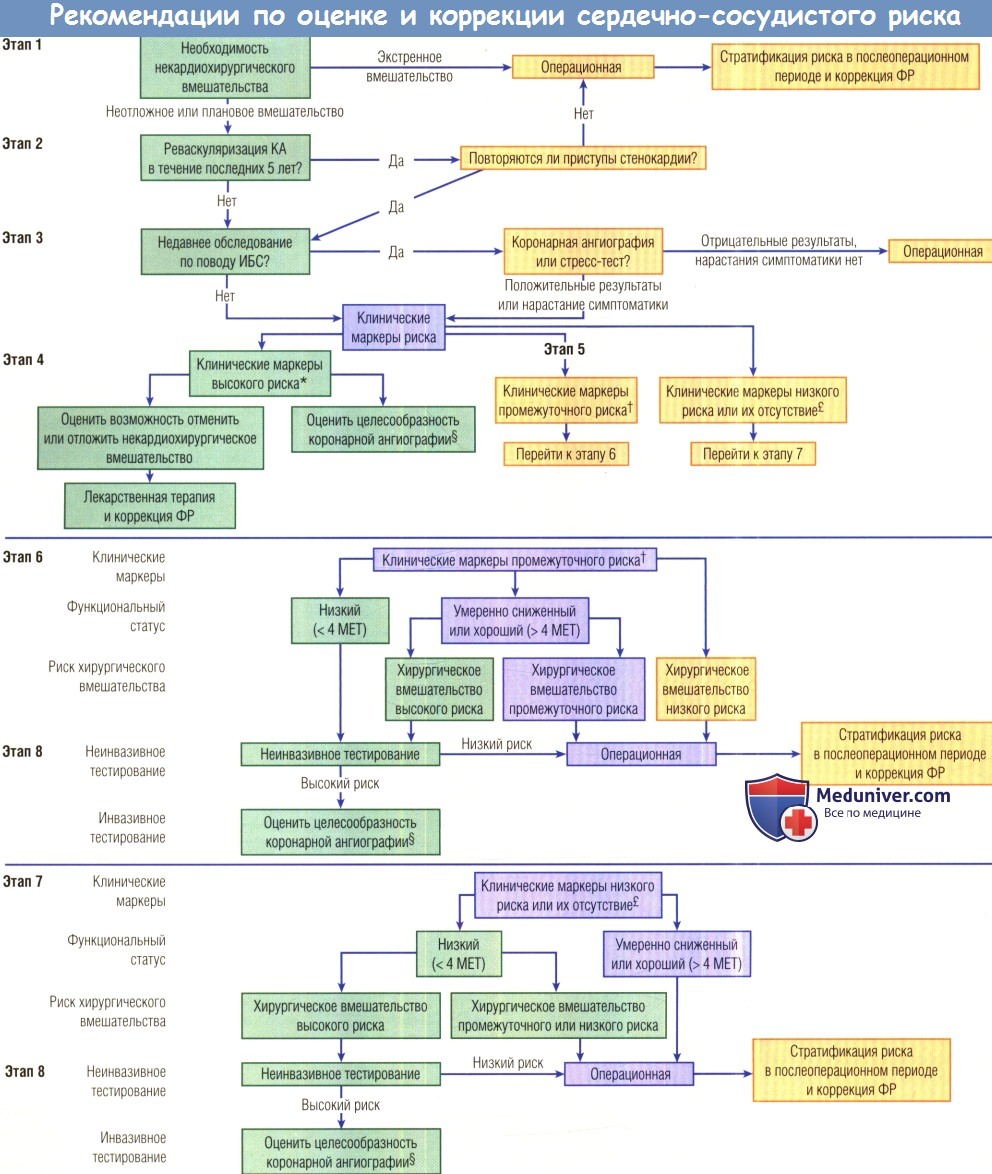
МЕТ — метаболический эквивалент; АГ — артериальная гипертензия; ИБС — ишемическая болезнь сердца; КА — коронарные артерии; ФР — факторы риска.
* Клинические маркеры высокого риска: нестабильная ИБС, декомпенсированная СН, значимые нарушения ритма, тяжелые пороки клапанов сердца, t Клинические маркеры промежуточного риска: стенокардия невысокого ФК, ИМ в анамнезе, компенсированная СН или СН в анамнезе, сахарный диабет, почечная недостаточность.
† Клинические маркеры низкого риска: пожилой возраст, изменения на ЭКГ, нарушения ритма, снижение функционального статуса, инсульт в анамнезе, неконтролируемая АГ
£ Дальнейшая тактика обусловлена результатами обследования и лечения.
Авторы делают вывод, что проведение реваскуляризации не показано больным со стабильным течением ИБС, а ЧКВ и КШ неэффективны для профилактики послеоперационных осложнений при одно- или двухсосудистом поражении. При проведении повторного анализа было выявлено, что на частоту периоперационных ИМ влияла степень реваскуляризации, при этом КШ было немного более эффективным, чем ЧКВ.
Как уже отмечалось ранее, Poldermans и соавт. рандомизировали пациентов в группы промежуточного риска с выполнением обследования и без него и не обнаружили различий в частоте сердечно-сосудистых событий (СССоб) в течение 30 дней после некардиохирургического вмешательства. Учитывая результаты ранее проведенных исследований, необходимо дальнейшее изучение эффективности превентивной коронарной реваскуляризации в группе пациентов с очень высоким риском.
Интерпретация результатов может зависеть от времени между коронарной реваскуляризацией и некардиохирургическим вмешательством, что влияет на протективный эффект и потенциальный риск. Back и соавт. обследовали 425 пациентов, которым было выполнено 481 плановое вмешательство на сосудах в VA Medical Center. Вмешательства на КА были разделены на недавние (КШ < 1 года, чрескожная транслюминальная коронарная ангиопластика [ЧТКА] < 6 мес) в 35 случаях (7%), предшествующие (1 года < КШ < 5 лет, 6 мес < ЧТКА < 2 года) в 45 случаях (9%) и отдаленные (КШ > 5 лет, ЧТКА > 2 лет) в 48 случаях (10%). Исходы у пациентов, которым была выполнена ЧТКА, не отличались от таковых при операции КШ (р = 0,7).
Существенные различия в частоте нежелательных явлений и летальных исходов были обнаружены среди больных, которым выполнили КШ в течение последних 5 лет или ЧТКА в течение 2 лет (6,3 и 1,3% соответственно), больных после отдаленной реваскуляризации (10,4 и 6,3% соответственно) и больных с высоким риском без реваскуляризации (13,3 и 3,3% соответственно) или промежуточным/низким риском (2,8 и 0,9% соответственно). Авторы сделали вывод о том, что предшествующая коронарная реваскуляризация (КШ > 5 лет, ЧТКА > 2 лет) может обеспечить лишь умеренную защиту от нежелательных СССоб и летального исхода после обширных вмешательств на сосудах.
Несколько вопросов возникает и в отношении ЧКВ со стентированием. Kaluza и соавт. оценили результаты лечения 40 пациентов, которым за 6 нед до обширного некардиохирургического вмешательства с общей анестезией провели профилактическое стентирование КА. Были задокументированы 7 ИМ, 11 эпизодов массивного кровотечения и 8 летальных исходов. Все летальные исходы и ИМ, а также 8 из 11 случаев кровотечений возникли у больных, которым операцию проводили менее чем через 14 дней после стентирования. 4 пациента скончались после операции, выполненной на следующий день после установки стента. Wilson и соавт. обследовали 207 больных, которым было выполнено некардиохирургическое вмешательство в течение 2 мес после стентирования.
8 больных умерли или перенесли ИМ, и все они были из тех 168 пациентов, которым операцию провели через 6 нед после установки стента. Vincenzi и соавт. изучили данные 103 пациентов и обнаружили, что риск СССоб в периоперационном периоде в 2,11 раза выше у больных, которым стентирование было выполнено недавно (< 35 дней до операции), по сравнению с теми, кому ЧКВ проводили более чем за 90 дней до вмешательства. Причем был важен срок, на который откладывали вмешательство, независимо от того, продолжали ли ан-титромбоцитарную терапию или кратковременно ее прерывали (гепарин назначали всем больным). Leibowitz и соавт. провели обследование 216 больных, которым было выполнено ЧКВ за 3 мес до некардиохирургического вмешательства (в 112 случаях — ЧТКА и в 94 — стентирование).
Умерли 26 больных (12%): 13 (14%) в группе стентирования и 13 (11%) — в группе ЧТКА, различия недостоверны. Частота ИМ и показатели смертности в течение 6 мес также существенно не различались (7 и 14% в группе стентирования vs 6 и 11% в группе ЧТКА соответственно). Достоверно больше событий произошло в обеих группах, если некардиохирургическую операцию выполняли в течение 2 нед после ЧКВ. На основании всех имеющихся данных можно заключить, что плановое некардиохирургическое вмешательство следует проводить не ранее, чем через 4-6 нед после ЧКВ (как со стентированием, так и без него).
Имплантация стентов с лекарственным покрытием представляет еще большую проблему. Все больше данных о сохранении риска тромбозов в течение как минимум 1 года после установки такого стента. Nasser и соавт. описали 2 случая тромбоза стентов, покрытых сиролимусом, через 4 и 21 мес после установки. В 2007 г. были опубликованы рекомендации AHA, АСС, Society for Cardiovascular Angiography and Interventions, American College of Surgeons и American Dental Association, в которых подчеркивается необходимость двойной антитромбоцитарной терапии в течение 12 мес после установки стента с лекарственным покрытием, а также рекомендуется отложить плановое оперативное вмешательство на 1 год; в том случае, если вмешательство откладывать нельзя, — продолжать терапию аспирином в течение всего периоперационного периода у больных с высоким риском и установленным стентом с лекарственным покрытием.
Список литературы:
1. Eagle K.A., Rihal CS, Mickel MC, et al: Cardiac risk of noncardiac surgery: Influence of coronary disease and type of surgery in 3368 operations. CASS Investigators and University of Michigan Heart Care Program. Coronary Artery Surgery Study. Circulation 96:1882, 1997.
2. Landesberg G, Mosseri M, Wolf YG, et al: Preoperative thallium scanning, selective coronary revascularization, and long-term survival after major vascular surgery. Circulation 108:177, 2003.
3. Posner KL, Van Norman GA, Chan V: Adverse cardiac outcomes after noncardiac surgery in patients with prior percutaneous transluminal coronary angioplasty. Anesth Analg 89:553, 1999.
4. McFalls EO, Ward HB, Moritz TE, et al: Coronary-artery revascularization before elective major vascular surgery. N Engl J Med 351:2795, 2004.
5. Ward HB, Kelly RF, Thottapurathu L, et al: Coronary artery bypass grafting is superior to percutaneous coronary intervention in prevention of perioperative myocardial infarctions during subsequent vascular surgery. Ann Thorac Surg 82:795, discussion 1, 2006.
6. Back MR, Stordahl N, Cuthbertson D, et al: Limitations in the cardiac risk reduction provided by coronary revascularization prior to elective vascular surgery. J Vase Surg 36:526, 2002.
7. Kaluza GL, Joseph J, Lee JR, et al: Catastrophic outcomes of noncardiac surgery soon after coronary stenting. J Am Coll Cardiol 35:1288, 2000.
8. Wilson SH, Fasseas P, Orford JL, et al: Clinical outcome of patients undergoing non-cardiac surgery in the two months following coronary stenting. J Am Coll Cardiol 42:234, 2003.
9. Vicenzi MN, Meislitzer T, Heitzinger B, et al: Coronary artery stenting and noncardiac surgery — a prospective outcome study. Br J Anaesth 96:686, 2006.
10. Leibowitz D, Cohen M, Planer D, et al: Comparison of cardiovascular risk of noncardiac surgery following coronary angioplasty with versus without stenting. Am J Cardiol 97:1188, 2006.
11. Moreno R, Fernandez C, Calvo L, et al: Meta-analysis comparing the effect of drug-eluting versus bare metal stents on risk of acute myocardial infarction during follow-up. Am J Cardiol 99:621, 2007.
12. Pfisterer M, Brunner-La Rocca HP, Buser PT, et al: Late clinical events after clopidogrel discontinuation may limit the benefit of drug-eluting stents: An observational study of drug-eluting versus bare-metal stents. J Am Coll Cardiol 48:2584, 2006.
13. Nasser M, Kapeliovich M, Markiewicz W: Late thrombosis of sirolimus-eluting stents following noncardiac surgery. Catheter Cardiovasc Interv 65:516, 2005.
14. Grines CL, Bonow RO, Casey DE Jr, et al: Prevention of premature discontinuation of dual antiplatelet therapy in patients with coronary artery stents: A science advisory from the American Heart Association, American College of Cardiology, Society for Cardiovascular Angiography and Interventions, American College of Surgeons, and American Dental Association, with representation from the American College of Physicians. J Am Coll Cardiol 49:734, 2007.
- Читать "Лекарства для профилактики сердечно-сосудистых осложнений операции"
Редактор: Искандер Милевски. Дата публикации: 19.2.2019
- Рекомендации по анестезии при сердечно-сосудистом заболевании
- Уход после операции при сердечно-сосудистом заболевании
- Хирургическое снижение сердечно-сосудистого риска перед операцией
- Лекарства для профилактики сердечно-сосудистых осложнений операции
- Немедикаментозное снижение сердечно-сосудистого риска перед операцией
- Рекомендации АСС/АНА по снижению сердечно-сосудистого риска операции
