Микробиологическая диагностика ацинетобактер (Acinetobacter)
Ацинетобактер-инфекция диагностируется путем бактериологического исследования.
Материалом для исследования может быть кровь, спинномозговая жидкость (СМЖ), мокрота, моча, гнойное отделяемое ран и слизистых оболочек, фекалии, а также смывы с инструментов, аппаратуры, поверхностей предметов больничного обихода и т. п.
а) Первый день исследования:
1. Гной, мокроту, осадок мочи предварительно микроскопируют. При обнаружении большого количества грамотрицательных коккобактерий можно заподозрить ацинетобактеры. Независимо от результатов бактериоскопии, материал засевают на кровяной агар в чашки Петри; при подозрении на ацинетобактер (на основании бактериоскопических или эпидемиологических данных) желательно сделать параллельно посев на селективную агаровую среду Лидс (по названию английского города Leeds), предназначенную для выделения некоторых неферментирующих грамотрицательных бактерий. В этом случае чашку с посевом инкубируют сразу при 30°С. В любом случае мокроту сеют в разведениях.
Для посевов фекалий недавно предложена французская сухая хромогенная селективная среда CHROMagar-Acinetobacter с высокой разрешающей способностью (чувствительность 91,7%, специфичность 89,6%).
2. СМЖ, независимо от результатов бактериоскопии, высевают одновременно на 3 чашки Петри — с «шоколадно»-кровяным агаром, 20 %-ным сывороточным и простым питательным агаром, чтобы не упустить все возможные бактериальные возбудители менингита, среди которых имеются труднокультивируемые.
3. Кровь засевают во флаконы с жидкой, полужидкой или двухфазной средой для выделения гемокультур с последующими высевами (после инкубации) на 5 %-ный кровяной агар.
Все посевы инкубируют 24 часа, а в случае отсутствия роста подозрительных колоний — 48 ч.
б) Второй день. Производят высев из среды для гемокультур на кровяной агар; флакон сохраняют в термостате и при отсутствии положительного результата на другой день высев повторяют.
Просматривают чашки с посевами, сделанными накануне. На кровяном агаре A. baumannii (он растет при 37°С, а не только при 30°С) образует серо-белые выпуклые крупные (2-3 мм) колонии без гемолиза; некоторые виды ацинетобактеров дают гемолиз. На среде Лидс, которая имеет оранжевый цвет, колонии суточного роста A. baumannii достигают размера порядка 2 мм и приобретают розовую окраску. Цвет агара под колонией и вокруг нее — фиолетово-красный (за счет подщелачивания среды).
При посевах СМЖ ацинетобактеры вырастают на всех трех средах в виде серовато-белых колоний, без изменения цвета «шоколадно»-кровяного агара. Колонии на простом агаре несколько мельче, чем на агаре с сывороткой и кровью.
Из подозрительных колоний готовят препараты-мазки, окрашенные по Граму. При сомнениях в окраске готовят новый препарат, окрашенный по Г. П. Калине.
В случае обнаружения колоний, содержащих грамотрицательные коккобактерии, с фрагментами отобранных сходных колоний ставят реакции на оксидазу и каталазу. Эти тесты крайне важны для выбора дальнейших действий бактериолога. При наличии каталазы и отсутствии оксидазы бактерии, сформировавшие изучаемые колонии, могут быть заподозрены на принадлежность к ацинетобактерам. Следует помнить, что на среде Лидс сходные розовые колонии образуют Stenotrophomonas maltophila и Senatia marcescens, также не образующие оксидазу, но они отличаются видом колоний (первые имеют сморщенную поверхность и изрезанные края, вторые же имеют желтые края); Burkholderia cepacia также дает розовые колонии, но обладает оксидазой.
Отобранные колонии отсевают на среду Клиглера (или иную комбинированную среду) для получения чистой культуры и последующего изучения.
в) Третий день. Просматривают высевы из гемокультур и, в случае появления роста колоний, их изучают, как описано выше (см. 2-й день). При отсутствии роста высевы периодически повторяют на протяжении 7 дней.
Изучают рост культур, выросших на среде Клиглера. Ацинетобактеры не вызывают изменения цвета этой среды, лишь через 48 часов она становится ярко-красной (из-за подщелачивания среды за счет расщепления пептонов с образованием аммиака). Снова повторяют реакции на оксидазу и каталазу, и в случае получения соответствующих результатов отсевают культуру на следующие среды:
• скошенный агар для получения чистой культуры и определения чувствительности;
• столбик желатиновой среды для определения желатиназы с последующей инкубацией при 22°С;
• сектор кровяного агара для изучения гемолиза;
• среду для определения подвижности;
• среду Симмонса с цитратом, как единственным источником углерода;
• две пробирки со средой Хью-Лейфсона с глюкозой, одну из которых заливают вазелиновым маслом, для выявления оксидации глюкозы; учет результатов через 5-6 дней;
• три пробирки с сердечно-мозговым бульоном, одну из которых инкубируют при 30°С, вторую — при 37°С и третью — при 44°С;
• на агар Мак-Конки (5.9);
• газоном на чашку с агаром Мюллера-Хинтона с наложением дисков пенициллина (10 мкг) и хлорамфеникола (30 мкг).
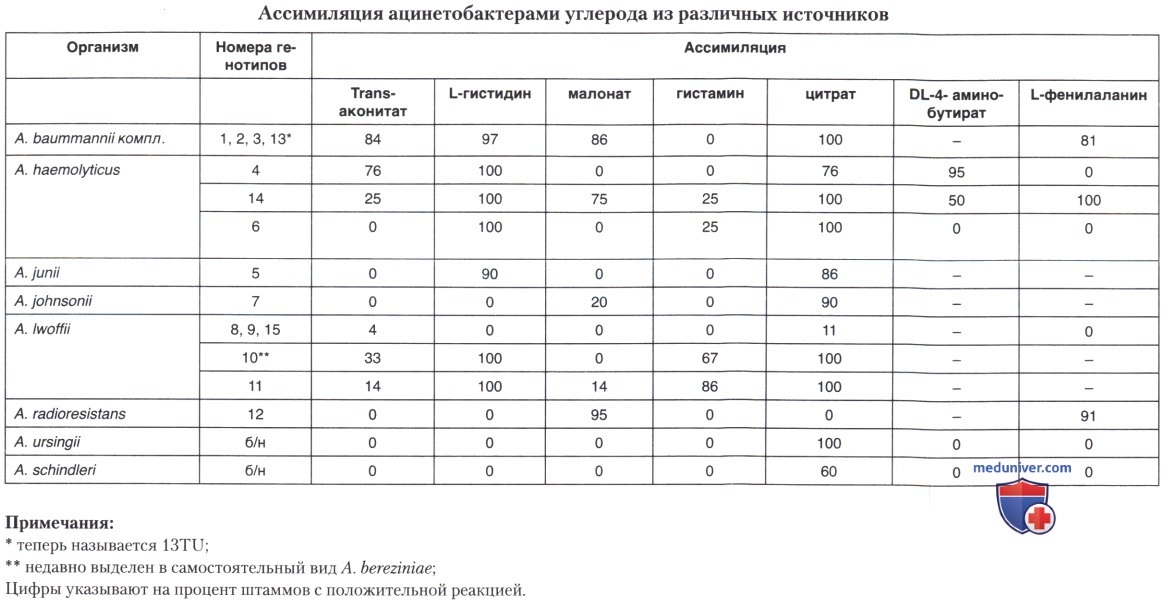
г) Четвертый день. Учитывают результаты посевов, сделанных ранее (т. е. 24 или 48 часов назад). Если выделенная грамотрицательная коккобактерия неподвижна, обладает каталазой, но не оксидазой, не ферментирует углеводы на среде Клиглера, то ее можно отнести к роду Acinetobacter. Дальнейшее разграничение по видам в условиях практических лабораторий сложно, так как требует специальных питательных сред на минеральной основе (среда по Stainer et al.) с добавлением источников углерода или азота. Однако при желании эти среды можно приготовить самостоятельно, используя 0,1%-ные растворы 7 источников. В обычных условиях из этих сред используют только жидкую среду с цитратом.
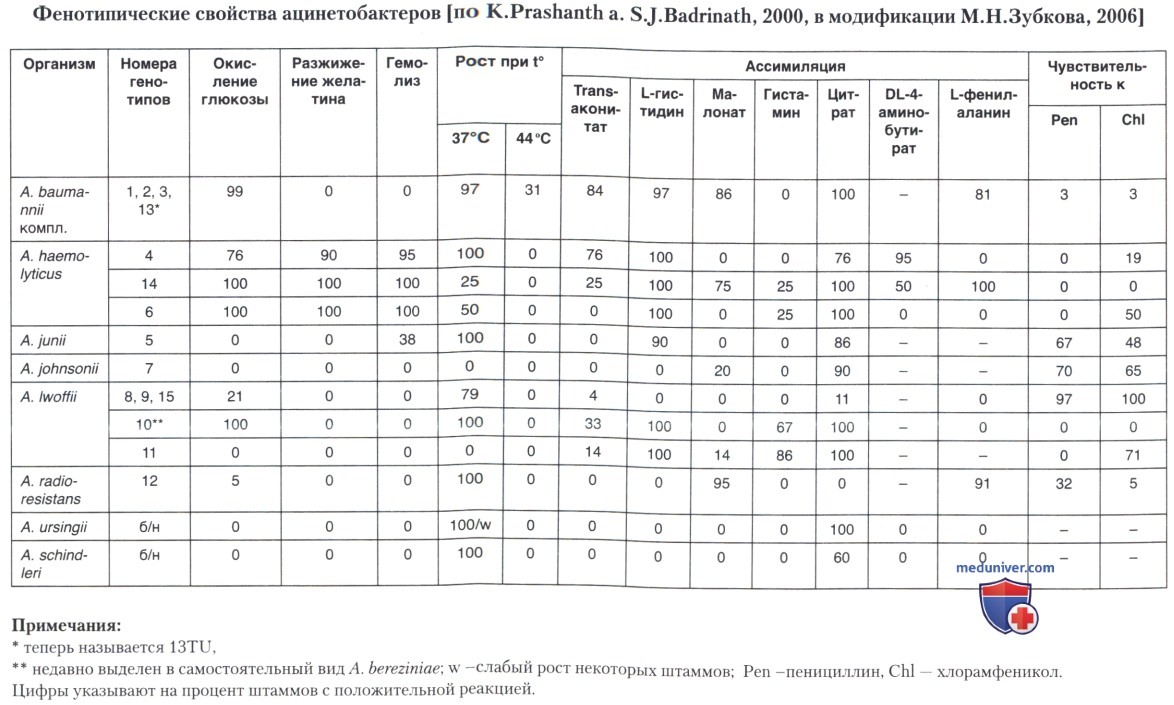
Для примерного разграничения видов можно учесть следующие признаки:
• окисление глюкозы, рост на среде с цитратом, отсутствие гемолиза и разжижения желатина, рост при 37°С и часто — при 44°С, рост на среде Мак-Конки в виде мелких красных колоний; устойчивость к пенициллину и хлорамфениколу свидетельствует в пользу A. baumannir,
• окисление глюкозы, наличие гемолиза и разжижжсния желатина, рост на среде с цитратом, устойчивость к пенициллину и часто — к хлорамфениколу, отсутствие роста при 44°С и на среде Мак-Конки говорит в пользу A. haemolyticus;
• один из геновидов A. Iwoffii окисляет глюкозу, но не разжижает желатин, не растет при 44°С, не дает гемолиза, не растет на средах с цитратом и Мак-Конки, устойчив к пенициллину и хлорамфениколу. Недавно его стали рассматривать как отдельный вид — A. bereziniae. Остальные два геновида различаются по окислению глюкозы, росту при 37°С и утилизации цитрата.
Известную помощь могут оказать тест-системы API20NE, Oxi/FermTube, Vitek2 и др.
Для выявления способности выделенных штаммов к образованию биопленки (как фактора патогенности) культуру ацинетобактера высевают на питательный агар с 0,08% конго красным (см. раздел 5.9). Штаммы, формирующие биопленки, и, следовательно, матричный полимер PNAG, образуют красные колонии; PNAG-отри-цательные штаммы образуют колонии белого цвета.
Для скрининговых исследований в отделении (выявление лиц и предметов, инфицированных множественно устойчивыми ацинетобактерами, обычно — A. baumannii) используют посев патологического материала, смывов с кожи рук, предметов внешней среды и т.п. Зарубежные авторы рекомендуют для этого применять среду Мак-Конки с цефтазидимом (8 мкг/мл) и амфотерицином В (2 мкг/мл).
Важнейшим этапом бактериологического исследования на ацинетобактер является определение выделенных и идентифицированных культур к антибиотикам.
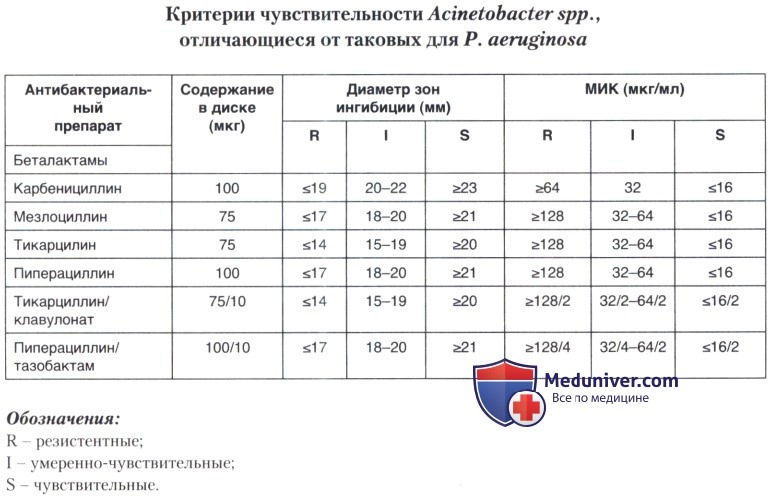
д) Определение чувствительности выделенных культур ацинетобактера к антибиотикам. Чувствительность ацинетобактеров к большинству антибиотиков в практических условиях определяют на среде Мюллера-Хинтона разными способами — методом серийных разведений в агаре и бульоне, диск-диффузионным методом; используется также Е-тест. Следует отметить, что для определения чувствительности к полимиксинам (полимиксин В, колистин) рекомендуется применять только метод разведений в бульоне, так как крупные молекулы этих препаратов плохо диффундируют в агар, что может привести к занижению минимальных ингибирующих концентраций (МИК) или диаметра зон задержки роста. В качестве контрольного штамма используется штамм Р. aeruginosa АТСС 27853.
При оценке результатов определения чувствительности следует пользоваться значениями МИК и диаметра зон подавления для Р. aeruginosa (см. таблице в статье о Р. aeruginosa) и лишь в некоторых случаях для Acinetobacter.
Для определения чувствительности ацинетобактеров в первую очередь рекомендуется использовать, как минимум, следующие препараты:
• цефтазидим или цефепим,
• имипинем или меропенем,
• ампициллин-сульбактам,
• ципрофлоксацин или левофлоксацин,
• гентамицин или тобрамицин.
Возможно расширение спектра препаратов — ампициллин, тетрациклин или доксициклин, ко-тримоксазол, цефотаксим или цефтриаксон, прочие фторхинолоны, полимиксины.
Для подтверждения результатов желательно одновременно использовать Е-тест.
Что касается культур ацинетобактеров, выделенных из крови и прочих стерильных в норме материалов, а также от пациентов в критическом состоянии из отделений интенсивной терапии, то ради быстрого выявления множественно устойчивых штаммов начинать определение чувствительности надо с постановки Е-теста.
Для проведения Е-теста с ацинетобактерами используют полоски промышленного изготовления, содержащие следующий набор препаратов: цефтазидим, меропенем, ампициллин-сульбактам, ципрофлоксацин и миноциклин.
е) Установление этиологической роли ацинетобактера при выделении его от больного. Выделение ацинетобактера из стерильной в норме жидкости человека (кровь, СМЖ, синовиальная, плевральная жидкости и т. п.) свидетельствует о его этиологической роли даже, если он выделен в смешанной культуре. Обнаружение ацинетобактера в отделяемом ран и открытых полостей в преобладающих количествах, по сравнению с другой флорой, также говорит в пользу признания его агентом воспалительного процесса. Об этом же свидетельствует и повторное выделение микроорганизма. Выделение ацинетобактера из участка, не являющегося воспалительным очагом (кожа, слизистые оболочки, кишечник), говорит в пользу носительства.
Обнаружение множественно устойчивого ацинетобактера в отделении хотя бы у носителей и на предметах внешней среды является серьезной угрозой в плане возникновения очага внутрибольничной инфекции.
- Читать далее "Лечение и профилактика инфекции ацинетобактер (Acinetobacter)"
Редактор: Искандер Милевски. Дата публикации: 20.4.2020
- Условно-патогенные бактерии рода Acinetobacter: таксономия, морфология
- Устойчивость ацинетобактеров (Acinetobacter) к внешним факторам
- Факторы патогенности ацинетобактеров (Acinetobacter)
- Клиника инфекции ацинетобактер (Acinetobacter)
- Эпидемиология внутрибольничной инфекции ацинетобактер (Acinetobacter)
- Микробиологическая диагностика ацинетобактер (Acinetobacter)
- Лечение и профилактика инфекции ацинетобактер (Acinetobacter)
