Лабораторная диагностика ботулизма
Лабораторная диагностика основывается на обнаружении ботулинического токсина или возбудителя ботулизма в материалах, взятых от больного (кровь, рвотные массы, промывные воды желудка, кал и др.), а также в пищевых продуктах, которые вызвали отравление. Важно установить не только присутствие токсина или микроба, но и определить тип токсина, чтобы подтвердить клинический диагноз и назначить правильное лечение. Кровь необходимо брать до введения больному лечебной сыворотки. В пробы, взятые для лабораторных исследований, а также в пищевые продукты, нельзя добавлять консервирующие вещества. Материалы должны храниться в холодильнике. Пробы, поступившие в лабораторию, исследуются одновременно по двум направлениям: две трети предварительно подготовленной пробы (получают фильтрат или центрифугат) предназначаются для обнаружения ботулинических токсинов в реакции нейтрализации, одна треть — для посевов с целью выделения ботулинических микробов.
а) Отбор и транспортировка проб для лабораторного исследования. Результаты лабораторного исследования при ботулизме в значительной мере зависят от времени, способа и условий отбора образцов, условий их транспортировки и хранения до начала исследования.
Обнаружение ботулинических токсинов и возбудителей ботулизма наиболее вероятно, если пробы от больных были взяты в максимально короткие сроки от начала заболевания, незамедлительно доставлены в лабораторию, а исследования были начаты сразу после их получения.
На исследование направляются следующие материалы: остатки подозреваемой пищи, которая употреблялась заболевшими, от каждого заболевшего кровь, рвотные массы, промывные воды желудка и испражнения. От погибших для исследования направляют кровь, содержимое желудка, отрезок тонкого и толстого кишечника, паренхиматозные органы (печень, селезенка).
Отбор проб для бактериологического исследования производят в стерильную посуду. Консерванты не добавляют. Обработка посуды дезинфицирующими средствами не допускается.
Пищевые продукты доставляются в той упаковке, в которой они находились. Если оригинальная упаковка небольшая, то ее необходимо поместить в стерильный контейнер. Пустая упаковка (банка, пакет, посуда и пр.), в которой находился подозреваемый продукт, также подлежит исследованию. Если остатки подозреваемого продукта отсутствуют, для исследования отбирают аналогичные продукты и банки с маркировкой, полностью идентичной вскрытой банке, при этом бомбажные банки исследуют в первую очередь.
Пищевые продукты для исследования отбирают в количестве 50-100 г. Материалы от заболевших берут до введения противоботулинической сыворотки. Кровь берут в количестве не менее 10-15 мл, рвотные массы — 25-50 г, испражнения — 25-50 г. Промывные воды и испражнения, если они брались при помощи клизмы, желательно получить в наименее разведенном виде с наличием твердых частиц. Для промывания желудка и клизмы следует применять стерильную или кипяченую воду. При необходимости обследования животных весь материал отбирают так же, как и от людей.
Пробы секционного материала отбирают в количестве 50-100 г от каждого органа. Берут их стерильно, для чего поверхность органа прижигают раскаленным шпателем. Пробы от каждого органа помещают в отдельные банки с плотными пробками.
Каждая проба снабжается этикеткой, в которой указывают: номер пробы, дату и время взятия, наименование материала или продукта. На каждой пробе, взятой от больного, и пробе секционного материала указывают фамилию имя и отчество больного и номер истории болезни.
В сопроводительном документе необходимо помещать дополнительно всю информацию по каждой пробе: рвотные массы первичные или повторные, промывные воды первичные или повторные, испражнения взяты при клизме и т.д. После отбора пробы до момента их отправки помещают в холодильник при 4-6°С.
Пересылку проб в лабораторию необходимо производить в кратчайшие сроки, не позже дня их взятия, так как при длительном хранении возможность получения объективного результата уменьшается.
Пробы упаковывают таким образом, чтобы гарантировать стерильность и сохранность материала при доставке в лабораторию. Транспортируют при 4-6°С в контейнерах с охлаждением или в ящиках со льдом (предохранять от замерзания). Упаковка, пересылка, порядок направления и оформления производятся в соответствии с общепринятыми правилами и действующими инструкциями.
Собранные материалы должны быть направлены для исследования в наиболее квалифицированную санитарно-бактериологическую лаборатория областного или городского центра Госсанэпиднадзора.
Лаборатория ГСЭН должна быть заранее извещена о направлении образцов для исследования; необходимо указать, сколько и какие образцы отправлены. Такая информация позволит подготовить все необходимые материалы и оборудование для проведения лабораторных исследований.
б) Подготовка проб для исследования. Исследование материалов, доставленных в лабораторию, производится немедленно по их получении. До завершения исследований все пробы хранят при температуре 4-6°С. Все пробы регистрируют с обязательным указанием даты и времени их отбора и доставки, условий транспортировки, упаковки, сохранности, наличии пломб и печатей, сопроводительных документов. Отмечают количество доставленного материала, его внешний вид, цвет, запах и другие характерные особенности.
Жидкие пробы (сыворотка крови больного, пищевые продукты, смывы и прочие) исследуют без предварительной обработки. При необходимости их центрифугируют при 1200 об/мин при 4°С в течение 10-15 мин.
Пробы плотной консистенции помещают в стерильную ступку, взвешивают (предварительно взвешивают ступку), измельчают стерильными желатинфосфатным буфером pH 6,2 либо ножницами или ножом, добавляют физиологический раствор, перемешивают, накрывают чашкой Петри и оставляют при комнатной температуре на 1,5-2 ч для экстрагирования.
Для исследования промывных вод желудка, по возможности, отбирают или осаждают путем центрифугирования плотные частицы, растирают их в ступке и экстрагируют в промывной жидкости 30-60 мин. При экстрагировании соленых продуктов вместо физиологического раствора необходимо добавлять дистиллированную воду.
Объем физиологического раствора или дистиллированной воды не должен превышать 1-3 объемов от веса исследуемого продукта, в зависимости от его консистенции (чем меньше добавлено физиологического раствора, тем вероятнее обнаружение токсина).
Жидкие пробы или экстракты, приготовленные из проб плотной консистенции, центрифугируют при 1200 об/мин 10-20 мин при 4-6°С или фильтруют через ватно-марлевый фильтр. Применять фильтровальную бумагу, тальковые и другие фильтры недопустимо, так как при этом ботулинические токсины могут адсорбироваться на поверхности фильтра.
Подготовку проб необходимо проводить таким образом, чтобы получить не менее 15-20 мл исходного материала, который обеспечит проведение исследований в полном объеме.
1. Получение сыворотки крови. Следует тщательно отделить сыворотку от сгустка крови. С целью лучшего формирования сгустка, кровь выдерживают 30-40 мин при комнатной температуре или при 37°С в термостате, затем стерильной пипеткой Пастера отделяют сгусток от стенок пробирки и помещают в холодильник при температуре 4-6°С на 30-40 мин для окончательного формирования сгустка. Сыворотку отсасывают и используют для обнаружения ботулинических токсинов, а сгусток крови используют для посева.
2. Подготовка проб для исследования испражнений. Отбирают в стерильную ступку 25-50 г испражнений, тщательно растирают пестиком, постепенно добавляют желатинфосфатный буфер или физиологический раствор в отношении 1:1-1:3. Выдерживают в холодильнике при 4-6°С в течение 6-18 ч, центрифугируют при 1200 об/мин в течение 20 мин при 4-6°С. Если экстракт недостаточно прозрачен, центрифугирование надосадочной жидкости можно повторить.
3. Хранение образцов. Подготовленные для исследования пробы, экстракты, центрифугаты и прочие материалы, сохраняют до конца исследования при 4-6°С. Остатки исходных материалов (образцы органов и тканей, сыворотка крови, пищевые продукты и т.д.) сохраняются при 4-6°С в течение 10 дней со дня выдачи ответа о результатах исследования. Уничтожение их осуществляется по распоряжению главного врача путем автоклавирования.
в) Определение ботулинических токсинов:
1. Подготовка проб. Пробы, поступившие в лабораторию, исследуют одновременно по двум направлениям: производят обнаружение ботулинических токсинов и ботулинических микробов. Две трети предварительно подготовленной пробы предназначают для обнаружения ботулинических токсинов, одну треть — для посевов с целью обнаружения ботулинических микробов. Часть пробы, которую исследуют на наличие токсинов, выдерживают в течение 1-1,5 ч при комнатной температуре для экстракции токсинов, фильтруют через ватно-марлевый фильтр или центрифугируют при 2600-3000 об/мин, в течение 15-20 мин. Фильтрование через тальковый фильтр недопустимо, так как тальк адсорбирует на себе ботулинические токсины. Для обнаружения ботулинических токсинов с полученными фильтратами или надосадочной жидкостью ставят реакцию нейтрализации токсина антитоксической сывороткой.
2. Обнаружение ботулинических токсинов в реакции нейтрализации. Для обнаружения токсинов следует взять для каждой пробы 4 мышей весом 16-18 г. В связи с тем. что в исследуемом материале может быть один или несколько типов ботулинических токсинов, предварительную реакцию необходимо ставить со смесью противоботулинических диагностических сывороток типа А, В, С, Е, Е Для этого выпускаются сухие типоспецифические диагностические сыворотки, титр которых должен быть в следующих пределах: для типа А — 200-400 ME, для типа В — 100-200 ME, для типа С — 200-300 ME, для типа Е — 200-400 ME, для типа F — 50-100 ME.
Доза сыворотки, которую рекомендуют для реакции нейтрализации, как правило, обеспечивает нейтрализацию гомологичного токсина в исследуемой пробе, ибо в организме и выделениях больных, а также в экстрактах из пищевых продуктов очень сильные токсины почти не встречаются. Нельзя пользоваться для целей диагностики лечебными противоботулиническими сыворотками.
Для постановки реакции нейтрализации готовят смесь из равных объемов моновалентных сывороток типов А, В, С, Е, Е Сыворотки каждого типа необходимо набирать разными пипетками. Из каждой исследуемой пробы наливают в две пробирки равное количество (1,5-2,4 мл) фильтрата или надосадочной жидкости. Остаток сохраняют в холодильнике для дальнейших исследований. В одну пробирку (контроль) добавляют 0,6 мл физиологического раствора, в другую (опыт) — 0,6 мл смеси моновалентных сывороток.
Содержимое пробирок перемешивают и оставляют при комнатной температуре на 30 мин, после чего содержимое каждой пробирки вводят в/п в объеме 0,7-1,0 мл двум белым мышам. Исследуемый материал из каждой пробирки следует вводить разными шприцами или сначала контрольную, а затем опытную смесь.
Наблюдение за животными проводят в течение 4 дней, однако, если мыши болеют или погибают раньше этого срока, то тут же ставят реакцию нейтрализации с моновалентными сыворотками. Ботулинический токсин не вызывает молниеносной гибели животных (в течение нескольких минут или секунд), мыши погибают не ранее, чем через 4-5 ч. При наличии ботулинического токсина погибают две мыши. Мыши, которым вводили смешанный с сыворотками фильтрат, остаются живы.
Обычно картина болезни и гибели мышей очень характерна: появляется учащенное дыхание, состояние полного расслабления мышц, западение брюшной стенки (осиная, талия), паралич и судороги перед смертью.
В случае гибели всех 4 мышей, т.е. тех, которым был введен фильтрат без сыворотки и с сывороткой, следует повторить реакцию нейтрализации с экстрактами, разведенными в 5, 10, 20 и даже 100 раз. При разведении экстрактов посторонняя микрофлора теряет способность убивать мышей, а ботулинические токсины, обладая обычно большей биологической активностью, будут вызывать гибель мышей даже при разведении фильтратов (экстрактов).
Вместо мышей для реакции нейтрализации могут быть использованы морские свинки весом 250-300 г. Одной из них вводят подкожно или внутрибрюшинно 0,5 мл смеси сывороток А, В, С, Е, F и 3 мл испытуемого фильтрата (или надосадочной жидкости), контрольной свинке вводят 3 мл испытуемого материала.
В случае обнаружения в пробе ботулинического токсина сразу же ставят развернутую реакцию нейтрализации для определения типа токсина с типоспецифическими диагностическими сыворотками.
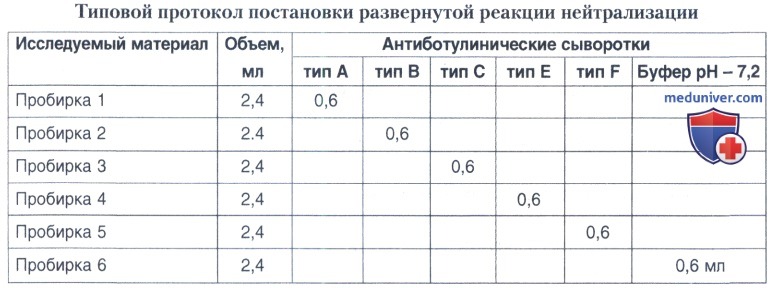
В 6 пробирок разливают по 2,4 мл исследуемого фильтрата, затем в каждую пробирку добавляют по 0,6 мл сыворотки: в первую пробирку — сыворотку типа А, во вторую — типа В, в третью — типа С, в четвертую — типа Е, в пятую — типа F, в шестую — приливают 0,6 мл буферного физиологического раствора, pH - 7,2. Все сыворотки разливают разными пипетками. Смесь после 30 мин выдерживания при комнатной температуре вводят внутривенно или внутрибрюшинно по 1 мл двум мышам из каждой пробирки отдельными шприцами.
Учет результатов проводится через 4-6 ч, 24 ч и далее на протяжении 4 дней. При наличии ботулинического токсина выживают мыши, получившие смесь токсина и гомологичной сыворотки, остальные погибают. Тип сыворотки, нейтрализующей токсин, указывает на типовую принадлежность токсина. Например, если гибнут все мыши, кроме тех, которым введено содержимое пробирки 1, это значит, что в исследуемом материале имеется токсин типа А.
Особое внимание нужно обратить на постановку реакции нейтрализации сыворотки больного, так как ее обычно бывает мало. Следует тщательно отделить сыворотку от сгустка крови, который необходимо посеять, так как при ботулизме можно обнаружить в крови палочку ботулизма, а с сывороткой поставить реакцию нейтрализации. В этом случае, следует сразу поставить развернутую реакцию нейтрализации с моновалентными ботулиническими сыворотками только типов А, В, Е. Для этого в три пробирки поровну разливают всю сыворотку больного, а затем в первую пробирку добавляют диагностическую сыворотку типа А — 0,4 мл, во вторую — типа В, в третью — типа Е. Все содержимое каждой пробирки вводят поровну двум мышам. Например, если в каждую пробирку налили по 1,8 мл сыворотки больного, а затем по 0,4 мл диагностической сыворотки, всего в пробирке будет 2,2 мл смеси. Эту смесь вводят внутривенно или внутрибрюшинно мышам по 1 мл (0,2 мл останется на стенках пробирки). Выжившие мыши укажут на тип токсина в крови больного; контролем будут служить павшие мыши, которым была введена сыворотка больного в смеси с диагностической ботулинической сывороткой других типов.
При получении положительной реакции нейтрализации с диагностическими бо-тулиническими сыворотками дают заключение о наличии в исследуемом материале ботулинического токсина и указывают его тип.
Нередко постановку реакции нейтрализации как с поливалентной, так и с моновалентной сыворотками приходится повторять из-за неспецифической токсичности посторонней микрофлоры, которая обычно имеется в рвотных массах, кале, органах трупов, поэтому в лучшем случае ответ о наличии токсина в пробе может быть дан на 2-3-й день, а о его типовой принадлежности — на 3-5-й день от начала исследования. В настоящее время установлено, что противоботулиническая сыворотка типа Е нейтрализует также ботулинический токсин типа F и наоборот. Поэтому при получении положительной реакции нейтрализации одновременно с противоботулиническими сыворотками типа Е и F следует провести дифференциальную диагностику — определить, относится ли обнаруженный токсин к типу Е или к типу F. Для этого следует поставить реакцию нейтрализации на мышах параллельно с двумя противоботулиническими диагностическими сыворотками типа Е и типа F, разведенными до концентрации 1 МЕ/мл. Удобнее всего для этих целей использовать стандартные противоботулинические сыворотки, выпускаемые ГКИ им. Тарасевича. Для этого в три пробирки наливают по 2,4 мл испытуемого экстракта, а затем в первую пробирку наливают 0,6 мл диагностической сыворотки типа Е, во вторую — 0,6 мл типа F, разведенных до концентрации 1 МЕ/мл, в третью — контрольную — 0,6 мл физиологического раствора. Если мыши погибают только в контроле и от сыворотки типа Е, то в экстракте имеется токсин типа F. Если наряду с контролем погибают мыши, которым введена смесь с сывороткой типа F, а выживают только мыши, получившие сыворотку типа Е, то в экстракте имеется токсин типа Е.
Другие предложенные методы лабораторной диагностики ботулизма (метод подсчета фагоцитарного индекса, использование люминесцирующих сывороток) являются сугубо экспериментальными и в широкой практике не применяются из-за недостаточной специфичности. В то же время, реакция пассивной гемагглютинации и ИФА могут быть использованы для быстрого анализа подозреваемых продуктов на присутствие в них ботулинических токсинов. Результат может считаться достоверным только в случае положительного результата. При отрицательном результате необходимо провести реакцию нейтрализации на мышах. Наиболее перспективным диагностическим методом является полимеразная цепная реакция (ПЦР), которая позволяет идентифицировать возбудитель в том же разведении образца, в котором содержится 1 DLM ботулинического токсина. Этот метод может быть применен для идентификации С. botulinum в пищевых продуктах и содержимом кишечника, однако он непригоден для обнаружения ботулинических токсинов в любых биологических материалах, включая кровь больных, ввиду низкой чувствительности метода.
в) Обнаружение возбудителей ботулизма:
1. Первый день. Для обнаружения возбудителей ботулизма производят посев 3-5 мл из 1/3 предварительно подготовленного материала на жидкие питательные среды. Для первичных посевов лучше использовать среды на основе гидролизатов белков (мяса, казеина), например, среду типа Китт—Тароцци. Необходимо, чтобы pH был в пределах 7,2-7,4. Обязательным является также наличие в мясных средах мясного или печеночного фарша, а в казеиновых — отварного пшена и ваты в качестве адсорбента. Пробирка или флакон должны быть заполнены питательной средой не менее чем наполовину. Перед посевом среды нагревают на кипящей водяной бане в течение 20 мин для удаления воздуха, после чего быстро охлаждают, добавляют 0,5% глюкозы и производят посев.
Посевы надо производить в среды в больших пробирках или во флаконах емкостью по 100-200 мл, залитые слоем вазелинового масла толщиной в 0,5 см. Лучше засевать исходный посевной материал в большой объем среды (70,0-150 мл), чтобы культуральной жидкости первичного посева хватило на все исследования (постановка реакции с поливалентной сывороткой и развернутой реакции нейтрализации, нередко с двух- или трехкратным повторением). Последующие пересевы исследуемых проб из первичного посева в те же жидкие питательные среды могут не дать токсинообразования в среде, по-видимому, из-за бурного роста посторонней микрофлоры. Посев следует производить в четыре флакона, один из которых прогревают после посева при 60°С 15 минут. В этих условиях прогревания обычно погибают аэробы и вегетативные формы анаэробов, но сохраняются споры С. botulinum типа Е, которые погибают при 80°С; другой флакон прогревают при 80°С 20 мин. Два флакона после посева не прогревают. После этого все флаконы помещают в термостат: один непрогретый флакон и флакон, прогретый при 60°С, инкубируют при 28°С, другой непрогретый флакон и флакон, прогретый при 80°С, инкубируют при 35°С. Первые два флакона исследуют на С. botulinum типов Е и F, вторые два флакона — на С. botulinum типов А, В, С.
Если в исследуемом материале возбудители ботулизма находятся преимущественно в вегетативной форме, то рост в посевах будет главным образом в непрогретых флаконах. В том же случае, если в материале имеются споровые формы, рост будет в прогретых флаконах и в отдельных случаях может сразу привести к выделению чистой культуры. Рост С. botulinum характеризуется нередко сильным газообразованием и иногда протеолизом кусочков печени или фарша.
После посева все исходные образцы проб следует сохранять при 4°С до окончания исследования. Через 48 ч после появления роста посевы исследуются на наличие возбудителей ботулизма.
Имеется сообщение зарубежных ученых, что для выявления С. botulinum типа Е в среду перед посевом следует добавлять трипсин до конечной концентрации 0,1%. В опытах этих исследователей процент выявления С. botulinum типа Е в исследуемых пробах почвы на среде с трипсином увеличился до 74%, в то время как исследование на среде без трипсина дало положительный результат лишь в 17% проб.
Поскольку для этих исследований требуется трипсин в довольно больших количествах, его можно заменить 4% раствором панкреатина. Кроме того, для таких сред следует использовать пробирки объемом 15-20 мл. Во флакон, который предварительно прогревается, трипсин добавляют после прогревания.
2. Второй день. Через 48 ч от начала роста из всех флаконов с соблюдением стерильности берут пробы культуральной жидкости (по 10-15 мл) и подвергают их исследованию. Предварительно готовят мазки, окрашивают их по Граму и микроскопируют. С культуральной жидкостью ставят реакцию нейтрализации с поливалентной про-тивоботулинической сывороткой типов А, В, С, Е, F, как это описано для определения токсинов. При получении положительных результатов реакцию нейтрализации ставят с каждой сывороткой раздельно.
При обнаружении в исследуемом посеве палочек, типичных по морфологическим особенностям для С. botulinum, а также ботулинического токсина дают заключение о зараженности исследуемою материала возбудителем ботулизма и наличии в нем ботулинического токсина. Выделение чистой культуры в таком случае не является обязательным. Если в посевах обнаруживают микробы, морфологически сходные с С. botulinum, а токсин отсутствует, то следует перед постановкой реакции нейтрализации провести активацию культуральной жидкости панкреатином или трипсином для обнаружения ботулинических токсинов типа Е, непротеолитичных штаммов типа В и некоторых штаммов типа F, а также провести выделение и изучение чистых культур. Активацию культуральной жидкости перед постановкой реакции нейтрализации с противоботулиническими сыворотками проводят только и в том случае, если в среду перед посевом не был добавлен трипсин или панкреатин, как это рекомендовано выше.
Если через двое суток (48 ч) во флаконах не обнаружен рост, то необходимо продолжить инкубацию посевов в термостате, а исследование провести вновь на 4-6-10-е сутки. Если исследования, проведенные на 10-е сутки, не дали положительных результатов по обнаружению возбудителей ботулизма и их токсинов, то выдают ответ об отсутствии ботулинических палочек и их токсинов в исследуемых материалах.
Для выделения чистых культур ботулинических палочек применяют посев в столбики прозрачной агаровой среды или рассевают на плотные среды в чашках Петри.
Для посевов в столбик применяют одно- или полуторапроцентный агар с глюкозой, приготовленный на бульоне Вейнберга или Хоттингера, разлитый в пробирки диаметром 0,8 см и длиной 15-18 см. Перед посевом агар расплавляют и охлаждают до 45-50°. Посев на высокий столбик производят следующим образом: необломанный конец пастеровской пипетки погружают в исследуемый материал (чаще это первичный посев исследуемого материала) и переносят последовательно из пробирки в пробирку, тщательно перемешивая, после чего агар перемешивают еще раз путем перекатывания пробирок между ладонями. Охлажденные пробирки с посевом помещаются в термостат при температуре 35-37°С. На каждый посев следует брать 5-8 пробирок столбика агара. Если в первичной культуре рост не очень обильный, при пересеве на высокий столбик пастеровскую пипетку следует обломать и набрать немного культуры в капилляр, а затем проводить посев, как указано выше.
Если в первичном посеве имеется массивный рост посторонней микрофлоры и мало типичных ботулинических палочек со спорами, необходимо взять 5-10 мл культуры в пробирку и подвергнуть ее прогреванию на водяной бане при 80°С 20 мин. После этого культуру надо посеять на высокие столбики агара.
С целью рассева на агаровые среды в чашках Петри каплю исследуемой жидкости наносят на поверхность сахарно-кровяного или печеночного агара, разлитого толстым слоем (приблизительно 3-5 мм) в чашки Петри. Затем каплю шпателем слегка втирают в агар и последовательно переносят шпатель еще на 2-3 чашки. Чашки помещаются в микроанаэростат (различных марок) — крышкой кверху и выращивают при температуре 35-37°С. С целью поддержания достаточного вакуума на дно анаэростата ставится открытая чашка Петри со щелочным раствором пирогаллола.
3. Третий день. Через 1-2 сут. в последних пробирках с агаровыми столбиками появляются отдельные колонии в виде комочков ваты, пушинок с уплотненным центром или же правильных дисков, «чечевичек». I [одозрительные колонии перевивают на жидкую питательную среду в пробирках с 0,5% глюкозы (бульон Вейнберга, среда Китт-Тароцци) под слоем вазелинового масла. Одновременно оставшуюся часть колонии микроскопируют.
Пересев колоний из пробирок можно производить двумя способами: 1) столбик агара прокалывают сверху отломанным капилляром пастеровской пипетки и извлекают нужную колонию; 2) дно пробирки с высоким столбиком агара слегка подогревают на пламени горелки; под действием паров закипевшей жидкости агар выталкивается в стерильную чашку Петри; подозрительную колонию извлекают отломанным капилляром пастеровской пипетки.
Через сутки колонии ботулинического микроба на агаровых средах в чашках Петри приобретают вид прозрачных росинок дымчатого цвета диаметром 0,1-0,2 см, окруженных зоной гемолиза. Их отсевают в пробирки с бульоном Вейнберга или Хоттингера либо со средой Китт-Тароцци, под вазелиновым маслом.
4. Четвертый день. Культуры, выросшие из колоний, микроскопируют и проверяют на наличие токсина при помощи реакции нейтрализации на мышах.
д) Спиртовой способ выделения С. botulinum. Ввиду того, что при большом загрязнении исследуемых проб посторонней микрофлорой возникают трудности в выделении С. botulinum, особенно токсинотипа Е, из-за того, что чувствительность спор этого микроба к нагреванию не отличается от чувствительности вегетативных форм некоторых бактерий, рекомендуется простой метод выделения чистой культуры микроба, основанный на устойчивости спор палочки ботулизма к 50% спирту.
К 2 мл культуральной жидкости 2-3-дневной инкубации при 28°С, содержащей ботулинический токсин типа Е, добавляют равный объем этилового спирта-ректификата. Смесь выдерживают 1 ч при комнатной температуре, периодически перемешивая, а затем из нее делают высев на 2-3 чашки с печеночным агаром, содержащим желток куриного яйца (желток одного яйца добавляют в 500 мл расплавленного и охлажденного до 50°С агара). Через 48 ч инкубации при 35°С в анаэростате, среди колоний посторонней микрофлоры, С. botulinum дают небольших размеров колонии, окруженные жемчужным поясом. Следует отметить, что некоторые спорогенные анаэробы (С. sporogenes и др.) также имеют вокруг колоний ореол в виде жемчужного пояса. Эти колонии высевают в пробирки со средой Тароцци и исследуют после инкубации в термостате в реакции нейтрализации. Особенно этот метод рекомендуется для выделения чистой культуры С. botulinum токсинотипа Е.
е) При отсутствии в лаборатории анаэростатов для выращивания анаэробов можно использовать простой чашечный метод, когда воздух просто исключается из питательного агара. Метод заключается в следующем: засеянный и слегка охлажденный питательный агар наливают в крышку стерильной чашки Петри, после чего на агар, почти застывший, помещают саму чашу Петри так, чтобы дно ее плотно соприкасалось с поверхностью залитого агара. Края чашки можно залить парафином. При этом методе поверхность стекла плотно соприкасается с агаром по всей его площади, и в слое агара, находящемся между пластинками стекла, создаются условия, благоприятные для роста самых строгих анаэробов.
Выросшие колонии нужно рассматривать в лупу или стереоскопический микроскоп МБС-1. Часть колоний используют для приготовления мазков, которые микро-скопируют. С поверхности чашки колонии снимают петлей или пастеровской пипеткой и засевают на пробирки со средой типа Тароцци с 0,5% глюкозы. Выросшие посевы проверяют на чистоту путем микроскопирования и на наличие токсина путем постановки реакции нейтрализации на мышах.
ж) Метод активации прототоксина С.botulinum. Активацию прототоксинов производят в экстрактах из пищевых продуктов, промывных вод желудка и рвотных масс, а также культуральной жидкости посевов, если исследуемый материал был засеян в среду без трипсина или панкреатина.
Чистый сухой трипсин растворяют перед употреблением в физиологическом растворе в концентрации 1:100 (1%-ный раствор); этот раствор принимают за исходный. Для активации берут данный раствор из расчета, чтобы в активируемой культуральной жидкости его концентрация была равна 0,1%.
Трипсин может быть заменен сухим медицинским высокоактивным панкреатином (активность должна быть не менее 50 единиц), раствор которого готовят следующим образом: 4 г панкреатина растворяют в 100 мл физиологического раствора и оставляют в холодильнике при 4°С на ночь. Перед употреблением полученную жидкость фильтруют через плотный бумажный фильтр, а затем стерилизуют фильтрацией. Готовый раствор панкреатина может сохраняться при 4°С в течение 2 нед.
Исследуемую 4-5-суточную культуру, полученную на жидкой мясной или казеиновой среде, подвергают центрифугированию или фильтрованию с целью отделения микробных тел от культуральной жидкости. Готовый раствор трипсина добавляют из расчета создания в культуральной жидкости концентрации 0,1%, для чего на 1 мл культуральной жидкости берут 0,1 мл исходного 1%-ного раствора трипсина. Если вместо трипсина применяют панкреатин, то культуральную жидкость смешивают в равных объемах с готовым раствором панкреатина. Полученные смеси помещают в термостат при 37°С на 1 ч. По истечении указанного срока в активированной жидкости определяют наличие ботулинического токсина на белых мышах путем постановки реакции нейтрализации.
- Читать далее "Лечение и профилактика ботулизма"
Редактор: Искандер Милевски. Дата публикации: 18.12.2019
- Возбудитель ботулизма (Clostridium botulinum): таксономия
- Морфологические и тинкториальные свойства возбудителя ботулизма (C. botulinum)
- Устойчивость возбудителя ботулизма (C. botulinum) к факторам внешней среды
- Культурально-биохимические группы возбудителя ботулизма (C. botulinum)
- Факторы патогенности возбудителя ботулизма (C. botulinum)
- Нейротоксины и экзоцитоз возбудителя ботулизма (C. botulinum)
- Генетическая характеристика нейротоксинов возбудителя ботулизма (C. botulinum)
- Патогенез и клиника ботулизма
- Иммунитет к ботулизму
- Эпидемиология ботулизма
- Лабораторная диагностика ботулизма
- Лечение и профилактика ботулизма
