Микробиологическая диагностика пневмококковой инфекции
Вид материала и ход бактериологического исследования на пневмококк зависят от формы заболевания.
При пневмонии и поражениях бронхиального дерева основным материалом является мокрота (утренняя порция); кроме того, исследуют смывы с бронхов, получаемые при бронхоскопии, гной из абсцесса легкого или плевральную жидкость, которые берут путем пункции.
При культуральном исследовании мокроты необходимо учитывать два обстоятельства.
Во-первых, мокрота негомогенна, состоит из слизистых комочков, и микроорганизмы распределены в ней неравномерно. Поэтому необходима предварительная гомогенизация мокроты — растирание в ступке с песком (в стерильных условиях) или обработка муколитиками — веществами, растворяющими слизь (например, 0,5% ацетилцистеином, хемотрипсином), либо в гомогенизаторе.
Во-вторых, порции мокроты из нижних отделов респираторного тракта при прохождении через верхние отделы обязательно инфицируются микроорганизмами ротоглотки, среди которых могут быть и носительские пневмококки. Однако количество последних в пробах невелико, а агент воспаления легких или бронхов присутствует в мокроте в больших количествах. Поэтому гомогенизированную мокроту разводят серийно, с шагом 10, в 106-107 раз, после чего делают посевы из раз-ведений по 0,1 мл. Только при наличии роста в разведении мокроты в 106 и выше (а бронхиальных смывов — в 104) выделенный микроорганизм считается возбудителем заболевания.
При воспалении среднего уха отделяемое берут ватным тампоном, укрепленным на проволочном стержне.
При подозрении на менингит исследуют спинномозговую жидкость (СМЖ), взятую при помощи люмбальной пункции со строгим соблюдением правил асептики.
Жидкость при плевритах, асцитах, артритах также берут путем пунктирования в асептических условиях.
Гной при фронтитах, синуситах, отитах можно взять стерильным ватным тампоном во время хирургической операции или при спонтанном истечении.
Кровь у лихорадящих больных при подозрении на пневмококковую бактериемию берут стерильно из вены и без предварительной микроскопии засевают в специальные жидкие или двухфазные среды для гемокультур. Посевы инкубируют в термостате и делают из них высевы для получения чистых культур.
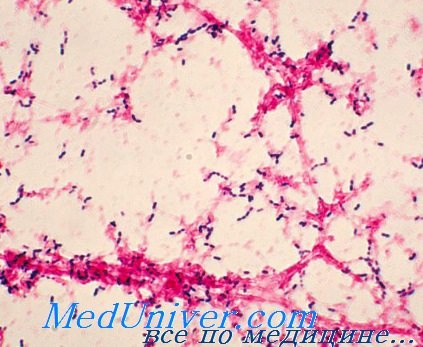
Первый день исследования. После взятия и обработки материала (мокрота, СМЖ, гной, плевральная и другие жидкости) из него готовят препараты-мазки, окрашенные по Граму; если при микроскопии видны грамположительные инкапсулированные диплококки ланцетовидной формы, то можно выдать предварительный ответ. Независимо от результатов бактериоскопии проводится полное бактериологическое исследование, цель которого — выделение чистой культуры и ее идентификация.
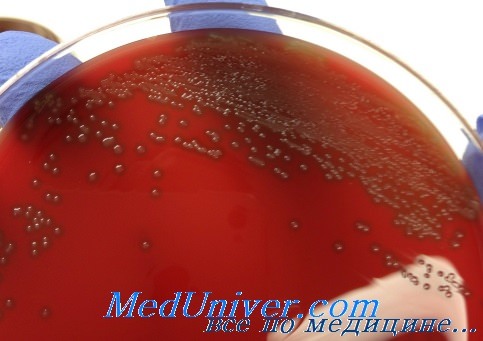
Основной средой для выделения чистой культуры пневмококка является питательный агар с добавлением 5-10% крови барана, лошади, кролика, который помещают в чашки Петри. Для подавления посторонней микрофлоры при исследовании материала из открытых полостей (легких, бронхов, пазух носа, среднего уха) на поверхность среды накладывают диск с антибиотиком мономицином или гентамицином, к которым пневмококк практически нечувствителен. Вокруг диска рост нормальной флоры подавляется.
Плевральную и другие жидкости из серозных полостей, а также инкубированную в жидкой среде кровь, высевают на 5%-ный кровяной агар.
При посеве СМЖ больного с подозрением на гнойный менингит, учитывая возможное присутствие в ней пневмококка, Haemophilus influenzae или менингококка, производят одновременный посев на «шоколадно»-кровяной агар и 20%-ный сывороточный агар. Засеянные чашки инкубируют в атмосфере с 5-10% CO2 (в «свечном» сосуде).
Второй день исследования. Через 24 ч инкубации посевы просматривают; подозрительные на пневмококк колонии отсевают в пробирки со скошенным сывороточным или кровяным агаром для окончательной идентификации. Так как колонии пневмококка на кровяном агаре очень сходны с колониями других видов стрептококков, окруженными зоной позеленения среды (α-гемолиз), — «зеленящих» оральных стрептококков, энтерококков, — то полученные из колоний чистые культуры дифференцируют с этими микроорганизмами.
Наиболее надежными признаками для дифференциации пневмококка и сходных с ним бактерий является его чувствительность к оптохину и желчи. Подлежащую дифференциации культуру засевают на кровяной агар с 0,00025% оптохина и на бульон с 10% желчи и для контроля — на эти же среды без оптохина и желчи. Возможно использование коммерческих дисков, пропитанных оптохином, а также самостоятельно приготовленных дисков, пропитанных раствором 20% желчи. В последнем случае диск накладывается на рост 22-24-часовой культуры на кровяном агаре; лизис наступает через 3 ч.
Одновременное применение обоих тестов обязательно, так как на слизистых оболочках встречается похожий на пневмококк S.pseudopneumoniae. Этот микроорганизм чувствителен к оптохину в обычных условиях, но устойчив к желчи. При сомнительных результатах желчного теста надо поставить оптохиновый тест, инкубируя чашки в присутствии CO2 («свечной сосуд»), В этих условиях S. pseudopneumoniae оказывается нечувствительным и к оптохину.
В качестве дополнительных признаков, позволяющих отличить пневмококк от сходных с ним (по морфологии клеток и колоний, а также α-гемолизу) энтерококков, можно применить следующие тесты: рост при температуре +10°С и +45°С; рост после прогревания бульонной культуры при 60°С в течение 30 мин; рост в бульоне с 6,5% хлорида натрия. Все эти пробы отрицательны у пневмококка, но положительны для энтерококка.
Третий день исследования. Готовят и микроскопируют окрашенные по Граму мазки из выросших культур. Морфологически пневмококк выглядит в культуре иначе, чем в мазках нативного материала (мокрота, СМЖ и т.д.). Клетки теряют ланцетовидную форму и образуют небольшие скопления или цепочки, состоящие из пар; капсула незаметна.
Учитывают результаты определения чувствительности выделенных культур к оптохину и желчи, а также данные других проб (если эти пробы были поставлены).
Возможна выдача окончательного ответа (о наличии или отсутствии в материале пневмококка). У выделенной культуры пневмококка определяют ее принадлежность к определенному серотипу (серогруппе), ряд признаков патогенности, а также чувствительность к антибиотикам.
Для серотипирования используют иммунные кроличьи сыворотки к наиболее распространенным типам (или хотя бы серогруппам). Реакция агглютинации не всегда пригодна из-за склонности пневмококка к спонтанному склеиванию. В таких случаях применяют реакцию набухания капсул на стекле по Neufeld, учитываемую при микроскопии смеси живой культуры с иммунной сывороткой.
В этой реакции специфические антитела, адсорбирующиеся на клеточной капсуле, создают оптический эффект утолщения капсулы по сравнению с клетками, взвешенными в изотоническом растворе хлорида натрия (контроль). Чтобы прозрачные капсулы были лучше заметны, в смесь бактерий и сыворотки, а также в контрольную взвесь вносят каплю 1% раствора метиленового синего. Видовую принадлежность культуры к S.pneumoniae можно подтвердить при помощи так называемой Омни-сыворотки, полученной путем иммунизации кроликов культурами всех типов пневмококка, в реакции набухания капсул или в агглютинации.
Хорошие результаты серогруппирования получены с использованием реакции коагглютинации с коммерческим реагентом или приготовленным самостоятельно из взвеси формалинизированного стафилококка и иммунных сывороток.
Для выявления вирулентности выделенного штамма ставят пробы на пневмолизин, гиалуронидазу, определяют летальные дозы для мышей.
Пневмолизин можно определить качественным методом путем посева культуры в чашку на питательный агар с 2% лошадиной крови и 10% нормальной сыворотки с последующей инкубацией в анаэростате. Через 22—24 ч вокруг колоний образуется зона β-гемолиза. Более рационален количественный метод. Используют 24-часовую культуру пневмококка на бульоне с 0,001%-ным раствором лецитина. Такая культура содержит уже аутолизированные клетки. Делают ряд двукратных серийных разведений культуры (в пробирках или в лунках микротитратора) и в каждое добавляют равный объем 0,5%-ной взвеси эритроцитов (человека, барана). Смесь инкубируют 1 ч в термостате, а затем сутки — в холодильнике. Наивысшее разведение, при котором наблюдается лизис эритроцитов, принимают за титр пневмолизина. Этот метод позволяет сравнивать пневмолитическую активность различных штаммов.
Гиалуронидазу определяют по методу Мак-Клина-Смирновой с использованием в качестве субстрата гомогената пупочных канатиков.
Вирулентность для белых мышей (14-16 г) устанавливают путем внутрибрюшинного введения разведений суточной агаровой культуры. Высоковирулентными считаются штаммы, ЛД50 которых не превышает 103 КОЕ, низковирулентными — штаммы, ЛД50 которых свыше 106 КОЕ.
Экспресс-методы микробиологической диагностики пневмококковой инфекции. В инфицированных пневмококком жидкостях организма, в частности, в моче, находятся растворенные специфические капсульные антигены. Для их выявления применяют реакции латекс-агглютинации или коагглютинации на стекле, иммуноферментный анализ, реакцию иммунофлюоресценции. В качестве источника антител в этих реакциях используется или Омни-сыворотка, содержащая антитела ко всем серотипам пневмококка, или сыворотка к видовому поверхностному антигену.
Серологическая диагностика. К концу первой недели острой пневмококковой инфекции (пневмонии, менингита, отита и т.д.) специфические антитела к капсульным полисахаридам появляются в слюне (IgA), а к 7-10-му дню — уже в крови (IgG). Антитела удается выявить в реакции непрямой иммунофлюоресценции с использованием серотиповых штаммов (или аутоштамма), иммуноферментного анализа с применением типовых капсульных полисахаридов. Серологические реакции с использованием видовых пневмококковых антигенов не разработаны.
При интерпретации результатов серологических реакций следует помнить, что в крови детей в возрасте до 6 мес. содержатся материнские антитела (IgG), и с этого срока до 2 лет дети слабо реагируют на капсульные антигены. Кроме того, у более старших детей и взрослых могут содержаться антитела к пневмококку как следствие предшествующих встреч с этим микроорганизмом. Указанные обстоятельства снижают ценность серодиагностики пневмококковой инфекции. В пользу этиологического значения пневмококка при острой пневмонии может говорить нарастание специфических антител в 4 раза и более.
Хранение и транспортировка выделенных культур пневмококка. Хранение культур S. pneumoniae затруднено из-за его склонности к аутолизу. Для хранения рекомендуют засевать культуру в пробирку со скошенным кровяным агаром, но не инкубировать в термостате, а хранить при 4-7°С в холодильнике. В таком состоянии возможна и транспортировка культур. Для регенерации культуры засеянную среду инкубируют при 37°С в течение 1 сут.
- Читать далее "Определение чувствительности к антибиотикам пневмококковой инфекции"
Редактор: Искандер Милевски. Дата публикации: 21.11.2019
- Пневмококк (Streptococcus pneumoniae): морфология и культурально-биохимические свойства
- Антигены пневмококка (S. pneumoniae)
- Факторы патогенности пневмококка (S. pneumoniae)
- Биологические модели пневмококковой инфекции
- Клинические проявления пневмококковой инфекции
- Иммунитет при пневмококковой инфекции
- Эпидемиология пневмококковой инфекции
- Микробиологическая диагностика пневмококковой инфекции
- Определение чувствительности к антибиотикам пневмококковой инфекции
- Лечение и профилактика пневмококковой инфекции
