Факторы неспецифической резистентности (защиты) организма
Иммунитет (от лат. immunitas—освобождение, избавление от чего-либо) — это наследственно закрепленная и индивидуально приобретенная невосприимчивость многоклеточного организма к генетически чужеродным агентам экзогенной и эндогенной природы. Генетически чужеродные агенты (не свои) поступают в организм извне в виде патогенных микроорганизмов, гельминтов, их токсинов, белков и других веществ, иногда в виде трансплантируемых тканей или органов либо возникают в самом организме (например, его собственные отжившие, мутировавшие или поврежденные клетки).
Распознавание таких чужеродных агентов и специфическое реагирование на них является функцией системы защиты, получившей название иммунной системы.
Известно два основных механизма защиты организма от чужеродных агентов:
• Первый обусловлен действием врожденных факторов неспецифической резистентности (от лат. resistentia—сопротивление) и контролируется генетическими механизмами—врожденный видовой иммунитет. Они обеспечивают неселективный по отношению к чужеродному агенту характер ответа. Так, например, человек невосприимчив к возбудителям чумы собак, холеры кур, а животные — к шигеллам, гонококку и другим патогенным для человека микроорганизмам.
• Второй определяется защитными механизмами, которые реализуются с участием лимфатической системы. Они лежат в основе формирования выработанного в течение жизни индивидуального адаптивного (приобретенного) иммунитета. Такой иммунитет характеризуется развитием специфических реакций иммунной системы на конкретный чужеродный агент (т. е. является индуцируемым) в виде образования иммуноглобулинов или сенсибилизированных лимфоцитов. Эти факторы обладают высокой активностью и специфичностью действия. В зависимости от способов формирования различают несколько типов приобретенного индивидуального иммунитета.
Факторы неспецифической резистентности (защиты), определяющие неселективный характер ответа на антиген, обеспечивают наиболее прочную форму невосприимчивости. Они обусловлены врожденными биологическими особенностями вида и реагируют на чужеродный агент независимо от его природы, стереотипно. Основные механизмы неспецифической защиты формируются под контролем генетического кода в процессе развития организма и связаны с естественнофизиологическими реакциями широкого спектра: механическими, химическими и биологическими.
Среди факторов неспецифической резистентности выделяют:
• ареактивность клеток макроорганизма к патогенным микроорганизмам и токсинам, обусловленную генотипом и связанную с отсутствием на их поверхности рецепторов для адгезии патогенного агента (отсутствие мишени);
• барьерную функцию кожи и слизистых оболочек, которая обеспечивается как отторжением клеток эпителия кожи и активными движениями ресничек мерцательного эпителия слизистых оболочек, так и выделением экзосекретов потовых и сальных желез кожи, специфических ингибиторов, лизоцима, кислой средой желудочного содержимого и другими агентами. Биологические факторы защиты на этом уровне обусловлены губительным воздействием нормальной микрофлоры кожи и слизистых покровов на патогенные микроорганизмы;
• температурную реакцию, при которой прекращается размножение большинства патогенных бактерий. Так, например, устойчивость кур к возбудителю сибирской язвы (В. anthracis) обусловлена тем, что температура их тела находится в пределах 41-42 °С, при которой бактерии не способны к самовоспроизводству;
• клеточные и гуморальные факторы организма.
В случае проникновения патогенов в организм включаются гуморальные факторы защиты, к которым относятся белки системы комплемента, пропердин, лизины, фибронектин, система цитокинов (интерлейкины, интерфероны и др.). Развиваются сосудистые реакции в виде быстрого локального отека в очаге повреждения, что задерживает микроорганизмы и не пропускает их во внутреннюю среду. В крови появляются белки острой фазы — С-реактивный протеин и маннансвязывающий лектин, которые обладают способностью взаимодействовать с бактериями и другими возбудителями. В этом случае усиливается захват патогенов фагоцитирующими клетками.
а) К клеточным факторам неспецифической защиты относятся тучные клетки, лейкоциты, макрофаги, естественные (натуральные) киллерные клетки (NK-клетки; от англ, natural killer).
1. Тучные клетки — это большие тканевые клетки, в которых находятся цитоплазматические гранулы, содержащие гепарин и биологически активные вещества типа гистамина, серотонина. При дегрануляции тучные клетки выделяют особые вещества, являющиеся медиаторами воспалительных процессов (лейкотриены и ряд цитокинов). Медиаторы повышают проницаемость сосудистых стенок, что позволяет комплементу и клеткам выходить в ткани очага поражения. Все это сдерживает проникновение патогенов во внутреннюю среду организма.
2. NK-клетки представляют собой крупные лимфоциты, не имеющие маркеров Т- или В-клеток; они способны спонтанно, без предварительного контакта, убивать опухолевые и инфицированные вирусом клетки. В периферической крови на их долю приходится до 10% от всех мононуклеарных клеток. NK локализованы главным образом в печени, красной пульпе селезенки, слизистых оболочках.
3. Лейкоциты содержат мощные бактерицидные факторы и обеспечивают фагоцитоз микробных клеток. Такие лейкоциты называют фагоцитами (фагоцитирующими клетками). Они представлены моноцитами, полиморфно-ядерными нейтрофилами и макрофагами.
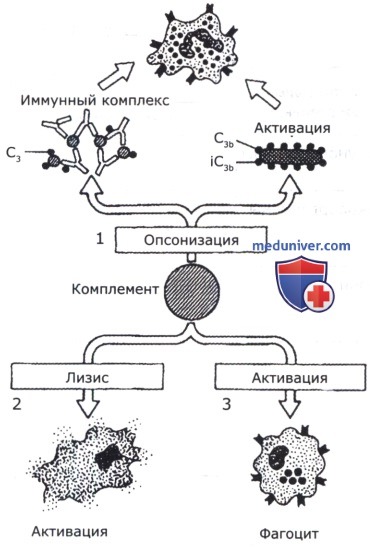
1 — опсонизация («одевание») комплементом микроорганизмов и иммунных комплексов для их распознавания клетками, экспрессирующими рецепторы к комплементу;
2 — лизис клеток-мишеней;
3 — активация фагоцитов, включая макрофаги и нейтрофилы.
б) Фагоцитоз — биологическое явление, основанное на узнавании, захвате, поглощении и переработке чужеродных корпускулярных объектов эукариотической клеткой. Объектами для фагоцитоза являются микроорганизмы, отмирающие собственные клетки организма, синтетические частицы (латекс) и другие корпускуляры. Фагоцитами являются полиморфно-ядерные клетки (нейтрофилы, эозинофилы, базофилы) и мононуклеарные клетки (моноциты крови), а также фиксированные макрофаги — альвеолярные, перитонеальные, купферовские клетки, дендритные клетки селезенки и лимфатических узлов, клетки Лангерганса и др.
Процесс фагоцитоза (от греч. phago — пожираю, cytos — клетки) протекает в несколько стадий:
— приближение фагоцита к чужеродному корпускулярному объекту (положительный хемотаксис);
— адсорбция его на поверхности фагоцита;
— поглощение путем обхвата его наружной мембраной фагоцита, ее инвагинация с последующим образованием фагосомы, которая затем сливается с лизосомой (специфические гранулы, содержащие ферментные бактерицидные системы) и формирует фаголизосому;
— переваривание объекта (клетки) ферментами (лизоцимом и кислыми гидролизами) фаголизосомы.
Результатом является разрушение чужеродных агентов до биологически инертных низкомолекулярных соединений.
Такой фагоцитоз протекает без участия специфических гуморальных факторов защиты, а поэтому получил название доиммунного (первичного) фагоцитоза. Именно этот вариант фагоцитоза впервые описан И. И. Мечниковым (1883) как фактор несиецифической защиты организма.
Результатом фагоцитоза является либо гибель чужеродной клетки (завершенный фагоцитоз), либо выживание и размножение захваченных клеток (незавершенный фагоцитоз). Незавершенный фагоцитоз является одним из механизмов длительной персистенции (переживания) патогенных агентов в макроорганизме и хронизации инфекционных процессов. Такой фагоцитоз чаще протекает в нейтрофилах и завершается их гибелью. Незавершенный фагоцитоз имеет место при туберкулезе, бруцеллезе, гонорее, иерсиниозах и других инфекционных процессах, индуцированных микроорганизмами различных групп — бактериями, вирусами, грибами, простейшими.
Повышение скорости и эффективности фагоцитарной реакции возможно при участии неспецифических и специфических гуморальных белков, которые получили название опсонинов. К ним относят белки системы комплемента С3b и С4b, белки острой фазы, IgG, IgM и др. Опсонины имеют химическое сродство к некоторым компонентам клеточной стенки микроорганизмов, связываются с ними, а затем такие комплексы легко фагоцитируются, потому что фагоциты имеют специальные рецепторы для молекул опсонинов. Кооперация различных опсонинов сыворотки крови и фагоцитов составляет опсонофагоцитарную систему организма. Оценку опсонической активности сыворотки крови проводят путем определения опсонического индекса или опсонофагоцитарного индекса, которые характеризуют влияние опсонинов на поглощение или лизис микроорганизмов фагоцитами. Фагоцитоз, в котором принимают участие специфические (IgG, IgM) белки-опсонины, называют иммунным.
в) Система комплемента (от лат. complementum—дополнение, средство пополнения) представлена группой белков сыворотки крови, которые принимают участие в реакциях неспецифической защиты: лизиса клеток, хемотаксиса, фагоцитоза, активации тучных клеток и др. Белки комплемента являются глобулинами или гликопротеинами. Они вырабатываются макрофагами, лейкоцитами, гепатоцитами и составляют 5-10% всех белков крови.
Система комплемента представлена 20-26 белками сыворотки крови, которые циркулируют в виде отдельных фракций (комплексов), различаются по физикохимическим свойствам и обозначаются символами С1, С2, С3 ... С9 и др. Хорошо изучены свойства и функции основных 9 компонентов комплемента.
В крови все компоненты циркулируют в неактивной форме, в виде коэнзимов. Активация белков комплемента (т. е. сборка фракций в единое целое) осуществляется специфическими иммунными и неспецифическими факторами в процессе многоступенчатых превращений. Они способны образовывать биологически активные соединения (С-реактивный белок и др.), вызывать воспалительные процессы, лизис клеток и, осаждаясь на поверхности клеточных мембран бактерий, стимулировать фагоцитоз.
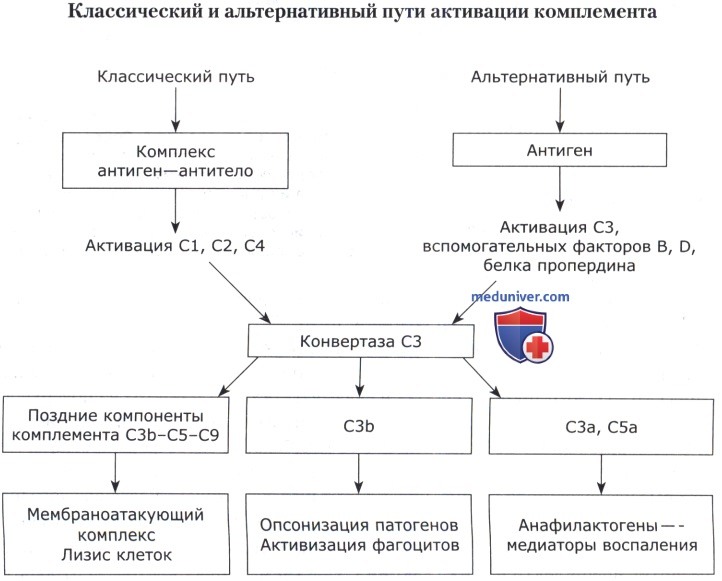
Известно три пути активации системы комплемента: альтернативный, классический и лектиновый.
При альтернативном пути комплемент может активироваться непосредственно клетками микроорганизмов, полисахаридами, липополисахаридами бактерий, вирусами и другими антигенами без участия антител. Инициатором процесса является компонент С3b, который в небольшом количестве всегда присутствует в сыворотке крови. Он связывается с поверхностными молекулами микроорганизмов. При участии ряда ферментов (факторы В и D) и белка пропердина С3b образует СЗ-конвертазу, которая является наиболее значимой протеазой при этом пути активации компонентов комплемента. Одна единица СЗ-конвертазы нарабатывает и фиксирует на поверхности микробной клетки около 1000 молекул С3b, которые выполняют противомикробную работу. Далее этот комплекс активирует компонент С5, который прикрепляется К мембране клетки-мишени. Затем на нем образуется мембраноатакующий комплекс (МАК — membrane-attact complex) из компонентов С6-С9.
Процесс завершается формированием неспадающихся пор, перфорацией мембраны и лизисом микробных клеток. Именно этот путь запуска каскада комплементарных белков имеет место на ранних стадиях инфекционного процесса, когда специфические факторы иммунитета (антитела) еще не работают. Кроме того, компонент С3b, связываясь с поверхностью бактерий, может выполнять роль опсонина, усиливая фагоцитоз.
Классический путь активации комплемента запускается и протекает с участием комплекса антиген—антитело. Молекулы IgM и некоторые фракции IgG в комплексе антиген—антитело имеют специальные места, способные связать компонент С1 комплемента.
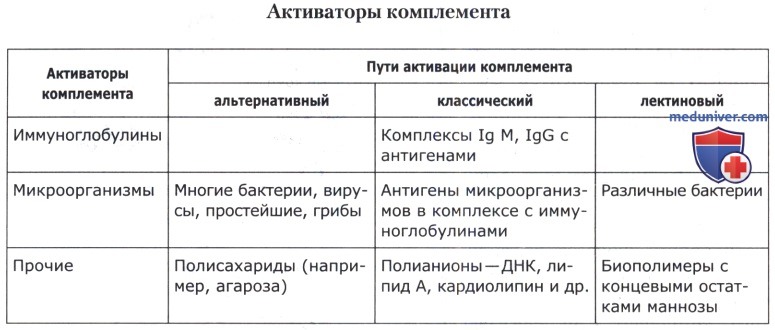
Молекула С1 состоит из 8 субъединиц, одна из которых является активной протеазой. Она участвует в расщеплении компонентов С2 и С4 с образованием С3-конвертазы, которая активирует компонент С5 и обеспечивает формирование мембраноатакующего комплекса, как при альтернативном пути.
Лектиновый путь активации комплемента обусловлен присутствием в крови особого кальцийзависимого сахаросвязывающего протеина—маннансвязывающего лектина (МСЛ). Этот протеин способен связывать остатки маннозы на поверхности микробных клеток, что приводит к активации протеазы, расщепляющей компоненты С2 и С4 с образованием С3-конвертазы. Это запускает процесс формирования мембраноатакующего комплекса, как при классическом пути активации комплемента. Некоторые исследователи рассматривают этот путь как вариант классического пути.
В процессе расщепления компонентов С5 и С3 образуются малые фрагменты С3а и С5а, которые служат медиаторами воспалительной реакции и инициируют развитие анафилактических реакций с участием тучных клеток, нейтрофилов и моноцитов. Эти компоненты получили название анафилатоксинов комплемента.
Активность комплемента и концентрация отдельных его компонентов в организме человека могут увеличиваться или уменьшаться при различных патологических состояниях, возможны и наследственные дефициты. Содержание комплемента в сыворотке животных зависит от их вида, возраста, а также от сезона и даже времени суток.
Наиболее высокий и стабильный уровень комплемента отмечен у морских свинок, поэтому в качестве комплемента используют нативную или лиофизированную сыворотку крови этих животных. Белки системы комплемента очень лабильны. Они быстро разрушаются при хранении при комнатной температуре, действии света, ультрафиолетовых лучей, протеаз, растворов кислот или щелочей, удалении ионов Са++ и Mg++. Прогревание сыворотки при 56 °С в течение 30 мин приводит к разрушению комплемента; такая сыворотка называется инактивированной.
Количественное содержание компонентов комплемента в периферической крови определяют как один из показателей активности гуморального иммунитета. У здоровых лиц содержание компонента С1 составляет 180 мкг/мл, С2 — 20 мкг/мл, С4 — 600 мкг/мл, С3 — 1200 мкг/мл.
г) Воспаление как важнейшее проявление иммунитета. Воспалительная реакция развивается в ответ на повреждение тканей (прежде всего покровных) и направлена на локализацию и уничтожение микроорганизмов, которые проникли в организм при его повреждении. В основе воспалительной реакции лежит комплекс гуморальных и клеточных факторов неспецифической резистентности.
Клинически воспаление проявляется покраснением, отеком, болью, локальным повышением температуры, нарушением функции поврежденного органа или ткани.
Центральную роль в развитии воспаления играют сосудистые реакции и клетки системы мононуклеарных фагоцитов: нейтрофилы, моноциты, базофилы, эозинофилы, макрофаги и тучные клетки. При повреждении клеток и тканей, кроме того, высвобождаются различные медиаторы — гистамин, серотонин, простагландины и лейкотриены, кинины, белки острой фазы, в том числе С-реактивный белок, и другие, которые играют важную роль в развитии воспалительных реакций.
Бактерии, проникшие в организм при его повреждении, и продукты их жизнедеятельности активируют свертывающую систему крови, систему комплемента и клетки макрофагально-мононуклеарной системы. Происходит образование сгустков крови, что предупреждает распространение возбудителей с кровью и лимфой и препятствует генерализации процесса. При активации системы комплемента образуется мембраноатакующий комплекс (МАК), который лизирует или опсонизирует микроорганизмы. Последнее усиливает способность фагоцитирующих клеток поглощать и переваривать микроорганизмы.
Характер течения и исход воспалительного процесса зависят от многих факторов: природы и интенсивности действия чужеродного агента, формы воспалительного процесса (альтеративное, экссудативное, пролиферативное воспаление), локализации, состояния иммунной системы и др. Если воспаление не завершается в течение нескольких дней, оно становится хроническим, и тогда развиваются иммунные реакции (иммунное воспаление) с участием макрофагов, В- и Т-лимфоцитов.
- Читать далее "Классификация антигенов"
Редактор: Искандер Милевски. Дата публикации: 14.08.2019
- Факторы неспецифической резистентности (защиты) организма
- Классификация антигенов
- Органы иммунной системы
- Виды иммунитета и формы иммунного ответа
- Гуморальный иммунный ответ
- Клеточный иммунный ответ
- Иммунологическая толерантность
- Типы реакций гиперчувствительности
- Иммунограмма в норме. Основные параметры иммунного статуса человека и методы его оценки
- Техника подсчета основных популяций лимфоцитов методом иммунофлюоресценции
