Экология как причина репродуктивных нарушений
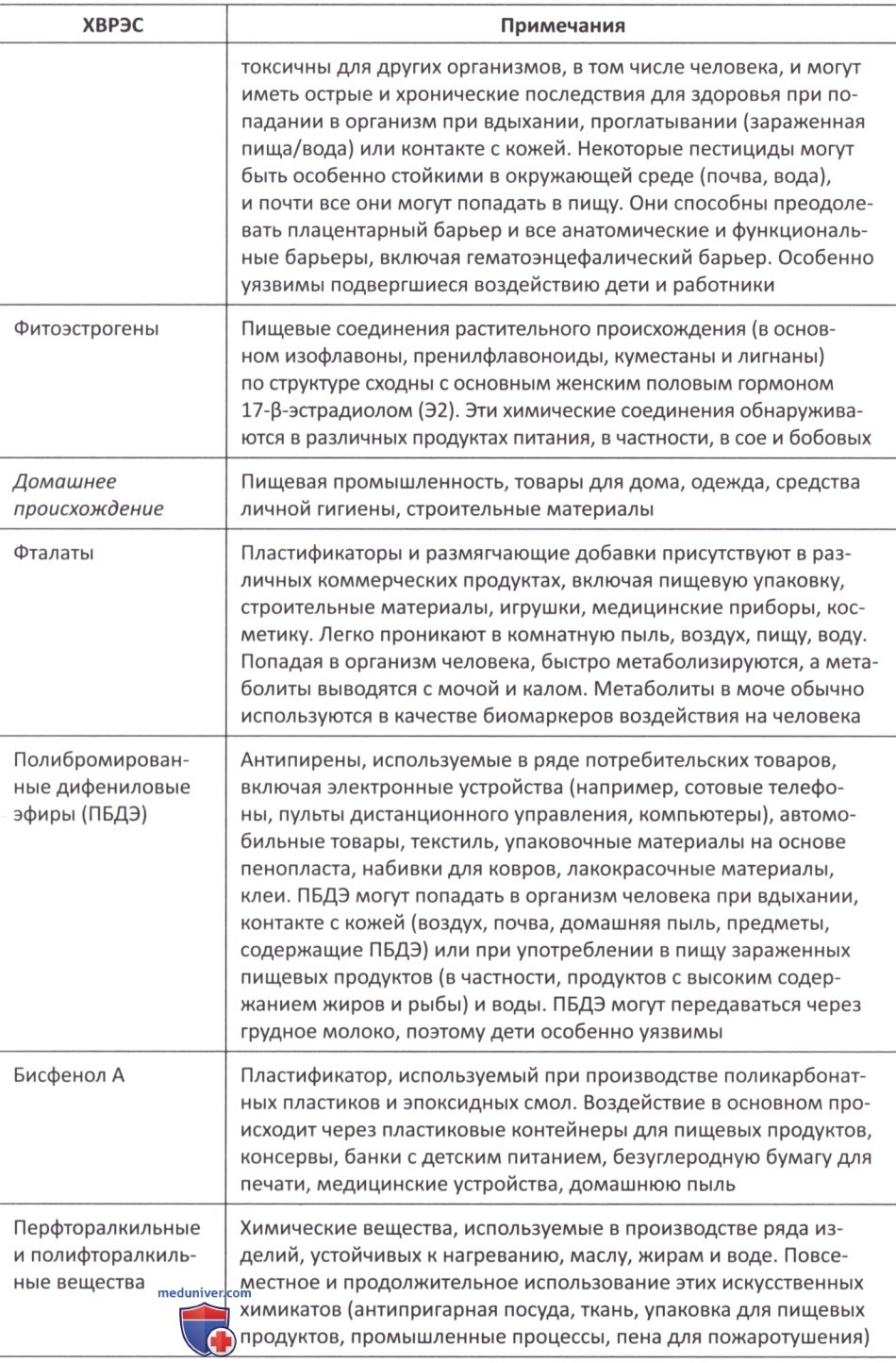
Большое число экспериментальных исследований на животных и людях указывает на взаимосвязь между воздействием ХВРЭС (в основном пестицидов, гербицидов, ВРА, фталатов, тяжелых металлов, диоксинов, ПХБ, полибромированных бифенилов) и возможными неблагоприятными последствиями для репродуктивных функций как у мужчин, так и у женщин. Эффект обусловлен эстрогенными, антиэстрогенными или антиандрогенными эффектами ХВРЭС, а также эпигенетическими механизмами, модулирующими индивидуальную восприимчивость к возникновению заболевания и отложенными эффектами внутриутробного и/или перинатального воздействия с возможностью проявления эффектов у следующего поколения.
Растущее число данных также указывает на то, что вещества, загрязняющие воздух (например, газообразные загрязнители, твердые частицы, полициклические ароматические углеводороды, тяжелые металлы), способны влиять на гаметогенез и ухудшать репродуктивную функцию у подвергшихся воздействию групп населения, в основном вызывая эндокринные нарушения (эстроегноподобное, антиэстрогенное и антиандрогенное действие), а также в результате повышения окислительного стресса.
Результаты исследований на животных показывают, что раннее воздействие ХВРЭС у самок может вызывать негативные эффекты на развивающиеся яичники, что опосредовано эпигенетическими механизмами (например, измененное метилирование ДНК), а также действуя на примордиальные зародышевые клетки, дифференцировку гонад, фолликулогенез и овуляцию. (Zama и Uzumcu, 2010).
Несколько эпидемиологических исследований выявили устойчивую взаимосвязь между хлорорганическими пестицидами (профессиональное воздействие или потребление с пищей) и снижением женской фертильности.
Хлорорганический пестицид метоксихлор, в частности, обладает эстрогеноподобными свойствами, и, как показали исследования на животных, влияние его метаболитов в раннем возрасте может оказывать эстрогеноподобное, антиэстрогенное или антиандрогенное действие, клинические исходы которого проявляются во взрослом возрасте (Zama и Uzumcu, 2010).
Исследование на беременных мышах показало отрицательное влияние на организм гербицида глифосата, включая развитие недостаточности функции яичников, изменение экспрессии генов, связанных со стероидогенезом и последующей секреции гормонов, а также окислительный стресс (Ren и соавт., 2018). У крыс введение глифосата в постнатальном периоде вызывает эндокринные нарушения в грудных железах мужских особей (изменение развития) (Altamirano и соавт., 2018), а у крупного рогатого скота может вызывать нарушение репродуктивной функции вследствие изменения стероидогенеза и пролиферации клеток гранулезы (Perego и соавт., 2017).
Следует отметить, что недавнее исследование на животных показало, что изменения, вызванные глифосатом, могут присутствовать в будущих поколениях (F2-F3) после воздействия на мать и в отсутствие прямого воздействия на потомство (F3). Фактически временное воздействие на беременных самок крыс (с 8-го по 14-й день беременности) низкой дозой глифосата (половина предельно допустимой концентрации) способствовало развитию заболевания яичников (поликистоз яичников с незначительным количеством гранулезных клеток) в F2 (внучатое потомство) и у самок поколения F3 (праправнуки) по сравнению с контрольной линией. Задержка начала полового созревания была также замечена у самцов в линии воздействия глифосатом в поколениях F1 и F2.
У самцов животных в поколении F2 при воздействии глифосата также были зарегистрированы серьезные изменения яичек (например, азооспермия, атрезия семенных канальцев, наличие вакуолей в базальных областях семенных канальцев, отторжение половых клеток в просвете канальцев и отсутствие просвета канальцев), а у самцов линии глифосата поколения F3 выявлялось изменение гистологической картины предстательной железы (атрофия или гиперплазия железистого эпителия, наличие вакуольных пространств в эпителии) с трехкратным увеличением заболеваемости по сравнению с контрольной группой.
Согласно результатам экспериментов, эти изменения в основном происходят из-за нарушения метилирования ДНК зародышевой линии, эпигенетического изменения (эпимутации) с передачей из поколения в поколение, присутствующего в сперматозоидах поколений F1, F2 и F3 (Kubsad и соавт., 2019).
Негативное воздействие БФА на женскую репродуктивную функцию особенно критично в перинатальном периоде. У животных, даже после воздействия низких доз, БФА может нарушить морфологию яичников и способствовать изменению времени полового созревания, оогенеза, полового цикла и уровня Л Г, кистозной гиперплазии эндометрия, развитию аденомиоза матки, лейомиом, атипичной гиперплазии и стромальных полипов, параовариальных кист, пролиферативных поражений маточных труб и развитию синдрома сохранения ткани мезонефрального протока (Zama и Uzumcu, 2010).
Эпидемиологические исследования у людей показали, что у женщин, страдающих бесплодием, уровень БФА в сыворотке крови может быть выше, чем у фертильных женщин. У женщин, которым была проведена процедура экстракорпорального оплодотворения, была выявлена обратная связь между уровнями БФА и пиковыми уровнями эстрадиола, количеством извлеченных ооцитов, созреванием ооцитов, скоростью оплодотворения и качеством эмбриона, что приводит к снижению успешности лечения. Повышенный уровень БФА в моче также был связан с нарушением имплантации бластоцисты в стенку матки, с изменениями объема яичников и количества зрелых фолликулов, а также с изменением уровней гонадотропных гормонов (Ziv-Gal и Flaws, 2016).
Воздействие БФА также играет важную роль в возникновении СПКЯ, поскольку у пациенток с СПКЯ наблюдаются более высокие уровни БФА по сравнению с контрольной группой, что связано с наличием инсулинорезистентности и гиперандрогении (Ни и соавт., 2018).
Новые данные указывают, что бисфенол S, широко используемый в качестве заменителя БФА, также оказывает неблагоприятное воздействие на репродуктивную функцию у женщин. Эти негативные влияния после длительного воздействия очень низких доз бисфенола S затрагивают фолликулогенез и качество ооцитов (Nevoral и соавт., 2018).
ПХБ (при приеме внутрь или вдыхании) может оказывать выраженное влияние на репродуктивную функцию женщины, изменяя овариальный цикл и потенциально нарушая фертильность. При исследовании группы женщин (21—38 лет) с нормальным менструальным циклом было показано, что повышенные уровни ПХБ, обладающих эстрогеноподобным действием, связаны с высоким риском увеличения соотношения ФСГ: Л Г, которое является маркером пониженной чувствительности яичников (Gallo и соавт., 2018).
Воздействие химических веществ, разрушающих эндокринную систему (ХВРЭС) также может приводить к развитию эндометриоза, причем значительное увеличение риска связано с воздействием ПХБ, хлорорганических пестицидов, эфиров фталевой кислоты (в частности, ДЭГФ) или перфтороктаноата.
У мужчин воздействие ХВРЭС (в основном фталатов, пестицидов, гербицидов, ПБДЭ, ПХБ) было связано с низким уровнем тестостерона в сыворотке крови и антиандрогенными эффектами, что клинически проявлялось крипторхизмом, гипотрофией/дисгенезией яичек и изменением сперматогенеза.
БФА, алкилфенолы, хлорорганические пестициды и ПХБ могут оказывать агонистическое действие на рецепторы эстрогена, а также изменять экспрессию чувствительных к эстрогену генов.
Пестициды метоксихлор, дихлордифенилтрихлорэтан, фунгициды и БФА, являясь антагонистами андрогенных рецепторов, могут проявлять антиандрогенную активность, что приводит к подавлению синтеза стероидов, нарушению сигнальных путей, связывающих гормоны с андроген-чувствительными тканями, и изменению экспрессии андроген-чувствительных генов.
Низкие концентрации БФА, ПХБ, фталатов (в частности, ДЭГФ) и метоксихлора также способны изменять работу путей, регулирующих биосинтез стероидных гормонов.
У крыс при пероральном приеме гербицида глифосата изменились уровни репродуктивных гормонов, развился окислительный стресс, значительно снизилось количество и подвижность сперматозоидов, а также увеличилось количество аномальных сперматозоидов. Эти изменения сопровождались тяжелыми гистологическими изменениями яичек (Owagboriaye и соавт., 2017).
Наконец, воздействие ряда факторов, загрязняющих окружающую среду (включая электромагнитные поля), способствует развитию окислительного стресса за счет генерации АФК, оказывая повреждающее воздействие на ткани, а также на количество, морфологию и активность сперматозоидов (Сидоркевич и соавт., 2017).
Следует отметить, что время воздействия является критическим фактором, поскольку воздействие может начаться уже внутриутробно и приводить к развитию выраженных и долгосрочных эффектов.



- Читать "Экология как причина гормонально-зависимых опухолей"
Редактор: Искандер Милевски. Дата публикации: 19.3.2023
- Химические вещества, разрушающие эндокринную систему (ХВРЭС)
- Экология как причина инсулинорезистентности, ожирения, сахарного диабета 2-го типа
- Экология как причина сахарного диабета 1-го типа
- Экология как причина заболеваний щитовидной железы
- Экология как причина репродуктивных нарушений
- Экология как причина гормонально-зависимых опухолей
- Эндокринные эффекты радиочастотных электромагнитных полей
