Влияние половых гормонов на развитие сердечно-сосудистых заболеваний
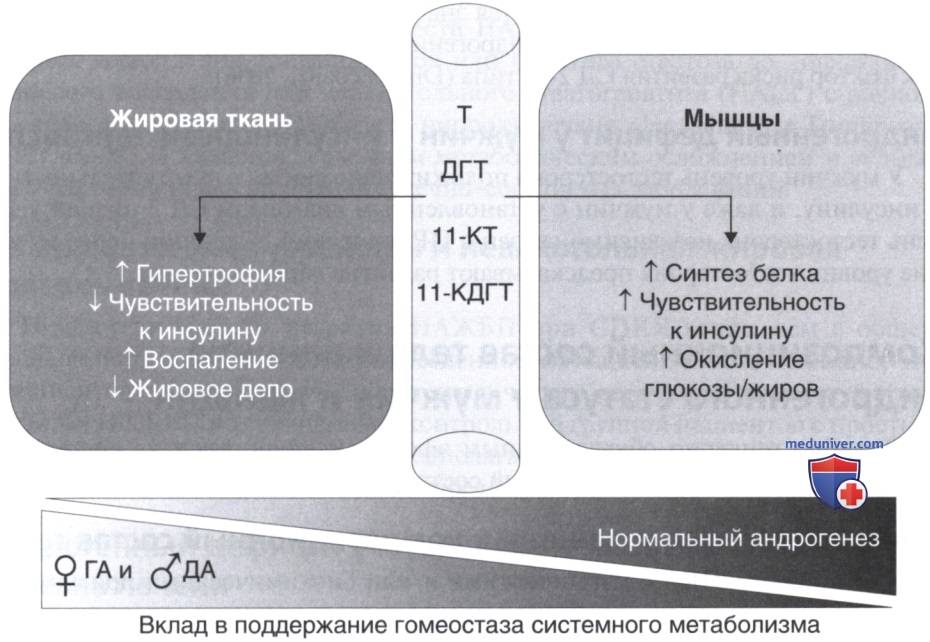
Андрогены играют важную роль в обмене веществ как в норме, так и при патологии. При гиперандрогении (ГА) у женщин и дефиците андрогенов (ДА) у мужчин выявляется сходный метаболический фенотип, что подчеркивает многообразие роли андрогенов в обмене веществ. Степень воздействия андрогенов на жировую и мышечную ткань у представителей обоих полов в значительной степени регулируется их концентрацией в сыворотке крови и тканях с узким физиологическим окном, за пределами которого наблюдаются нарушения метаболизма и композиционного состава тела.
У здоровых женщин низкие концентрации андрогенов при повышении уровня эстрогенов приводят к преобладанию распределения жировых запасов по женскому типу и снижению метаболического риска; при уровнях циркулирующих андрогенов, наблюдаемых при тяжелой ГА у женщин и ДА у мужчин, наблюдается центральное, или висцеральное, ожирение, тогда как при более высоких концентрациях андрогенов, наблюдаемых у здоровых мужчин, этот эффект рассеивается за счет увеличения безжировой мышечной массы тела и уменьшения жировой массы.
а) Избыток андрогенов у женщин и связанные с ним метаболические нарушения. Нарушения метаболизма андрогенов, вызванные заболеваниями половых желез, надпочечников или гипофиза, приводят к изменениям концентрации циркулирующих андрогенов и развитию осложнений со стороны репродуктивной системы и обмена веществ. У женщин синдром поликистозных яичников (СПКЯ), проявляющийся триадой, состоящей из нарушения овуляции, поликистозной морфологии яичников и ГА, является наиболее частым эндокринным заболеванием. У мужчин нарушения функции половых желез чаще всего приводят к гипогонадизму и, как следствие, к ДА, в основе которого могут лежать как наследственные причины, так и приобретенные, в результате некоторых заболеваний или состояний, таких как ожирения, приема лекарств или процесса старения.
Интересно, что ГА у женщин и ДА у мужчин связаны со сходным неблагоприятным метаболическим фенотипом, включающим ожирение, ИР, увеличение частоты развития СД 2-го типа, НАЖБП и сердечно-сосудистые заболевания (Зароцкий и соавт., 2014).
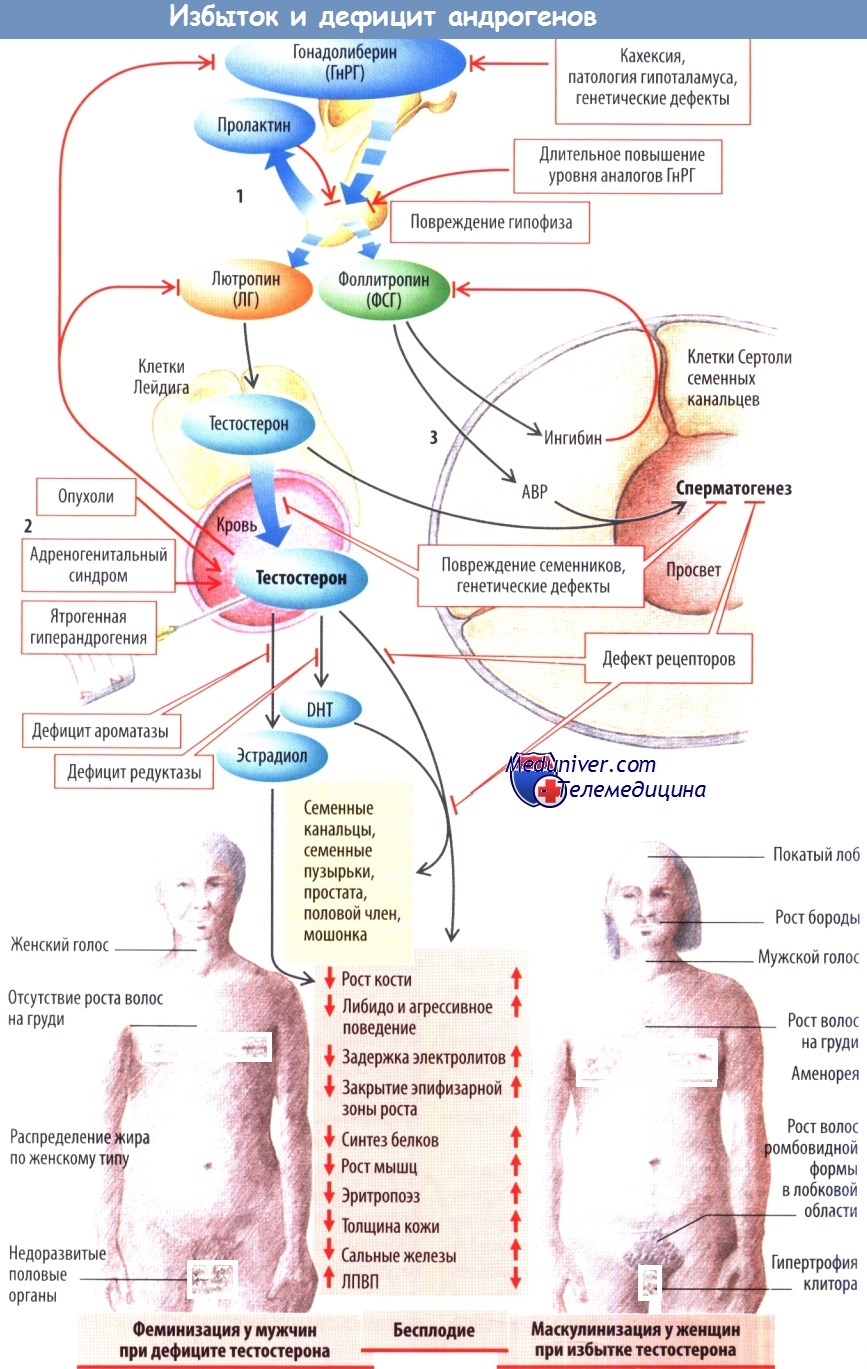
1. Синдром поликистозных яичников (СПКЯ). СПКЯ — наиболее частая причина ГА у женщин, им страдают 5—10% женщин репродуктивного возраста. Согласно Роттердамским критериям 2003 г., СПКЯ диагностируется при наличии двух из следующих трех признаков: ультразвуковых признаков поликистозного строения яичников (ПКЯ), ановуляции и ГА. При СПКЯ также развивается нарушение обмена веществ, связанное с развитием ИР, висцерального отложения жира и ожирения, дислипидемии, НАЖБП и сердечно-сосудистых заболеваний. На фоне ГА развиваются связанные с СПКЯ метаболические нарушения.
Обычно количество циркулирующих андрогенов оценивается путем измерения уровня тестостерона сыворотки крови (Т), однако по данным недавно проведенного исследования было показано, что андростендион (А4) является более чувствительным маркером для выявления ГА, ассоциированной с СПКЯ, а комплексная оценка А4 и Т позволяет спрогнозировать неблагоприятный метаболический риск (O’Reilly и соавт., 2014).
2. Женщины с моногенными причинами гиперандрогении. Врожденная дисфункция коры надпочечников (ВДКН) представляет собой группу заболеваний с аутосомно-рецессивным типом наследования, характеризующихся дефицитом глюкокортикоидов (ГКС) и различными вариантами нарушения секреции минералокортикоидов и андрогенов. Среди больных женщин выявлено три варианта ВДКН с гиперандрогенией: дефицит 21-гидроксилазы, дефицит 11 |3-гидроксилазы и дефицит 3β-гидроксистероиддегидрогеназы 2-го типа. Наиболее распространенным из этих дефектов является дефицит 21-гидроксилазы, который приводит к развитию неклассической формы ВДКН с умеренным дефицитом ГКС и ГА (Speiser и White, 2003).
Вследствие ферментативного блока стероиды-предшественники сбрасываются на пути биосинтеза андрогенов, который еще больше стимулируется за счет усиления гипоталамо-гипофизарно-надпочечникового возбуждения из-за потери кортизола, играющего роль в функционировании отрицательной обратной связи. В то время как у пациентов с крупными мутациями с потерей функции заболевание обычно диагностируется сразу после рождения или в раннем детстве, у пациентов с малыми мутациями заболевание диагностируется гораздо позднее, поскольку в этом случае секреция ГКС и минералокортикоидов в достаточной мере поддерживается за счет непрерывного усиления стимуляции надпочечников адренокортикотропным гормоном (АКТГ) за счет гиперандрогении.
У этих пациентов не отмечается явная вирилизация, но обычно наблюдается фенотип СПКЯ в подростковом или молодом возрасте, включая гирсутизм, нерегулярные менструации и картину поликистозных яичников. Сообщалось об увеличении распространенности ожирения и инсулинорезистентности у пациентов с неклассической ВДКН, что отражает неблагоприятный метаболический фенотип, обнаруживаемый при СПКЯ. Поскольку СПКЯ является диагнозом исключения и в среднем у 2—3% женщин с фенотипом СПКЯ выявляется неклассическая форма ВДКН, при обследовании рекомендуется скрининг на наличие ВДКН по исходному уровню 17-гидрокси-прогестерона сыворотки.
3. Женщины с моногенными причинами инсулинорезистентности. Тяжелая ИР может развиться независимо от ожирения как следствие изолированных дефектов генов, влияющих на сигнальные пути инсулина или развитие жировой ткани. Дефекты сигнальных путей инсулина могут быть обнаружены на уровне рецептора инсулина или в пострецепторной передаче сигнала. Монотонные расстройства также могут вызывать тяжелое ожирение и последующее развитие ИР или дисфункциональное развитие жировой ткани, что приводит к врожденной полной или частичной липодистрофии (Semple и соавт., 2011).
У пациентов с ИР из-за монотонной липодистрофии или мутаций рецептора инсулина также отмечается ГА, нарушение овуляции, поликистозные яичники и черный акантоз, обычно при отсутствии ожирения. Компенсирующая гиперинсулинемия может стимулировать биосинтез андрогенов в яичниках за счет прямого воздействия инсулина на теку и стромальные клетки, хотя нельзя сбрасывать со счетов другие периферические источники инсулин-стимулированного синтеза андрогенов.
б) Дефицит андрогенов у мужчин и связанные с ним метаболические последствия. ДА у мужчин — это клинический синдром, возникающий из-за недостаточности выработки тестостерона яичками вследствие первичного поражения половых желез или заболевания органов гипоталамо-гипофизарной системы. У взрослых мужчин он диагностируется по наличию физических симптомов ДА с биохимическими признаками низкого уровня циркулирующего Т. Общие симптомы — снижение либидо и эректильная дисфункция, утомляемость, снижение физической силы и выносливости, а также в некоторых случаях нарушение когнитивных функций и расстройства настроения (Boehm и соавт., 2015).
1. Первичный гипогонадизм у мужчин. Первичный мужской гипогонадизм определяется низким уровнем сывороточного тестостерона в сочетании с повышенным уровнем лютеинизирующего гормона (ЛГ). Нормальный уровень тестостерона и высокий уровень ЛГ характерны для компенсированного гипогонадизма, представляющего собой нарушение функции яичек, которое восстанавливается за счет усиленной стимуляции ЛГ. Компенсированный гипогонадизм не имеет клинических проявлений, но с более высокой вероятностью прогрессирует до явного ДА по сравнению с эугонадальным состоянием. Врожденный первичный гипогонадизм может быть вызван дисгенезией гонад и крипторхизмом, а также анеуплоидией аутосомных или половых хромосом, как при синдроме Клайнфельтера.
2. Вторичный гипогонадизм у мужчин. Вторичный гипогонадизм, или гипогонадотропный гипогонадизм, характеризуется низким уровнем тестостерона из-за снижения секреции гонадотропина и, как следствие, нарушения гипоталамо-гипофизарной стимуляции синтеза андрогенов в яичках. Подавляющее большинство таких случаев вызвано опухолями гипоталамо-гипофизарной области. Врожденный гипогонадотропный гипогонадизм может наблюдаться при множественном дефиците гормонов гипофиза при таких состояниях, как септооптическая дисплазия, но чаще он связан с изолированным дефицитом гонадотропина, например, при синдроме Каллмана, который может также проявляться аносмией и аномалиями черепно-лицевой зоны.
3. Приобретенный гипогонадизм у мужчин. Приобретенный гипогонадизм может быть вызван поражениями или опухолями центральной нервной системы или яичек, радио- и химиотерапией, медикаментозным лечением, хроническими заболеваниями, рядом соматических заболеваний, в том числе ожирением. Хирургическая, или медикаментозная, андроген-депривационная терапия является признанным вариантом лечения как метастатического рака простаты без предшествующей гормональной терапии, так и кастрационно-резистентного рака простаты.
Старение влияет на систему гипоталамус—гипофиз—гонады и может привести к ДА с поздним началом, который определяется низким уровенем тестостерона при условии исключения классических причин ДА. Старение также может привести к постепенному развитию тестикулярной недостаточности из-за снижения количества клеток Лейдига и их ответа на стимуляцию ЛГ, а также снижения активности гипоталамо-гипофизарной системы.
ДА у мужчин также может быть вызван ожирением (Kelly and Jones, 2015). Ожирение значительно увеличивает скорость снижения уровня тестостерона с возрастом, что связано с нарушением высвобождения гонадотропинов. При этом потеря веса может привести к восстановлению эугонадного состояния мужчины. Предположительным механизмом этой взаимосвязи является система гипогонадизм-ожирение-адипокины. Было высказано предположение, что ожирение приводит к увеличению превращения андрогенов в эстрогены посредством ароматазной активности в жировой ткани, что снижает уровень активных андрогенов. Эстрогены также могут подавлять систему гипоталамус-гипофиз-гонады, что снижает синтез Т в половых железах.
в) Влияние андрогенов на ткани-мишени. Помимо центральной роли в развитии и поддержании репродуктивной функции и полового влечения у мужчин и женщин, андрогены оказывают ключевое влияние на ткани-мишени. К ним относятся жировая ткань и скелетные мышцы, которые имеют важное значение для поддержания системного гомеостаза глюкозы и липидов.
1. Андрогены, жировая ткань и обмен липидов. Модели распределения жировой ткани демонстрируют явный половой диморфизм: для женщин характерен более высокий процент жировой ткани, чем у мужчин, при меньшем общем количестве мышечной массы. Типичным для женщин является распределение жира по женскому типу с меньшим количеством висцерального, но большим количеством подкожного жира; для мужчин характерно распределение по мужскому типу с преобладанием висцерального жира над подкожным.
Увеличение количества жировой ткани является следствием как ее гиперплазии (адипогенеза), которая обусловлена пролиферацией преадипоцитов и их дифференцировкой в адипоциты, так и гипертрофии, которая вызвана накоплением липидов в дифференцированных адипоцитах; оба процесса являются основными детерминантами метаболических нарушений (Demerath и соавт., 2007).
Андрогены нарушают адипогенез, подавляя пролиферацию и дифференцировку мезенхимальных стволовых клеток и преадипоцитов. Так, дигидротестостерон и Т оказывают ингибирующее действие на детерминацию мультипотентных стволовых клеток по линии преадипоцитарного ростка, а также на дифференцировку адипоцитов у обоих полов. Кроме того, дегидроэпиандростерон (ДГЭА) подавляет пролиферацию и дифференцировку клеточной линии подкожных преадипоцитов и увеличивает базальный уровень поглощения глюкозы.
ДГЭА-сульфат такими свойствами не обладает. Нарушение пролиферации и дифференцировки адипоцитов приводит к компенсаторной гипертрофии адипоцитов и увеличению массы жировой ткани и реализуется в развитии инсулинорезистентности, внутриклеточного стресса и воспаления, что, в свою очередь, вызывает провоспалительный, диабетогенный и атерогенный эффекты. Андрогены также оказывают прямое и косвенное влияние на чувствительность жировой ткани к инсулину.
Характерные эффекты андрогенов на жировую ткань и скелетные мышцы и их влияние на метаболизм в целом можно резюмировать следующим образом: андрогены могут оказывать пролипогенное действие на жировую ткань, приводя к увеличению жировой массы; в более высоких концентрациях, наблюдаемых у здоровых мужчин, преобладает чистый анаболический эффект андрогенов на скелетные мышцы, приводящий к увеличению их массы. Однако, когда уровни циркулирующих андрогенов находятся в диапазоне их избытка у женщин и дефицита андрогенов у мужчин, потеря мышечной массы и увеличение абдоминального жира приводят к системным клиническим проявлениям и вызывают метаболические и сердечно-сосудистые заболевания (рис. ниже).
г) Инсулинорезистентность, сахарный диабет 2-го типа и андрогенный статус у мужчин и женщин. ИР — это нарушение системного метаболического ответа на действие инсулина, которое включает в себя поглощение и метаболизм глюкозы, подавление липолиза и стимулирование липогенеза, а также синтез белка и гликогена. ИР сопровождается компенсаторной гиперинсулинемией, приводящей к усилению ответа на инсулин в обычно менее чувствительных тканях, а также к нарушениям метаболизма липидов в печени и жировой ткани. Явная гипергликемия возникает после декомпенсации усиленного ответа β-клеток поджелудочной железы на системную ИР.
1. Гиперандрогения у женщин и инсулинорезистентность. Наличие гиперандрогении при СПКЯ тесно коррелирует с ИР. У женщин с СПКЯ наблюдается тенденция к развитию нарушения толерантности к глюкозе и СД 2-го типа, причем риск значительно увеличивается при наличии ожирения. У женщин с СПКЯ и андрогенией высокая частота развития нарушения толерантности к глюкозе и СД 2-го типа наблюдается как при наличии ожирения, так и без него, однако ожирение усугубляет течение заболевания. Напротив, у женщин с СД 2-го типа наблюдается значительно более высокий уровень тестостерона; следовательно, гиперандрогению у женщин можно рассматривать как фактор риска развития СД 2-го типа (Ding и соавт., 2006).
2. Андрогенный дефицит у мужчин и инсулинорезистентность. У мужчин уровень тестостерона положительно связан с чувствительностью к инсулину, и даже у мужчин с установленным диагнозом СД 2 низкий уровень тестостерона независимо связан с ИР; напротив, у женщин более высокие уровни тестостерона предсказывают развитие гипергликемии.
д) Композиционный состав тела и влияние андрогенного статуса у мужчин и женщин. Подобно гендерно обусловленным эффектам андрогенов на системную ИР, их влияние на композиционный состав тела также зависит от пола.
1. Гиперандрогения у женщин и композиционный состав тела. У женщин с СПКЯ с клиническими и/или биохимическими признаками гиперандрогении отмечается более высокая частота развития ожирения и увеличение общей массы жировых отложений, чем в общей популяции женщин. Кроме того, в исследованиях женщин с СПКЯ и гиперандрогенией описано увеличение мышечной массы, коррелирующее с уровнями Т и А4 в сыворотке крови, а также отклонение в сторону увеличения случаев ожирения по мужскому типу (Kirchengast и Huber, 2001).
2. Андрогенный дефицит у мужчин и композиционный состав тела. В отличие от женщин, количество циркулирующих андрогенов у мужчин обратно пропорционально индексу массы тела (ИМТ) и висцеральному отложению жира. По данным большого количества литературы, существует связь между низким уровнем тестостерона и повышенным количеством массы жировой ткани по сравнению с контрольной группой пациентов с нормальным уровнем половых гормонов. У мужчин имеется обратная зависимость между ИМТ и уровнями общего и свободного Т, а также между окружностью талии и уровнем общего Т. Несмотря на то, что возраст связан со снижением уровня андрогенов, обратная зависимость между Т и общей массой жировой ткани в организме, процентным содержанием жира в организме, окружностью талии и количеством висцеральной жировой ткани сохраняется и после поправки на возраст (Blouin и соавт., 2005).
е) Неалкогольная жировая болезнь печени и андрогенный статус у мужчин и женщин. Под термином НАЖБП подразумевается спектр повреждений печени, вызванных ожирением и ИР при отсутствии факта значительного употребления алкоголя в анамнезе. Степень тяжести НАЖБП варьируется от внутрипеченочного накопления триглицеридов или простого стеатоза до диффузного тканевого воспаления или неалкогольного стеатогепатита (НАСГ) с риском развития выраженного фиброза и цирроза печени (Hazlehurst и Tomlinson, 2013). НАЖБП является серьезным метаболическим осложнением и серьезным фактором риска развития сердечно-сосудистых заболеваний.
1. Гиперандрогения у женщин и неалкогольная жировая болезнь печени. Показатели частоты развития НАЖБП при СПКЯ выше, чем в общей женской популяции; в недавно проведенном метаанализе было показано, что у пациентов с СПКЯ отмечается почти в четыре раза более высокая частота развития НАЖБП по сравнению с контрольной группой пациентов с простым ожирением, несмотря на то, что предполагаемый механизм, лежащий в основе связанной с СПКЯ НАЖБП, еще предстоит выяснить.
2. Андрогенный дефицит у мужчин и неалкогольная жировая болезнь печени. Роль тестостерона в патогенезе НАЖБП изучалась в нескольких исследованиях, в которых сообщалось об обратной связи между уровнем сывороточного Т и НАЖБП. Первоначально механизмом, предположительно лежащим в основе этой связи, было избыточное висцеральное отложение жира в контексте гипогонадизма, но недавние исследования показали прямое действие андрогенов на метаболизм печени, приводящее к увеличению количества малонил-КоА, субстрата для липогенеза de novo (Schwingel и соавт., 2011). Более того, использование синтетических анаболических стероидов также связано с развитием стеатоза у мужчин.
ж) Сердечно-сосудистый риск и андрогенный статус у мужчин и женщин:
1. Гиперандрогения у женщин и сердечно-сосудистый риск. В некоторых исследованиях было продемонстрировано, что гиперандрогения при СПКЯ связана с более высоким уровнем общего холестерина и более низким уровнем липопротеинов высокой плотности (ЛПВП), без влияния на уровни триглицеридов и ЛПНП, а также с более высокими значениями маркеров системного воспаления, окислительного стресса и нарушений коагуляции. Все это способствует увеличению риска сердечно-сосудистых заболеваний. У женщин с СПКЯ и гиперандрогенией также наблюдается развитие дисфункции микрососудистого русла из-за нарушения вазодилатации.
Данные о долгосрочных сердечно-сосудистых событиях при СПКЯ противоречивы: некоторые исследователи пришли к выводу об отсутствии повышенного риска заболевания крупных сосудов, атеросклероза брюшного отдела аорты, инфаркта миокарда или инсульта, в то время как другие описывают увеличение частоты развития инфаркта миокарда и стенокардии, а также риска коронарной болезни сердца и инсульта.
2. Дефицит андрогенов у мужчин и сердечно-сосудистый риск. У мужчин низкий уровень тестостерона ассоциирован с проатерогенным липидным профилем, тогда как между тестостероном и триглицеридами, общим холестерином и ЛПНП была описана обратная зависимость (Wu и von Eckardstein, 2003). С другой стороны, у мужчин с заболеванием коронарных артерий определяется более низкий уровень тестостерона, и его тяжесть имеет отрицательную связь с уровнем тестостерона. Дефицит андрогенов у мужчин связан с более высоким риском смерти от всех причин, также существует обратная связь между уровнями тестостерона и предполагаемой смертностью от всех причин, сердечно-сосудистых заболеваний и злокачественных новообразований.
Видео андрогены в норме и при патологии у женщин, мужчин
- Читать "Влияние гормонов щитовидной железы на развитие сердечно-сосудистых заболеваний"
Редактор: Искандер Милевски. Дата публикации: 20.12.2023
- Влияние нарушения обмена глюкозы на факторы риска сердечно-сосудистых заболеваний
- Влияние пролактина на факторы риска сердечно-сосудистых заболеваний
- Влияние половых гормонов на развитие сердечно-сосудистых заболеваний
- Влияние гормонов щитовидной железы на развитие сердечно-сосудистых заболеваний
- Влияние горма роста (соматотропина) на развитие сердечно-сосудистых заболеваний
