Принципы профилактики и лечения дисбактериоза кишечника
Оппортунистические инфекции, как эндогенного, так и экзогенного (внутрибольничного) происхождения, часто возникают у пациентов со сниженной резистентностью макроорганизма. Как известно, нормальная микрофлора открытых полостей организма хозяина формирует на поверхности его слизистых оболочек своеобразные биопленки, состоящие из белкового и/или экзополисахаридного матрикса, в который заключены микроколонии индигенной микрофлоры.
Больные поступают в различные стационары, как правило, с микроэкологическими и иммунными нарушениями. Под действием различных стрессорных факторов, включая назначение этиотропных, цитостатических, гормональных препаратов, применения радиотерапии, возможна замена биопленок индигенной микрофлоры организма хозяина на биопленки, состоящие из ассоциаций различных условно-патогенных микроорганизмов. Следствием такой трансформации является формирование локального инфекционного процесса эндогенного или экзогенного происхождения, который впоследствии может перейти в генерализованную форму путем трансмембранной транслокации микроорганизмов и их токсинов из открытой полости организма в лимфатическое и кровеносное русло с возникновением дополнительных очагов инфекционного процесса различной локализации.
Наиболее часто очаги эндогенной инфекции формируются в кишечном, урогенитальном и респираторном трактах. Часто такие очаги включают лекарственно устойчивые бактерии родов Staphylococcus, Enterococcus, Klebsiella, Escherichia, Enterobacter, Citrobacter, Hafnia, Serratia, Providencia, Morganella, Proteus, Rahnella, Pseudomonas, Acinetobacter, Streptococcus, Corynebacteium, а также грибы родов Candida и Geotrichium, нередко в ассоциациях формируемых поликомпонентных паразиоценозов.
Наиболее часто выраженные и стойкие очаги инфекционного процесса связаны с формированием биопленок синегнойной, протейной, энтеробактерной или клебсиеллезной природы. Они, как правило, развиваются на фоне тяжелой соматической основной патологии (опухоли, спаечная болезнь кишечника, нейроэндокринная и генетическая патология с выраженными вторичными иммунодефицитами), при наличии сопутствующих микологических, глистных и паразитарных инвазий у лиц с лучевой болезнью и при суперинфекциях (хламидиозе, микоплазмозе, уреаплазмозе, герпес-, рота-, корона- и цитомегаловирусной инфекции, вирусных гепатитах, туберкулезе, сифилисе).
Поэтому, в случае обнаружения неслучайных ассоциаций условно-патогенных микроорганизмов, больным рекомендуется проведение дополнительных целевых микробиологических, вирусологических, иммунологических и паразитологических обследований для исключения вышеуказанных суперинфекций, паразитозов и вариабельных (вторичных) иммунодефицитных состояний. Это в большинстве случаев позволяет провести правильную диагностику и назначить адекватную терапию основных заболеваний и оппортунистических инфекций с учетом микроэкологических нарушений. Следует отметить, что при стойком нарушении нормальной микрофлоры (дисбиозе) могут проявляться признаки аллергии, атопический дерматит и нейродермиты, степень выраженности которых в разных случаях неодинакова.
Для стандартизации диагностики, лечения и профилактики дисбактериоза разработан «Протокол ведения больных. Дисбактериоз кишечника» (ОСТ 91500.11.0004. Приказ М3 РФ № 231 от 09.06.2003), согласно которому дисбактериоз определяется как «Клинико-лабораторный синдром, связанный с изменением качественного и/или количественного состава микрофлоры кишечника с последующим развитием метаболических и иммунологических нарушений с возможным развитием желудочно-кишечных расстройств». В указанном документе даны сведения и характеристики важнейших представителей микрофлоры человека; описаны модели пациентов при различных стадиях и фазах развития дисбактериоза, включая клинические и лабораторные критерии их оценки; рекомендованы препараты для восстановления микрофлоры, зарегистрированные в Российской Федерации.
Подчеркнуто, что этот клинико-лабораторный сидром обусловливается совокупными свойствами условно-патогенных микроорганизмов и их токсинами, повреждающими слизистую. Возникающий воспалительный процесс ведет к нарушению кишечного всасывания с развитием гиповитаминозов, белковой недостаточности, аллергозам. Создаются условия для транслокации бактерий из кишечника в системный кровоток с риском развития локальных инфекционных процессов вплоть до их генерализации.
Для профилактики и комплексной терапии оппортунистических инфекций, протекающих на фоне нарушенного микробиоценоза открытых полостей организма хозяина, используются препараты, которые в настоящее время разделяют на 4 группы: пробиотики, пребиотики, синбиотики и метабиотики. Согласно определению, предложенному в 2008 г. Экспертным комитетом ФАО и ВОЗ: «Пробиотики — это живые микроорганизмы, которые при употреблении в необходимом количестве, оказывают благоприятное воздействие на здоровье хозяина (Пробиотики и пребиотики. Всемирная гастроэнтерологическая организация (практические рекомендации).
В Отраслевом стандарте РФ (ОСТ 91500.11.0004) дано более полное определение: «пробиотики — это живые микроорганизмы, которые при естественном способе введения оказывают позитивные эффекты на физиологические, биохимические и иммунные реакции организма хозяина через стабилизацию и оптимизацию функции его нормальной микрофлоры».
Пребиотики — это препараты немикробного происхождения, способные оказывать позитивный эффект на организм хозяина через селективную стимуляцию роста или метаболической активности нормальной микрофлоры кишечника. В эту группу входят пребиотические препараты, относящиеся к различным фармакотерапевтиче-ским группам, но обладающие общим свойством — стимулировать рост нормальной микрофлоры: лактулоза (дюфалак), стимбифид (рафтилин), изомальтоолигосахи-рид, инулин, ПАМБА (амбен), лизоцим, патотенат кальция и др.
Синбиотики — это препараты, полученные путем рациональной комбинации пробиотиков с пребиотиками. Некоторые биологически активные добавки к пище (БАД), содержащие живые пробиотические бактерии и различные полезные для поддержания здоровья человека ингредиенты (аминокислоты, микроэлементы, витамины, антиоксиданты и т.д.)> следует рассматривать как синбиотики.
Метабиотики — препараты, содержащие бактериальные метаболиты, короткоцепочечные жирные кислоты и структурные компоненты бактериальных поверхностных и цитоплазматических структур, ДНК, РНК представителей индигенной микрофлоры, оказывающие лечебный эффект путем нормализации состава микробиоты кишечника и восстановления водно-электролитного баланса организма хозяина.
Основные лекарственные пробиотические препараты, приводящие к улучшению состояния здоровья, снижению риска возникновения различных заболеваний и способствующие позитивному эффекту комплексной терапии оппортунистических инфекций, представлены в таблице ниже.
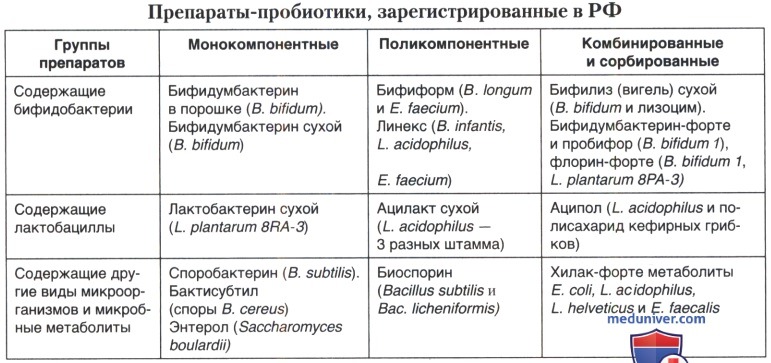
Препараты с пробиотическим механизмом действия принято подразделять на несколько групп:
• монокомпонентные, содержащие живые бактерии, относящиеся к представителям нормальных симбионтов — бифидобактерии (В. bifidum 1), лактобациллы (L. plantcirum 8РА-3) или к самоэлиминирующим антагонистам — споробактерин (В. subtilis), бактисубтил (споры В. cereus), энтерол (S. boulardii);
• поликомпонентные — бифилонг (В. bifidum и В. longum), ацилакт (Lactobacillus spp. — 3 разных штамма), аципол (L. acidophilus и полисахарид кефирных грибков), препараты фирмы Ферросан (Дания): Бифиформ Комплекс таблетки, содержащие В. lactis ВВ-12, L. rhamnosus GG, L. acidophilus и инулин, и Бифиформ капсулы для взрослых, содержащие В. longum и Е. faecium, и препарат Линекс (Sandoz, Франция), содержащий В. inf antis, L. acidophilus и E. faecium, биоспорин (В. subtilis и В. licheniformis);
• комбинированные — кипацид, содержащий L. acidophilus и комплексный иммуноглобулин, бифилиз, включающий В. bifidum и лизоцим;
• сорбированные — бифидумбактерин-форте и пробифор (иммобилизованные на активированном угле жизнеспособные бактерии В. bifidum 1 в концентрации 107-108), флорин-форте, представляющий собой иммобилизованные на активированном угле жизнеспособные бактерии В. bifidum 1 и планктонные L. plantarum 8РА-3. Пробиотики для перорального применения должны содержать жизнеспособные
бактерии в большом количестве (не менее 10 млн); обладать кислото- и желчеустойчивостью; подавлять патогенную и условно-патогенную микрофлору; оказывать иммуномодулирующее действие и восстанавливать нарушенный микробиоценоз. Они оказывают позитивное воздействие на процессы окислительного фосфорилирования и конкурентного поглощения витаминов, мембранный транспорт нутриентов и электролитный обмен.
Стабилизация нормального микробиоценоза обеспечивает подавление роста и транслокации возбудителей и их токсинов в системный кровоток; увеличение параметров гуморального (авидности антител сыворотки крови к связыванию антигенов патогенных микробов и их токсинов) и клеточного иммунитета (устранение дисбаланса провоспалительных (ИЛ-lb, ИЛ-6, ИЛ-8, TNF) и противовоспалительных (ИЛ-4 и ИЛ-10) цитокинов).
Пробиотические препараты эффективны при острых кишечных инфекциях бактериальной и ротавирусной природы, антибиотико-ассоциированной диареи, избыточном размножении бактерий в тонкой кишке и др. Биологическое действие препаратов может быть обусловлено бактериальными клетками, живыми или убитыми, и их структурными компонентами. В основе действия поверхностных структур и ДНК бактерий, входящих в состав пробиотиков, лежит способность взаимодействовать с Toll-подобными рецепторами, причем это взаимодействие в значительной мере определяется их видовой и штаммовой принадлежностью. Эффект терапии зависит и от лекарственной формы препарата, конкретной клинической ситуации, состояния иммунной системы и степени воздействия пробиотического препарата на местную лимфоидную ткань.
При сформировавшихся стойких очагах эндогенной и экзогенной инфекции пробиотикотерапия может не дать заметных положительных результатов из-за неспособности дезорганизовать бактериальную биопленку ассоциантов-возбудителей воспалительного процесса. В этом случае наблюдаются хронизация и рецидивирующее течение инфекционного процесса, требующие индивидуальной этиотропной терапии и коррекции нарушенной нормальной микрофлоры больного.
Для лечения таких больных рекомендованы: селективная деконтаминация патогенной и условно-патогенной микрофлоры с помощью кишечных антисептиков широкого спектра действия (рифаксимин, интетрикс, энтерофурил и т.д.), препаратов из апатогенных споровых культур бактерий, обладающих антагонистической активностью (бактисубтил, споробактерин, биоспорин), и использование энтерола (содержащего S. boulardii), эффективного для профилактики и лечения антибиотико-ассоциированной диареи. Для коррекции нарушенной нормальной микрофлоры используют пробиотики, пребиотики и симбиотики, включая пробиотические БАДы (нормофлорины Л, Б, биовестин лакто, аципол и др.).
Комплексное лечение оппортунистических инфекций, имеющих сложный этиопатогенез, направлено на ликвидацию и санацию всех выявленных первичных и вторичных очагов эндогенных и экзогенных инфекций, на восстановление физиологических функций и структуры поврежденных органов и систем организма (в частности, коррекцию моторной, секреторной и пищеварительной функций кишечника, нормализацию витаминно-минерального баланса) и стабилизацию иммунного гомеостаза.
- Читать далее "Характеристика основных пробиотиков (пробиотических препаратов)"
Редактор: Искандер Милевски. Дата публикации: 7.1.2021
- Принципы профилактики и лечения дисбактериоза кишечника
- Характеристика основных пробиотиков (пробиотических препаратов)
- Факторы воздействующие на микрофлору человека
- Функциональный пищевой продукт - пребиотик
- Свойства некоторых пребиотиков
- Словать терминов по оппортунистическим инфекциям в микробиологии
