Пластичность стволовых клеток - возможности дифференцировки
Первая существенная работа в этом направлении появилась в 1998 г. В ней сообщалось, что стволовые кроветворные клетки (СКК) может дифференцироваться в скелетные мышцы. Эти сенсационные данные послужили началом неслыханного в истории биологии бума в проблеме стволовых клеток. За последующие 4 года опубликовано более 200 работ, в которых утверждается, что стволовая кроветворная клетка (СКК) может дифференцироваться практически в любые ткани, в том числе в нервную, кардиомиоциты, гепатоциты, кожу, эпителий легких и кишечника, почек, сосуды, клетки поджелудочной железы (как продуцирующие инсулин b-клетки, так и все остальные типы панкреатических клеток) и др.
В таких исследованиях обычно изучают судьбу в культуре (in vitro) или в организме (in vivo) высокоочищенных популяций ранних предшественников из взрослого костного мозга, включая все члены отдела стволовых кроветворных клеток (СКК). Отбор ведется либо по маркерам на клеточных сортерах, либо используют клетки «боковой популяции» (клетки с активным механизмом выброса красителя, не имеющие маркеров линейных дифференцировок). Клетки помещают в культуру на фибронектиновой подложке, где для предотвращения дифференцировки используют коктейль, состоящий из LIF, PDGF (фактор роста, продуцируемый тромбоцитами), EGF (эпидермальный фактор роста). Получаемые линии бессмертны, во всяком случае, они способны проделать более 120 удвоений.
Такие линии являются практически неограниченным источником стволовых клеток, пригодных для изучения их дифференцировочного потенциала как в культуре, так и в организме. С помощью указанных приемов удается изучать потенциал стволовых клеток других тканей.
Для того чтобы вызвать желательные дифференцировки полученных клеточных линий и свежевыделенных сортированных СКК используют коктейли ростовых факторов, специфических для каждого вида дифференцировки. При этом одни и те же факторы используются в различных комбинациях для стимуляции как одинаковых, так и различных дифференцировок. Кроме того, ряд результатов был получен и при трансплантации некультивированных и неочищенных клеток. В связи с этим описание множества отдельных систем здесь невозможно и интересующихся приходится отсылать к соответствующим первоисточникам.
После трансплантации костного мозга или очищенных стволовых кроветворных клеток (СКК) либо мезенхимальных стволовых клеток (МСК) удалось выявить скелетные миобласты, кардиомиобласты, эндотелиальные клетки, эпителий печени и желчных протоков, эпителий легких, кишечника и кожи, нейроэктодермальные клетки донорского происхождения. Более того, были открыты стволовые клетки разнообразных тканей, которые могут превращаться друг в друга, включая СКК. Так, появилось сообщение об образовании СКК из нейральных и мышечных стволовых клеток.
Далее приводятся некоторые основные результаты, полученные in vivo. При трансплантации мезенхимальных стволовых клеток (МСК) мышам с инфарктом миокарда обнаружена миграция донорских клеток в область поражения (хемокиновый сигнал для привлечения клеток в зону инфаркта не известен), где они пролиферируют и дифференцируются в кардиомиоциты. Аналогичные результаты получены в ксеногенной системе при трансплантации атимическим крысам клеток костного мозга или крови человека. Наоборот, СКК из мышц способны восстанавливать кроветворение у облученных мышей, хотя опубликованы данные о том, что это не мышечные, а СКК, депонированные в мышце.
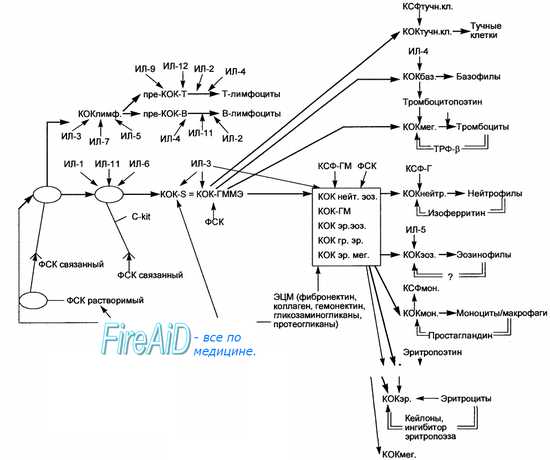
Обнаружена дифференцировка стволовых кроветворных клеток (СКК) в гепатоциты при трансплантации костного мозга мышам с пораженной печенью, однако число донорских клеток отличается в разных исследованиях на 4 порядка: в одном исследовании оно составляет 1 на миллион клеток, а в других несколько процентов. Трансплантация МСК в боковой желудочек мозга новорожденных мышей сопровождается упорядоченной миграцией (хемокиновый сигнал также не известен) донорских клеток в передний мозг, где они дифференцируются в нейроны, астроциты и олигодендроглию. Наоборот, культивированные стволовые нервные клетки из мозга взрослых мышей при трансплантации облученным реципиентам восстанавливают донорское кроветворение и продуцируют все три типа нервных клеток.
Необходимо отметить, что такие результаты удалось получить только после ко-культивирования стволовых нервных клеток с эмбриональными стволовыми клетками (ЭСК), и нельзя быть уверенными, что не произошло их слияние в культуре, что может приводить к ложной идентификации донорских клеток.
Эти результаты ставят под сомнение все, что мы знаем о биологии развития вообще, так как детерминация клеток (процесс необратимой дифференцировки клеток в эмбриогенезе) оказывается обратимой, и возможна де- и трансдифференцировка стволовых клеток, разрешающая несвойственные им дифференцировки не только в пределах тканей одного зародышевого листка, но даже в ткани других зародышевых листков. Например, СКК мезенхимальной природы могут дифференцироваться не только в клетки мезенхимального происхождения (кровь, кость, мышцы и др.), но и в нервные клетки, имеющие эктодермальное происхождение, или в печеночные клетки, производные эндодермального листка. Аналогичным образом такие взаимные превращения описаны и для нервной стволовой клетки, способной к дифференцировке не только во все три вида нервных клеток (нейроны, олигодендроциты, астроциты), но и в СКК, МСК, стволовую клетку печени, мышцы и т. д. В целом эти работы создают впечатление, что «все может превращаться во все» вполне в духе волшебных сказок.
Огромный интерес в мире к проблеме пластичности вполне понятен. Открывается возможность для клеточной терапии таких заболеваний, как паркинсонизм, болезнь Альцгеймера, инфаркт миокарда, цирроз печени, диабет, мышечная дистрофия, переломы костей и многих других тяжелых, а часто и неизлечимых заболеваний. Впервые человечество хотя бы гипотетически получает возможность искусственного создания «запасных частей» для важнейших органов и тканей организма. К тому же, несмотря на фантастический характер этих исследований, принципиальных аргументов против их реальности практически нет.
После осуществления клонирования не менее 8 видов животных стало очевидным, что во взрослом организме существуют соматические клетки, в которых сохранена вся генетическая информация. Еще более удивительно, что влияния со стороны цитоплазмы могут вернуть ядерный материал практически к состоянию зиготы, т. е. возможно снова развитие нового организма, при этом должна быть реально отменена уже состоявшаяся случайная инактивация одной из Х-хромосом, восстановлена длина теломер и др. Это требует строго оркестрированного последовательного включения экспрессии различных генов. Оказывается, что вся эта информация сохраняется по крайней мере в некоторых соматических клетках. Очевидно, что в природе не существует принципиальных запретов на де- или трансдифференцировку стволовых клеток млекопитающих.
Все же данные о пластичности стволовых кроветворных клеток (СКК) должны восприниматься с осторожностью. Дело в том, что эти исследования чрезвычайно сложны. Они требуют обязательной идентификации, с одной стороны, клеток разного происхождения (донора и реципиента), а с другой — производных разных тканей в пределах одного организма. На одних и тех же образцах надо выявить маркеры донора и там же многие маркеры, как морфологически, так и функционально характеризующие ткань, происхождение которой выясняется. Между тем в культуре клеткам свойственно терять или приобретать новые поверхностные маркеры, и даже выделение нескольких десятков их оказывается недостаточным для четкого определения происхождения и фенотипа клеток. К тому же в самых разнообразных тканях широко представлены клетки кроветворного происхождения, в частности макрофаги и лимфоциты, что тоже может приводить к искажению результатов, в частности, потому, что макрофаги могут фагоцитировать разрушенные клетки иного происхождения, мимикрируя производные другой ткани.
Следующей возможностью появления артефактов является слияние клеток донора и реципиента в культуре. Показано, что такие тетраплоид-ные клетки могут быть ошибочно идентифицированы. Некоторые генетические маркеры могут существовать в виде эписом, т. е. невключенными в геном, и в этом случае клетки разного происхождения окажутся одинаково маркированными.
Возможные западни таких исследований не исчерпываются перечисленным. Для получения прямых и бесспорных доказательств трансдифференцировки необходимо использовать для трансплантации только одну надежно маркированную стволовую клетку или клонированную популяцию этих клеток. Даже выполнение всех этих требований не гарантирует, что обнаруженный феномен может быть реализован в организме. Получение клонированных животных не является доказательством того, что этот процесс может происходить в нормальных условиях. То же относится и к трансдифференцировке стволовых клеток. Даже если действительно доказано, что некоторые клетки являются результатом необычной дифференцировки введенной стволовой клетки, из этого не следует, что процесс имеет какое-то физиологическое значение.
Все еще не доказано или не подтверждено, что клетки необычного происхождения обеспечивают восстановление функции поврежденного органа или системы. В случаях, когда известна «география» клеток, надо обнаружить реальное возникновение таких структур (островки Лангерганса, печеночные балки и др.). Главное — должно быть убедительно продемонстрировано восстановление утраченной функции в результате необычной дифференцировки трансплантированных стволовых клеток.
Таким образом, время (2003 г.) пересмотра основных догм в учении о стволовых кроветворных клетках (СКК) еще не настало. Недопустимо использовать недостаточно теоретически развитые знания в клинике.
- Читать "Врожденный и адаптивный иммунитет - механизмы"
Оглавление темы "Гемопоэз":- Механизмы миграции стволовых кроветворных клеток (СКК)
- Мезенхимная стволовая клетка - свойства, функции
- Эмбриональная стволовая клетка (ЭСК) - свойства, функции
- Пластичность стволовых клеток - возможности дифференцировки
- Врожденный и адаптивный иммунитет - механизмы
- Стволовые лимфоидные клетки - общий лимфоидный предшественник
- Онтогенез В-лимфоцитов - дифференциация
- Перестройка иммунноглобулинов при В-лимфоцитопоэзе
- Антигены и рецепторы В-лимфоцитов
- Созревание В-лимфоцитов в костном мозге
