Гликогенсинтетаза. Гликогенолиз в печени
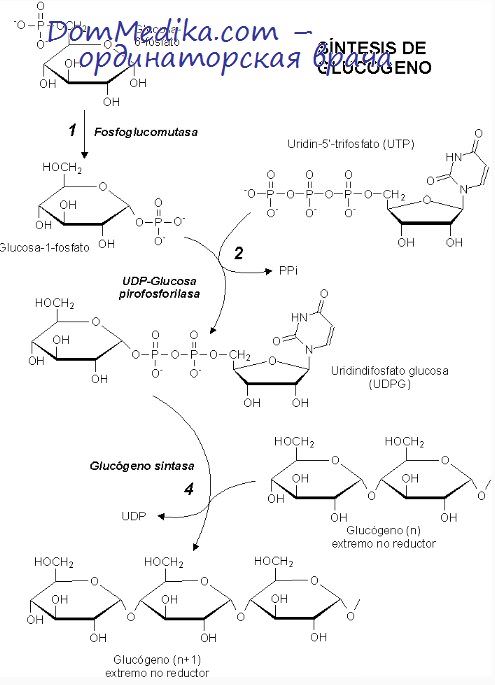
При реакции, катализируемой гликогенсинтетазой, входящий в состав УДФ-глюкозы мономер глюкозы присоединяется к свободной гидроксильной группе в положении 4 концевого остатка глюкозы уже существующей молекулы гликогена. Эта реакция повторяется с участием следующих поступающих в систему молекул УДФ-глюкозы, каждая из которых присоединяет по одному остатку глюкозы в положении 1 и освобождает УДФ. За счет АТФ этот УДФ может быть вновь превращен в УТФ.
Образующийся полимер содержит различное число (от нескольких тысяч до сотен тысяч) мономеров глюкозы, соединенных 1—4-связями.
Такая молекула не существует в виде вытянутой в одну линию цепи, поскольку имеется второй фермент, переносящий часть растущей цепи в обратном направлении с присоединением к свободной гидроксильной группе в положении 6 мономера глюкозы уже существующей цепи. Сочетанное действие этого «ветвящего» фермента и гликогенсинтетазы приводит к образованию линейных цепей мономеров глюкозы, соединенных 1—4-связями, и боковых ветвей с 1—6-связями в точках ветвления.
В результате этого структура гликогена напоминает дерево с ветвями, присоединенными к почти каждому десятому остатку глюкозы. Такая сильно разветвленная структура выполняет в клетке две главные функции: во-первых, она обеспечивает множество концевых участков, пригодных для быстрого присоединения или освобождения молекул глюкозы; во-вторых, она придает компактность и плотность резервируемой в клетке частице.
Электронно-микроскопическое исследование показывает, что эти частицы в цитоплазме печени соединены друг с другом в кластеры, или розетки, диаметром примерно 20 нм. Эти частицы содержат в виде структурированного многоферментного комплекса, помимо запасов гликогена, ферменты синтеза гликогена (синтетаза и ветвящий фермент), а также ферменты его распада.
Гликогенолиз в печени
Распад гликогена в печени происходит в ответ на повышение потребностей в глюкозе либо со стороны печеночной ткани, либо в других частях тела. Фермент фосфорилаза, как указывает его название, ответствен за разрыв связей между глюкозными мономерами гликогеновых цепей путем присоединения по этим связям неорганического фосфата, но не воды, как это имеет место при гидролитическом действии амилазы на полисахариды.
Фосфорилаза отличается от амилазы еще и тем, что последовательно отщепляет остатки глюкозы один за другим от кончиков ветвей «гликогенового дерева», а не в результате беспорядочного действия на любые связи. Действие фосфорилазы направлено только на линейные участки молекулы полимера, вплоть до точек ветвления; гидролиз 1—6-связей с освобождением глюкозы катализирует специальный фермент гликоген—6-глюканогидролаза (debranching enzyme), благодаря действию которого оставшаяся часть «дерева» становится пригодной для дальнейшей обработки при участии фосфорилазы.
Поскольку последний фермент катализирует присоединение фосфата к линейным 1—4-связям, продукты действия фосфорилазы представляют собой молекулы глюкозо-1-фосфата, число которых примерно в 10 раз превосходит число молекул свободной глюкозы, образующихся при гидролизе 1—6-связей.
- Читать далее "Реакции гликогенолиза. Регуляция гликогенеза и гликогенолиза"
Оглавление темы "Регуляция обмена углеводов":1. Гликогенсинтетаза. Гликогенолиз в печени
2. Реакции гликогенолиза. Регуляция гликогенеза и гликогенолиза
3. Аденилатциклаза и обмен гликогена. Фосфорилаза в обмене гликогена
4. Печеночные гликогенозы. Типы гликогенозов
5. Галактоземия. Обмен углеводов в мышцах
6. Регуляция гликолиза. Лактатдегидрогеназы
7. Метаболизм гликогена в мышце. Регуляция гликогенолиза и гликогенеза
8. Гликогенозы мышц. Обмен углеводов в мозгу
9. Субстраты метаболизма мозга. Обмен углеводов в эритроцитах и гемолитические анемии
10. Сахар крови. Регуляция сахара крови
