Метаболизм гликогена в мышце. Регуляция гликогенолиза и гликогенеза
Ферментные системы и регуляторные механизмы, участвующие в обмене гликогена в мышце и в печени, сходны между собой. Поскольку запас гликогена в мышце служит только для удовлетворения ее собственных потребностей, его концентрация в меньшей мере, чем в печени, изменяется при голодании; после приемов пищи концентрация гликогена в мышцах не достигает таких высоких значений, как в печени. Содержание гликогена в мышце, находящейся в состоянии покоя и получающей достаточное количество питательных веществ, редко превышает 1 % от ее общего веса, что обусловлено торможением активности гликогенсинтетазы гликогеном, когда его концентрация превышает эту величину. Поскольку общая масса мышц в организме человека велика, суммарные запасы гликогена в мышцах примерно в 5 раз больше, чем в печени. Несмотря на наличие такого большого запаса вещества, способного превратиться в глюкозу, гликоген мышц невозможно использовать для восполнения уменьшенного уровня глюкозы в крови, так как в мышцах нет глюкозо-6-фосфатазы. В соответствии с этим обмен гликогена в мышцах представляет собой исключительно внутриклеточный процесс, изменяющийся в зависимости от собственных внутренних энергетических потребностей клетки. В мышцах осуществляется цикл реакций гликогенеза — гликогенолиза: Глюкозо-6-фосфат —> Гликоген Гликоген —> Глюкозо-6-фосфат.
Для мышечной клетки затрата энергии в уплату за удобное хранение составит поэтому всего один макроэргический эквивалент на 1 моль глюкозы, как это было подсчитано выше в отношении использования внутриклеточной энергии в печени.
Регуляция гликогенолиза и гликогенеза
В мышце, находящейся в покое, фосфорилаза b, как и в печени, не активна: в физиологических условиях активность этого фермента совершенно не изменяется при изменениях концентрации АТФ и АМФ в клетке. Катализируемое киназой фосфорилирование фосфорилазы с образованием фосфорилазы а представляет собой первичный этап активации, имеющий отношение к начальным стадиям самого процесса сокращения. Киназа фосфорилазы мышц сильно активируется Са2+, концентрация которого в мышце в условиях покоя низка; раздражение соответствующего нерва вызывает освобождение Са2+ из связанной формы в цитоплазме. Такое освобождение Са2+ служит пусковым механизмом сокращения мышцы и одновременно стимулирует образование фосфорилазы а из фосфорилазы Ь, а также превращение гликогенсинтетазы из формы I в форму D. Таким образом, сигнал, побуждающий мышцу к началу работы, служит одновременно стимулом для распада гликогена, обеспечивающего снабжение энергией. После прекращения стимула Са2+ удаляется из цитоплазмы, и благодаря действию фосфатаз гликогенолиз оказывается «выключенным», тогда как синтетаза превращается в более активную форму I.
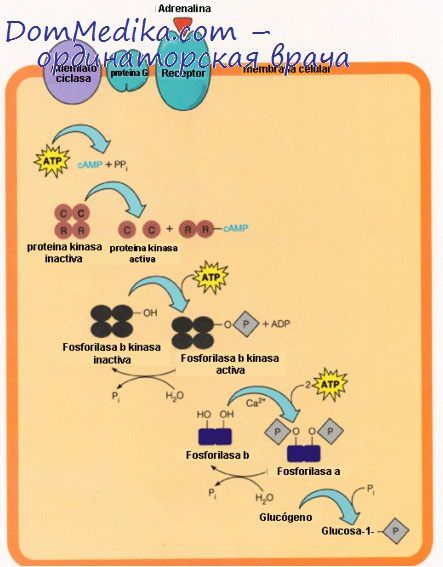
В дополнение к этой внутриклеточной регуляции посредством изменений концентрации Са2+ на гликоген мышц воздействует также внеклеточный агент — адреналин, причем это воздействие опосредовано через аденилатциклазную систему; в противоположность печени мембрана мышечной клетки не имеет рецепторов для глюкагона и, следовательно, не реагирует на этот гормон.
Циклаза мышц по сравнению с аналогичным ферментом печени более чувствительна к адреналину, который служит сигналом общей тревоги, побуждающим к максимально напряженной мышечной деятельности в период, когда требуются усилия чрезвычайно большой интенсивности. Повышение внутриклеточных концентраций циклического АМФ в результате активации аденилатциклазы приводит к превращению киназы фосфорилазы в такую форму, которая активна даже в присутствии очень низких концентраций Са2+.
Таким образом, фосфорилаза b может быть активирована с образованием фосфорилазы а независимо от процессов, сопровождающих мышечное сокращение, чем обеспечивается постоянный, повышенный уровень образования глюкозо-6-фосфата для выработки энергии путем реакций гликолиза.
Гликоген представляет собой наиболее быстро используемый источник энергии для мышечной деятельности после того, как запасы богатых энергией АТФ и креатинфосфата в мышцах исчерпаны (через 20—30 с после наиболее напряженной работы, например при беге на короткие дистанции). Использование гликогена затем происходит с той максимальной скоростью, которую только допускает гликолиз (в течение 2—3 мин) до тех пор, пока накопление лактата не становится избыточным и самоограничивающим. Кроме того (как это имеет место, например, при беге на длинные дистанции), работу мышцы ограничивают максимальные скорости реагирования аэробных механизмов окисления НАД-Н и пирувата. Первоначально в качестве топлива будет преимущественно потребляться гликоген мышц, но затем его роль как окисляемого субстрата постепенно возьмут на себя жирные кислоты. Таким образом, функционирование мышцы в условиях длительной работы приобретает черты сходства с теми процессами, которые характерны для мышцы в покое. Даже после нескольких часов относительно медленной деятельности достаточно короткого (всего несколько минут) периода отдыха для того, чтобы восстановить энергетические ресурсы.
- Читать далее "Гликогенозы мышц. Обмен углеводов в мозгу"
Оглавление темы "Регуляция обмена углеводов":1. Гликогенсинтетаза. Гликогенолиз в печени
2. Реакции гликогенолиза. Регуляция гликогенеза и гликогенолиза
3. Аденилатциклаза и обмен гликогена. Фосфорилаза в обмене гликогена
4. Печеночные гликогенозы. Типы гликогенозов
5. Галактоземия. Обмен углеводов в мышцах
6. Регуляция гликолиза. Лактатдегидрогеназы
7. Метаболизм гликогена в мышце. Регуляция гликогенолиза и гликогенеза
8. Гликогенозы мышц. Обмен углеводов в мозгу
9. Субстраты метаболизма мозга. Обмен углеводов в эритроцитах и гемолитические анемии
10. Сахар крови. Регуляция сахара крови
