Фиксация иммуноглобулинов на макрофагах (моноцитах). Связывание иммуноглобулинов с лимфоцитами
При изучении IgG кролика была продемонстрирована зависимость цитотропных свойств от общей конформации молекулы. Как показали И. Тарханова с соавторами (1975), расщепление в молекуле IgG кролика только одной дисульфидной связи в районе талии модифицирует белок таким способом, что он менее эффективно фиксируется в коже морской свинки in vivo и полностью теряет способность связываться изолированными тучными клетками. Это происходит несмотря на то, что центр для связывания IgG тканями морской свинки находится не в районе талии молекулы IgG, а в пределах Fc-участка.
Действительно, полученный с помощью папаина Fc-фрагмент молекулы IgG эффективно конкурирует с нерасщепленным IgG за рецепторы на клетках-мишенях. Следовательно, инактивация гетероцитотропного IgG после разрыва дисульфидной связи в районе талии (эта связь в молекуле IgG кролика единственная) — результат изменения общей конформации молекулы. Такие изменения, как об этом свидетельствуют данные о строении IgG, могут быть обусловлены увеличением свободы движений Су2-доменов относительно друг друга и Су3-доменов. Как будет продемонстрировано ниже, расщепление дисульфидной связи в районе талии оказывает большое влияние на реализацию многих эффекторных функций IgG.
Фиксация на макрофагах (моноцитах) и лимфоцитах. Указанная функция присуща прежде всего IgG и IgE. IgM способен фиксироваться только на одной из субпопуляций Т-лимфоцитов.
На макрофагах (моноцитах) обнаружено несколько видов рецепторов для IgE и IgC, причем последние специализированы в отношении связывания белка в мономерной и агрегированной формах. В свою очередь, рецепторы для нативного IgG подразделяются по специфичности на рецепторы для разных подклассов IgG. В агрегированной форме (например, в виде комплекса антиген-антитело) IgG с равной эффективностью связывается как гомологичными, так и гетерологичными макрофагами. Связывание нативного IgG видоспецифично.
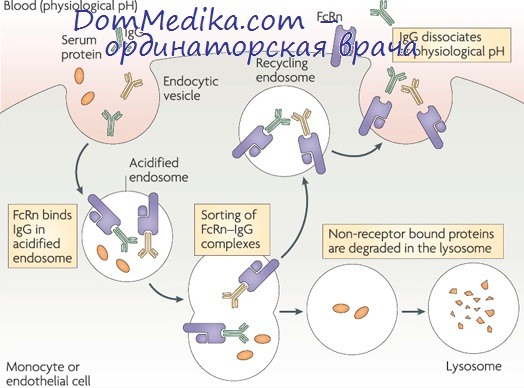
Важные данные получены при определении константы связывания мономерной формы IgG гомологичными макрофагами (R. Leslie, M. Alexander, 1982). Проанализировано взаимодействие в гомологичных системах IgG человека, кролика, морской свинки, мыши. Константа связывания Ка в различных системах колеблется на два порядка (от 6х105-М-1 до 1,3Х Х108 М-1). Число связывающих центров, т. е. Fcy-рецепторов, на поверхности макрофагов варьирует от 2Х104 до 4,5х106. При этом величина Ка тем больше, чем меньше число связывающих центров.
Реакция IgG с макрофагами — это экзотермическая реакция, в силу чего с повышением температуры (от 20 до 37°С) величина Ка снижается приблизительно на 30%. Тем не менее при величине Ка порядка 105—107 М-1 (при 37°С), свыше 95% Fcy-рецепторов макрофагов для IgG заняты фиксированным на них IgG в мономерной форме.
Остается открытым вопрос, необходимо ли in vivo вытеснение мономерного IgG с поверхности макрофагов для связывания этими клетками иммунных комплексов? Проблема существенна, так как без ее решения невозможно объяснить с современных позиций важнейший механизм иммунитета — освобождение организма от комплексов антител с самыми разнообразными антигенами, включая патогенные бактерии, вирусы, простейшие.
Среди подклассов IgG человека с моноцитами из крови человека связываются в мономерной форме только IgGl и IgG3 (с нейтрОфилами связываются все четыре подкласса IgG человека). На макрофагах мыши существуют специальные рецепторы для двух подклассов IgG: IgG2a и IgG2b. Центр для связывания IgG человека моноцитами находится в СуЗ-домене. После расщепления из этого домена выделили пептид из 10 аминокислот, который конкурирует с IgGl и IgG3 за связывание на моноцитах.
В IgG2a мыши центр для связывания макрофагами находится между Сн2- и СнЗ-доменами, а в IgG2b — в Сн2-домене.
- Вернуться в раздел "медицинская физиология"
Оглавление темы "Синтез и функции иммуноглобулинов":1. Рекомбинантные гены иммуноглобулинов. Гены тяжелых цепей иммуноглобулинов
2. Процессинг пре-мРНК. Процессинг иммуноглобулинов
3. Единицы транскрипции иммуноглобулинов. Трансляция легких и тяжелых цепей иммуноглобулинов
4. Синтез иммуноглобулинов. Секреция новообразованных иммуноглобулинов
5. Функции иммуноглобулинов. Антигеннезависимые эффекторные функции иммуноглобулинов
6. Реабсорбция в извитых канальцах почек иммуноглобулинов. Причина быстрого выведения Fab-фрагментов иммуноглобулинов
7. Фиксация иммуноглобулинов на тучных клетках и базофилах. Связывание иммуноглобулинов с тучными клетками
8. Цитотропные свойства IgE. Гомоцитотропины
9. Дифференцировка пре-В-лимфоцитов. Гомоцитотропины со свойствами IgG
10. Фиксация иммуноглобулинов на макрофагах (моноцитах). Связывание иммуноглобулинов с лимфоцитами
