Механизмы развития рака (аденокарциномы) простаты
Аденокарцинома предстательной железы — наиболее частая форма рака у мужчин. В 2007 г. в США доля рака предстательной железы составляла 29% всех злокачественных опухолей, а в структуре летальности от злокачественных опухолей была сравнима с таковой рака толстой кишки (9%). Риск заболеть раком предстательной железы в течение жизни составляет 1 : 6, но за последние 20 лет наблюдается значительное падение уровня смертности от злокачественной опухоли этой локализации. Рак предстательной железы может варьировать от клинически незначимого и выявляемого случайно до очень агрессивной злокачественной опухоли с летальным исходом.
а) Распространенность рака простаты. Еще многое в развитии рака предстательной железы неизвестно, но установлено, что имеют значение такие факторы, как возраст, раса, наследственность, гормональный фон и окружающая среда.
Раком предстательной железы обычно заболевают мужчины старше 50 лет. Однако в группах повышенного риска (см. далее) скрининг рака предстательной железы рекомендуется начинать с 40 лет. Эту рекомендацию предлагают распространить на всех мужчин в возрасте 40 лет с повторным исследованием в возрасте 45 лет с целью выявления нетипичных случаев до того момента, как опухоль станет неизлечимой. По данным аутопсии, частота рака предстательной железы у мужчин в возрасте 50 лет составляет 20%, а в возрасте 70-80 лет - 70%.
Отмечаются национальные и расовые различия в распространенности данного заболевания. Так, рак предстательной железы редко встречается у азиатов, но наиболее распространен среди представителей негроидной расы.
Помимо влияния наследственности имеют значение факторы окружающей среды, что подтверждается повышением уровня заболеваемости среди иммигрантов в США из Японии (хотя повышение не достигает значений заболеваемости среди коренных американцев). По мере того как восточная кухня все больше изменяется под влиянием Запада, заболеваемость клинически значимым раком предстательной железы на Востоке имеет тенденцию к росту. Не совсем понятно, определяется ли это пищевыми пристрастиями или изменениями образа жизни. Были изучены различные влияния, но ни одно из них не было признано основным фактором.
Например, изучали роль избыточного употребления жиров. Развитие рака предстательной железы могут предотвращать или замедлять ликопины (обнаруженные в томатах), селен, соя и витамин D.
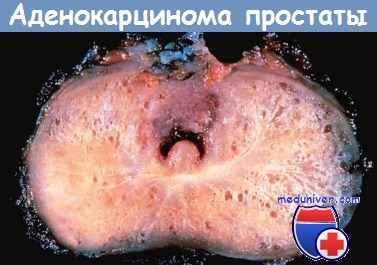
Опухолевая ткань располагается в заднем отделе железы (внизу слева).
Плотная беловатая ткань опухоли отличается от рыхлой структуры доброкачественной периферической зоны на противоположной стороне.
б) Причины и патогенез рака простаты. Важную роль в развитии рака предстательной железы играют андрогены. Рост и развитие опухолевых клеток, как и нормальных клеток предстательной железы, зависит от андрогенов, которые, связываясь с андрогенным рецептором, индуцируют экспрессию генов, отвечающих за рост клеток и их выживание. При изучении риска развития рака предстательной железы в разных расах интерес вызвал ген AR, сцепленный с Х-хромосомой и содержащий полиморфную последовательность повторов кодонов CAG, кодирующих глутамин.
Результатом значительного накопления повторов кодонов CAG является развитие редкой нейродегенеративной патологии — болезни Кеннеди, характеризующейся судорогами и слабостью в мышцах. Однако даже у здоровых людей наблюдаются выраженные различия в количестве повторов кодонов CAG и функции гена AR. Ген AR с минимальным количеством повторов полиглутамина обусловливает сильнейшую чувствительность к андрогенам. Наименьшее количество повторов полиглутамина отмечают у лиц с темным цветом кожи, среднее количество — у представителей европеоидной расы, а наибольшее количество — у азиатов, что совпадает с показателями заболеваемости и смертности от рака предстательной железы в этих группах. Количество повторов обратно пропорционально заболеваемости раком предстательной железы, зарегистрированной у подопытных мышей.
Значение андрогенов в поддержании роста и выживаемости опухолевых клеток в предстательной железе можно видеть на примере эффекта кастрации или терапии антиандрогенами, что обычно приводит к регрессу заболевания. К сожалению, большинство опухолей достаточно быстро становятся резистентными к андрогенной блокаде. Резистентность обеспечивают различные механизмы: приобретение чувствительности к низким концентрациям андрогенов (например, посредством амплификации гена AR); мутации гена AR, позволяющие активироваться андрогенному рецептору при соединении с неандрогенным лигандом; другие мутации или эпигенетические изменения, которые активируют альтернативные сигнальные пути, совместно нивелирующие зависимость от гена AR. К последним относятся изменения, которые ведут к повышенной активации сигнального пути Р13К/АКТ, который есть в опухолях, резистентных к антиандрогенной терапии.
Большой интерес в развитии рака предстательной железы представляет роль наследственных полиморфизмов. По сравнению с мужчинами с отсутствием в семейном анамнезе рака предстательной железы у мужчин, имеющих одного родственника первой степени родства, страдающего раком данной локализации, риск повышен в 2 раза, а при наличии двух родственников первой степени родства риск заболеть раком предстательной железы возрастает в 5 раз. Мужчины с отягощенной наследственностью имеют также риск развития рака предстательной железы в более раннем возрасте.
Риск повышается в 20 раз у мужчин, имеющих мутации гена-супрессора опухолей BRCA2, но большинство наследственных форм рака предстательной железы развиваются из-за изменений в других локусах, не приводящих к значительному повышению риска этой формы рака. Исследования взаимосвязи наследственности и генома человека позволили выявить локусы, ассоциированные с риском развития рака предстательной железы, к которым относится и локус 8q24, селективно повышающий риск среди мужчин с темным цветом кожи. Представляют интерес гены из тех участков, которые отвечают за врожденный иммунитет. Это позволяет предположить, что в основе развития карциномы предстательной железы может лежать воспаление, как и при других опухолях у человека.
Другие работы посвящены изучению роли опухолеспецифических приобретенных соматических мутаций и эпигенетических изменений. Наиболее распространенный вариант соматических мутаций при раке предстательной железы дает начало хромосомной перестройке: смещению кодирующих последовательностей фактора транскрипции генов семейства ETS (наиболее часто ERG и ETV1) на регулируемый андрогенами ген-промотор TMPRSS2. Такие перестройки переводят ETS под контроль гена-промотора TMPRSS2, в результате под действием андрогенов повышается экспрессия генов ETS. На фоне этого неизмененные эпителиальные клетки предстательной железы приобретают способность к инвазии (возможно, посредством активации матриксных металлопротеиназ).
Опухоли с измененными генами ETS имеют определенные морфологические признаки и различные продукты экспрессии этих генов по сравнению с опухолью с неизмененными генами этого семейства. Считается, что такие генные перестройки определяют специфический молекулярный подкласс рака предстательной железы. Знания о перестройке генов ETS также можно использовать для скрининга и ранней диагностики этой опухоли с помощью полимеразной цепной реакции.
Чаще всего наблюдаемое при раке предстательной железы эпигенетическое изменение — гиперметилирование гена GSTP1, ингибирующего экспрессию глутатион-S-трансферазы (GSTP1). Ген GSTP1 локализуется на хромосоме 11q13 и является важной составной частью пути защиты от широкого спектра канцерогенов. Другие гены, заблокированные эпигенетическими модификациями в клетках этой опухоли, включают ряд генов-супрессоров опухолей: PTEN, RB, p16/INK4a, MLH1, MSH2 и АРС.
Кроме простат-специфического антигена (PSA), рассмотренного далее, стали известны и другие гены и белки, которые могут играть роль биомаркеров рака предстательной железы. Некоторые из них принимают непосредственное участие в развитии данного заболевания, например EZH-2, а-метил-коэнзим А-рацемаза (AMACR) и PCАЗ. При раке предстательной железы отмечают пониженный уровень Е-кадгерина — белка, отвечающего за адгезию (уровень Е-кадгерина также снижен при инвазивной перстневидноклеточной карциноме желудка и дольковой карциноме молочной железы). Снижение уровня Е-кадгерина в опухолевых клетках связано с повышенной экспрессией ингибитора транскрипции EZH-2, что может быть причиной прогрессирования злокачественной опухоли.
При раке предстательной железы и предраковых поражениях повышена активность AMACR (фермента, участвующего в бета-окислении разветвленных аминокислот) (см. далее) и гена РСАЗ на хромосоме 9q, который кодирует регуляторную рибонуклеиновую кислоту (РНК).
Такое разнообразие аномалий позволяет сделать вывод, что карцинома предстательной железы (как и другие злокачественные опухоли) является следствием нескольких критических комбинаций приобретенных соматических мутаций или эпигенетических нарушений. Описано предраковое поражение — простатическая интраэпителиальная неоплазия (ПИН). В ткани предстательной железы, где выявлена злокачественная опухоль, часто встречается ПИН, которая располагается в непосредственной близости от злокачественной опухоли.
Исследования показали, что многие молекулярные изменения, обнаруживаемые при инвазивном процессе, также наблюдаются при ПИН. Например, определяются перестройки генов семейства ETS, подтверждающие, что ПИН предшествует злокачественной опухоли. Остается неясным, всегда ли ПИН трансформируется в нее.
- Читать "Морфология рака (аденокарциномы) простаты"
Оглавление темы "Патология мужских мочеполовых органов":- Механизмы развития и морфология тератомы яичка
- Механизмы развития и морфология опухоли стромы полового тяжа
- Механизмы развития и морфология гонадобластомы, лимфомы яичка
- Механизмы развития болезней влагалищной оболочки яичка
- Механизмы развития и морфология простатита
- Механизмы развития и морфология аденомы простаты (доброкачественной гиперплазии представительной железы, ДГПЖ)
- Механизмы развития рака (аденокарциномы) простаты
- Морфология рака (аденокарциномы) простаты
- Градация и стадии рака (аденокарциномы) простаты
- Клиника рака простаты
