Иммунитет при лимфоцитарном хориоменингите (ЛХМ) - исследования in vitro
Исследования in vitro. Персистентно инфицированные клеточные системы послужили хорошей основой для экспериментального изучения механизма иммунологически опосредованной цитопатологии при лимфоцитарном хориоменингите на клеточном уровне.
Perlmann и Holm показали, что иммуноспецифический лизис клеток, содержащих вирусоспецифический антиген, может осуществляться двумя путями: либо контактом со специфически сенсибилизированными лимфоидными клетками, либо с антителами, полученными от иммунизированных животных. В первом случае процесс лизиса клеток-мишеней протекает независимо от комплемента, во втором — требует его присутствия.
Еще в 1962 г. было обнаружено присутствие вирусоспецифического антигена на поверхности клеток L, персистентно инфицированных вирусом лимфоцитарного хориоменингита (Benson). В настоящее время установлено накопление двух видов антигенов в такой системе. Один из них расположен на клеточной поверхности и обнаруживается в непрямом тесте флуоресцирующих антител с гипериммунной сывороткой ко всем компонентам вируса и с помощью цитотоксического теста. Антисыворотка против комплементсвязывающего антигена выявляла гранулярный антиген только внутри цитоплазмы, но не на поверхности клеток (Rutter, Gschwender).
Персистентно инфицированные клетки L при сокультивировании с иммунными лимфоцитами обнаруживали значительно меньшую эффективность высева по сравнению с культурой незараженных клеток L, также контактировавших с иммунными лимфоцитами (Lundstedt).
Эти данные были подтверждены исследованиями Oldstone и Dixon, использовавшими изотопную метку 51Cr, выделяющуюся из инфицированных фибробластов мышиных эмбрионов под действием либо иммунных лимфоцитов, либо вирус оспецифических антител. Цитолитическая активность клеток селезенки мышей Balb/c, иммунизированных штаммом Е-350 против остро инфицированных клеток L, появляется в организме животных на 4-й день после внутрибрюшинной иммунизации, к 10-му дню достигает максимума и затем к 3-й неделе снижается до едва уловимых значений (Cole е. а.).
Эта активность полностью снимается при обработке иммунных селезеночных клеток анти-тэта-сывороткой, что указывает на основное участие Т-клеток в реакции (Cole е. а.).
Вместе с тем способность лизировать клетки-мишени, как оказалось, не коррелирует у иммунных лимфоцитов с их способностью вызывать смертельное заболевание при переносе в организм лекарственно-индуцированных взрослых вирусоноситслей (Cole, Nathanson).
В опытах in vitro активность иммунных лимфоцитов в отношении персистентно ипфицироваиных клеток также неоднозначна. Максимальная способность иммунных лимфоцитов лизировать клетки-мишени наблюдается в период высокой продукции такими клетками инфекционного вируса и присутствия па поверхности инфицированных клеток значительных количеств вирусоспецифического антигена, тогда как в той же системе, но при персистенции, продолжающейся в течение нескольких недоль, клетки оказываются относительно нечувствительными к литическому действию иммунных лимфоцитов (Cole е. а.).
Весьма вероятно, что подобное явление поможет понять различную реакцию на адаптивную иммунизацию у мышей с персистентной вирусной инфекцией, сформированной при рождении, и у мышей лекарственно-индуцированных вирусоноситслей.
Резюмируя обсуждение иммунопатологии лимфоцитарного хориоменингита, следует подчеркнуть, что результат заражения животных вирусом ЛХМ можно рассматривать как результат попытки зараженного хозяина элиминировать инфекционный процесс с помощью иммунологических защитных механизмов. Для инфекции, по-видимому, необходимо участие какого-то определенного количества клеток невральных мембран, чтобы развилось иммунологически опосредованное, как правило, смертельное, поражение центральной нервной системы. Поэтому у иммунных животных, видимо, функционируют те же механизмы элиминации (вряд ли можно было бы предполагать нечто иное), которые оказываются весьма эффективными до образования в невральных мембранах клеток-мишеней с тем, чтобы вызвать развитие фатального заболевания.
Вместе с тем в организме новорожденных или подвергавшихся обработке иммуподепрессантами животных происходит активное накопление вируса и постепенное широкое распространение его по всему организму. И в случае размножения вируса на фоне неполного развития или тяжелого поражения органов иммуногенеза создаются условия формирования и поддержания вирусной персистенции, так как именно в такой ситуации подавляется или обрывается клональная активность вирусоспецифических Т-лимфоцитов (Cole, Nathanson).
В популяции иммунных селезеночных клеток литической способностью обладают иммунные лимфоциты вилочковой железы — Т-лимфоциты (тимоциты). Однако для реализации этой способности необходим тесный контакт сенсибилизированных Т-лимфоцитов с инфицированными клетками (Cole е. а., Zinkernagel, Doherly). Цитотоксическая реакция иммунных лимфоцитов против клеток-мишеней, зараженных вирусом ЛХМ, протекает успешно только в случае близкого соответствия лимфоцитов и клеток-мишеней по Н-2-генам (Zinkernagel е. а.).
Сингенные иммунные клетки селезенки оказались по меньшей мере в 100 раз эффективнее аллогенных лимфоцитов. Реципрокное ограничение цитотоксической активности Т-клеток имело место между аллелями Н-2К, H-2d, H-2b. Тот факт, что лимфоциты от мышей Н-2а вызывают высокое специфическое выделение 51Cr, как из Н-2К, так и из Н-2d-клеток, инфицированных вирусом, свидетельствует о значении идентичности к и d концов комплекса гена Н-2 для литического взаимодействия клеток (Doherty, Zinkernagel).
Недавно было обнаружено существование двух популяций иммунных Т-лимфоцитов. Для этого лимфоидные клетки, характеризующие ранние стадии иммунитета («ранние иммунные клетки»), получали из селезенки и лимфатических узлов мышей через 9 дней после заражения, т. е. когда цитотоксическая активность в отношении инфицированных клеток-мишеней была максимальной. Наряду с этим лимфоидные клетки, характеризующие поздние стадии иммунитета («поздние иммунные клетки»), получали из тех же органов, но через 30 дней после заражения. Оказалось, что клеточные смеси, полученные через 9 дней, содержат 30—35% больших и бластоподобных лимфоцитов, в то время как смеси, полученные через 30 дней, — только 10—15%.
Перенос 108 «ранних иммунных клеток» сопровождался снижением титра вируса в печени и в селезенке остро инфицированных реципиентов, тогда как перенос того же количества «поздних иммунных клеток» оказывал лишь незначительный эффект. «Ранние иммунные клетки» были неактивными в организме персистентно инфицированных реципиентов, в то время как «поздние иммунные клетки» обладали выраженной антивирусной активностью. «Ранние» клетки отличались от «поздних» высокой резистентностью их функции к довольно значительным дозам Х-лучей. Есть основания думать, что наблюдаемые различия в свойствах свидетельствуют о существовании двух клеточных популяций, а сходная их чувствительность к анти-тэта-сыворотке подтверждает их принадлежность к Т-лимфоцитам (Volkert е. а.).
В лимфоидных органах мышей, зараженных штаммами Volkert и WEL, замечено значительное истощение Т-лимфоцитов в различных лимфатических узлах (Masuda, Suzuki). Это обстоятельство может пролить свет на механизм поддержания персистентной инфекции лимфоцитарного хориоменингита в организме животных, если иметь в виду, что лизис, например, инфицированных клеток L мышиными иммунными сыворотками в присутствии комплемента практически не зависел от плотности поверхностного вирусоспецифического антигена на мембранах. У мышей, являющихся длительными носителями вируса, отмечают малое содержание иммунных лимфоцитов при наличии антител к вирусу в сыворотке.
Поэтому можно считать, что состояние вирусоносительства у животных поддерживается как за счет дефицита Т-лимфоцитов в организме, так и за счет присутствия подавляющих антител (Cole е. а.).
Роль различных антител в иммунологической защите организма от ЛХМ-инфекции еще недостаточно ясна, хотя известно, например, что иммунные сыворотки, содержащие высокие титры комплементсвязывающих антител и низкие уровни нейтрализующих антител, одинаково эффективно лизируют в присутствии комплемента и остро и персистентно инфицированные клетки-мишени. Литическая активность сохраняется и в том случае, если такие сыворотки разводят до уровня, когда нейтрализующая активность в них уже не определяется, т. е., видимо, эффект лизиса связан главным образом с комплементсвязывающими антителами. Наконец, литическая активность определяется и в сыворотках мышей-вирусоносителей (Cole е. а.).
- Читать "Эпидемиология лимфоцитарного хориоменингита (ЛХМ) - распространенность"
Оглавление темы "Медленные вирусные инфекции":- Иммунитет при врожденной краснухе
- Эпидемиология врожденной краснухи - распространенность
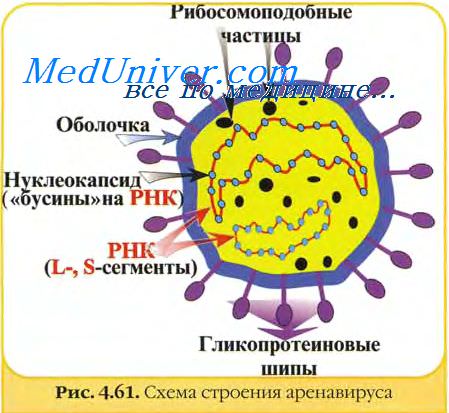
- Вирус лимфоцитарного хориоменингита (ЛХМ) - структура, характеристика
- Клиника лимфоцитарного хориоменингита (ЛХМ) - проявления
- Патогистология лимфоцитарного хориоменингита (ЛХМ)
- Патогенез лимфоцитарного хориоменингита (ЛХМ)
- Иммунитет при лимфоцитарном хориоменингите (ЛХМ) - исследования in vivo
- Иммунитет при лимфоцитарном хориоменингите (ЛХМ) - исследования in vitro
- Эпидемиология лимфоцитарного хориоменингита (ЛХМ) - распространенность
- Возбудитель лихорадки Ласса - структура, характеристика
