Оценка метаболизма миокарда в норме и при ишемии
Высокоэнергоемкие фосфаты, такие как аденозинтрифосфат, обеспечивают энергией сократительные белки КМЦ. АТФ накапливаются в миокарде благодаря двум различным, но интегрированным метаболическим процессам: окислительному фосфорилированию и гликолизу.
Жирные кислоты, глюкоза и лактат являются основными источниками энергии в сердце и в зависимости от концентрации каждого из них в артериальной крови и физиологических условий любой из этих трех источников может быть первичным субстратом. Повышенный захват и утилизация одного субстрата ведет к снижению потребления остальных.
В обычном состоянии натощак длинноцепочечные свободные ЖК являются предпочтительным источником энергии в сердце, а участие глюкозы составляет лишь 15-20% общего энергоснабжения. Когда снабжение кислородом нормальное, высокие уровни АТФ и тканевого цитрата, образующегося при расщеплении ЖК, подавляют окисление глюкозы.
Когда снабжение кислородом снижено, уровни АТФ и цитрата падают, а темпы гликолиза ускоряются. Анаэробный гликолиз может поддерживаться, если лактат и ионы водорода (продукты гликолиза) удаляются и не накапливаются. В условиях выраженной гипоперфузии эти конечные продукты гликолитического каскада накапливаются, вызывая ингибирование гликолитических ферментов и истощение имеющихся высокоэнергоемких фосфатов, что приводит к разрыву мембраны и гибели КМЦ.
В связи с этим даже для поддержания анаэробного гликолиза необходимо наличие минимально достаточного кровотока.
Визуализация метаболизма жирных кислот в миокарде
[11C]-Пальмитат. Поскольку ЖК являются первичным источником энергии миокарда в состоянии больного натощак, ранние ПЭТ-исследования были сфокусированы на характеристике кинетики длинноцепочечных ЖК, таких как [11С] пальмитат. Использование динамической ПЭТ позволило определить поступление РФП (за счет регионарной перфузии), пик накопления и выведение из пораженной зоны.
При поступлении РФП внутрь кардиомиоцита (КМЦ) он либо включается в эндогенный липидный пул, либо перемещается в митохондрии, где быстро деградирует путем β-окисления с образованием двуокиси углерода. В зависимости от потребности 80% экстрагированного [11С]пальмитата активно транспортируется из липидного пула в митохондрии для β-окислительного катаболизма. Но из-за сложной кинетики и большого количества сопутствующих явлений [11С]пальмитат не нашел широкого клинического применения.
[123I]-β-Метилйодпентадексановая кислота. Визуализация с меченными радиоактивным йодом аналогами жирной кислоты (йод-123-β-метилйоднентадекановая кислота) методом ОФЭКТ — это исследовательская область, изучающая «ишемическую память». После эпизода ишемии метаболизм ЖК может быть подавлен в течение длительного времени, и визуализация с помощью [123I]-β-метилйодпентадекановой кислоты обнаружит регионарный метаболический дефект, даже если произошло восстановление перфузии.
Этот метаболический сигнал о недавней ишемии был назван «ишемической памятью». Этот сигнал может быть полезен в клинической практике, например у пациентов, поступивших в отделение интенсивной терапии с купированными болями в груди. И хотя в Японии [123I|-β-метилйодпентадекановая кислота получила одобрение для клинического использования, она еще не одобрена PDA.
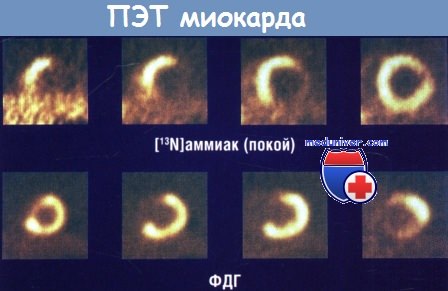
Верхний ряд. На всех изображениях среза по короткой оси, начиная с верхушки (слева) к основанию сердца (справа),
[13N]-аммиак используют как РФП миокардиального кровотока в покое.
Наблюдается снижение кровотока в переднебоковой, боковой и нижней стенках (дефекты наиболее четко отображены на первых трех изображениях слева).
Нижний ряд. ФДГ используют в качестве РФП миокардиального метаболизма глюкозы.
Повышенное поглощение ФДГ наблюдается в переднебоковой, боковой и нижней стенках.
Это называют «несогласованной» комбинацией ПЭТ-результатов, что свидетельствует о жизнеспособности миокарда в зонах пониженного кровотока или гибернации.
Визуализация метаболизма глюкозы в миокарде
Жирные кислоты являются первичным источником энергии натощак, а увеличение концентрации глюкозы в состоянии сытости приводит к повышению уровня инсулина, который стимулирует метаболизм глюкозы, подавляя липолиз. В результате метаболизм миокарда переключается с преимущественной утилизации ЖК на потребление глюкозы.
Принцип использования метаболического радиофармпрепарата (РФП), который отслеживает гликолиз, основанный на концепции сохранения или даже повышения утилизации глюкозы в миокарде с относительно плохой перфузией, но жизнеспособном (гибернирующем) миокарде, называют метаболически перфузионным несоответствием.
Потребление глюкозы миокардом в рубцовой или фиброзной ткани отсутствует, что представлено метаболически перфузионным соответствием. Несмотря на то что количество энергии, вырабатываемой при гликолизе, может быть адекватным для поддержания жизнеспособности кардиомиоцита (КМЦ) и сохранения электрохимического градиента на клеточных мембранах, ее может быть недостаточно для сохранения сократительной функции.
2-[18F]-Флюоро-2-дезоксиглюкоза. ФДГ — аналог глюкозы, используемый при ПЭТ для визуализации потребления глюкозы. ФДГ после инъекции в дозе 5-10 mCi быстро переходит из капилляров через клеточную мембрану внутрь КМЦ, где подвергается фосфорилированию гексокиназой до ФДГ-6-фосфата, но далее она не метаболизирует и не используется для синтеза гликогена. Вследствие того что скорость дефосфорилирования ФДГ низкая, она попадает в «ловушку» в миокарде, что создает возможность визуализировать при ПЭТ или ОФЭКТ регионарное потребление глюкозы.
В гибернирующем, но жизнеспособном миокарде захват ФДГ может быть повышен, что в асинергичных участках со сниженным в покое кровотоком становится сцинтиграфическим признаком гибернации.
Диагностическое качество визуализации ФДГ сильно зависит от гормонального статуса пациента и возможности использования субстрата. Большинство клинических исследований с ФДГ выполняют после нагрузки глюкозой в дозе 50-75 г приемом per os декстрозы за 1-2 ч перед инъекцией РФП, чтобы повысить метаболизм глюкозы и захват ФДГ, а также для улучшения качества изображений.
90% изображений с ФДГ у лиц без СД имеют вполне диагностически приемлемое качество, а у пациентов с клиническим или субклиническим СД при использовании только нагрузки глюкозой изображения менее четкие, т.к. повышение инсулина в плазме крови может быть замедлено, тканевой липолиз — не подавлен, а уровни свободных ЖК могут остаться довольно высокими. Стандартизация схем оптимизации качества изображений с ФДГ у пациентов с СД включает:
(1) в/в введение инсулина после нагрузки глюкозой;
(2) гиперинсулинемическое/эугликемическое клампирование (фиксация);
(3) использование дериватов никотиновой кислоты.
Визуализация окислительного метаболизма и митохондриальной функции миокарда
[11C]-Ацетат. Все окислительные субстраты метаболизируют в цикле трикарбоновых кислот (ТКК) после конвертирования в ацетил-коэнзим А (КоА). [11С]Ацетат активно экстрагируется миокардом и метаболизирует преимущественно трансформацией в [11С]ацетил-КоА в цитозоле и окислением в цикле ТКК в митохондриях до двуокиси [11С] углерода и воды.
Таким образом, быстрое миокардиальное превращение и клиренс [11С]ацетата в форме двуокиси [11С]углерода представляет собой метаболизм миокарда и оценивает митохондриальную функцию. У пациентов со сравнительно недавним ИМ и хронической стабильной стенокардией, скорость клиренса [11С]ацетата может отражать жизнеспособность миокарда и прогнозировать функциональное восстановление после реваскуляризации. Несмотря на обнадеживающие данные, [11С]ацетат как РФП остается на стадии исследования.
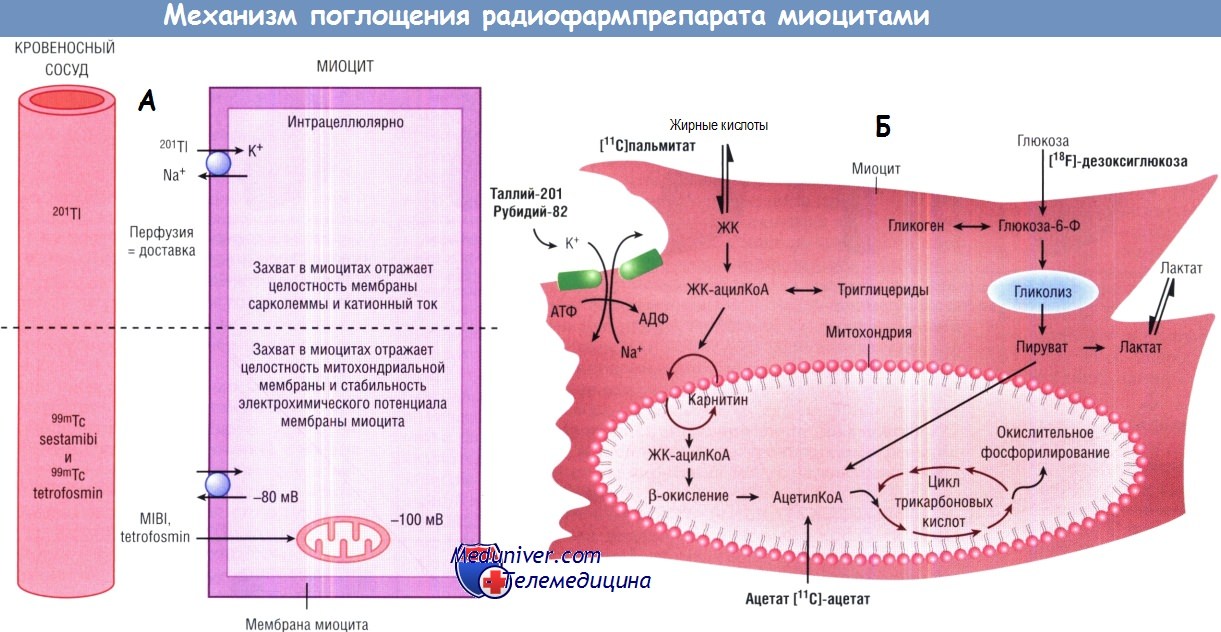
(Б) Механизм поглощения и задержки ПЭТ-препаратов перфузии (рубидий-82) и окислительного и анаэробного метаболизма ([11C]ацетат, (11C]пальмитат и [18F]-дезоксиглюкоза).
АДФ — аденозиндифосфат; АТФ — аденозинтрифосфат;
КоА — коэнзим А; ЖК — жирная кислота.
Рекомендуем видео урок цикл Кребса простым понятным языком
- Читать "Радионуклидное исследование функции желудочков сердца"
Оглавление темы "Визуализация миокардиальной перфузии (ВМП)":- Оценка метаболизма миокарда в норме и при ишемии
- Радионуклидное исследование функции желудочков сердца
- Радионуклидное исследование сердца при стабильных болях в груди
- Стратификация риска при синдроме стабильных болей в груди
- Значение и прогноз нормальных результатов визуализации миокардиальной перфузии (ВМП)
- Влияние метода диагностики ИБС на чувствительность и точность
- Влияние патологии сердца на точность диагностики ИБС визуализацией миокардиальной перфузии (ВМП)
- Современная чувствительность и специфичность визуализации миокардиальной перфузии (ВМП)
- Стресс-тест для диагностики ИБС при визуализации миокардиальной перфузии (ВМП)
- Физическая нагрузка для диагностики ИБС при визуализации миокардиальной перфузии (ВМП)
