Механизмы антикоагуляции (схема антитромботической системы)
Существует ряд физиологических антитромботических механизмов, целью которых является предупреждение свертывания крови в нормальных условиях. Активность компонентов антикоагулянтной системы зависит от целостности сосудистого эндотелия. Эти физиологические системы обеспечивают жидкое состояние крови в условиях нормального кровообращения и ограничивают процесс тромбообразования зоной поражения.
Эндогенными ингибиторами функции тромбоцитов являются эндотелиальный ПГ-I2, оксид азота, аденозиндифосфатаза (АДФаза) и монооксид углерода. Другие компоненты антикоагулянтной системы, в т.ч. антитромбин, комплекс белок С — белок S — тромбомодулин и ингибитор тканевого фактора, могут предупреждать образование фибрина. Кроме того, фибрин, который все же образовался, подвергается деградации под действием фибринолитической системы.
а) Антитромбин. Антитромбин (или антитромбин III) является основным белком плазмы, ингибирующим тромбин и другие факторы коагуляции. Он представляет собой одноцепочечный гликопротеин, синтезируемый в печени, и принадлежит к классу белков — ингибиторов сериновых протеаз (серпинов). Антитромбин нейтрализует тромбин и другие активные формы факторов коагуляции за счет связывания их активных центров (Arg393 и Ser394).
Скорость образования этих инактивирующих комплексов увеличивается в несколько тысяч раз в присутствии гепарина. Гепарин и протеогликан гепарансульфат являются компонентами сосудистой стенки. Таким образом, инактивация тромбина и других факторов коагуляции, возможно, происходит на поверхности сосудов в физиологических условиях. Врожденный дефицит (количественный или качественный) антитромбина у человека приводит к предрасположенности к венозным тромбозам.
б) Белок Z. Белок Z-зависимый ингибитор протеаз (ZPI) является гепарин-независимым ингибитором фактора Ха. Белок Z — это витамин К-зависимый белок, циркулирующий в плазме в комплексе с ZPI. Ингибирование фактора Ха ZPI (представителем семейства серпинов) в 1000 раз усиливается белком Z. По-видимому, низкий уровень белка Z не является независимым фактором риска тромбозов, но увеличивает риск у пациентов с другими тромбофилиями, особенно с дефицитом фактора V (фактора Leiden). Недавно было продемонстрировано, что полиморфизм гена ZP1 увеличивает риск венозных тромбозов.
в) Комплекс белок С- белок S - тромбомодулин. Белок С — еще один гликопротеин, синтезируемый в печени, который становится антикоагулянтом под действием тромбина, расщепляющего связь Argl69-Leul70 его тяжелой цепи. Активация белка С тромбином происходит с участием тромбомодулина, представляющего собой протеогликан, связывающий тромбин на поверхности эндотелиальных клеток. Таким образом, тромбомодулин выполняет антитромботическую функцию путем связывания тромбина и удаления его из кровотока, а также способствуя образованию активированного белка С, являющегося антикоагулянтом.
Связывание белка С с рецептором на поверхности эндотелиальных клеток способствует увеличению концентрации белка до уровня тромбин-тромбомодулинового комплекса, что увеличивает эффективность активации. Активированный белок С оказывает антикоагулянтное действие вследствие расщепления связей и разрушения связанных с мембраной факторов коагуляции Va и VIIIa. Кофактор белок S усиливает эти реакции. Белок S является гликопротеином, подвергающимся витамин К-зависимому карбоксили-рованию с образованием гамма-карбоксиглютаминовой кислоты. Кофакторное действие белка S обусловлено тем, что он усиливает аффинитет активированного белка С к мембранным фосфолипидам.
Качественный или количественный дефицит белка С или белка S либо резистентность к действию активированного белка С, обусловленная специфической мутацией гена фактора V, приводят к гиперкоагуляции.
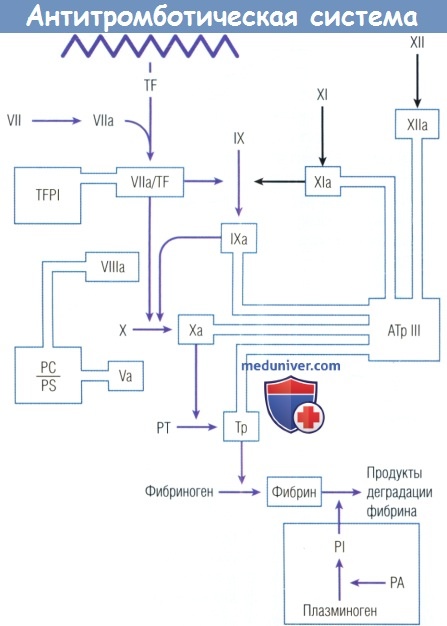
ингибитор тканевого фактора (TFPI) — и система фибринолиза, состоящая из плазминогена, активатора плазминогена (РА) и плазмина (PI).
РТ — протромбин; TF — тканевый фактор; Тр — тромбин.
г) Ингибитор тканевого фактора. Ингибитор тканевого фактора представляет собой ингибитор протеазы в плазме, который регулирует внешний путь свертывания, индуцируемый тканевым фактором. В отличие от других антикоагулянтов, принадлежащих к семейству серпинов, ингибитор тканевого фактора является поливалентным ингибитором сериновых протеаз типа Kunitz. Подобная структура позволяет ингибитору тканевого фактора проявлять двойную антикоагулянтную активность:
(1) против комплекса тканевый фактор-фактор VIIa (активность опосредована доменом Kunitz-1, связывающим фактор VIIa;);
(2) против фактора Ха (за счет связывания Kunitz-2 с фактором Ха).
Ингибитор тканевого фактора циркулирует в крови, будучи связанным с белками. Гепарин может привести к высвобождению ингибитора тканевого фактора из клеток эндотелия, где он связан с гликозаминогликанами, и из тромбоцитов. Нарушение активности ингибитора тканевого фактора и образование антител к нему наблюдаются у пациентов с АФС. ЛП(а) может связываться с ингибитором тканевого фактора и инактивировать его. Это новый механизм, который может объяснить влияние ЛП(а) на развитие тромбозов. Низкий уровень ингибитора тканевого фактора создает предпосылки для венозных тромбозов. На фоне приема оральных контрацептивов также возможно потенцирование подобного эффекта.
д) Фибринолитическая система. Тромбин, который не был ингибирован физиологической антикоагулянтной системой, может конвертировать фибриноген в фибрин. В ответ на этот процесс активируется эндогенная фибринолитическая система, которая удаляет фибрин, образовавшийся во внутрисосудистом пространстве, и восстанавливает проходимость сосудов. Если тромбин является основным ферментом свертывающей системы, то плазмин представляет собой главный фермент фибринолитической системы. Действие плазмина направлено на разрушение фибрина с образованием продуктов деградации фибрина.
Плазминоген, неактивный предшественник плазмина, синтезируется в печени и циркулирует в плазме в высокой концентрации. Он представляет собой одноцепочечный гликопротеин, имеющий очень сходную структуру с аполипопротеином (а), апо(а). Повышение уровня ЛП(а) в плазме ассоциируется с высоким ССР. Возможно, одним из атерогенных механизмов действия ЛП(а) является угнетение фибринолиза в результате конкурентного действия в отношении плазминогена.
1. Активаторы плазминогена. Активаторы плазминогена расщепляют связь Arg560-Val561 с плазминогеном, что приводит к образованию активного фермента плазмина, представляющего собой двухцепочечную молекулу, которая получает свою тяжелую цепь (или A-цепь) от аминокислотной концевой области, а легкую цепь (или В-цепь) — от карбоксильной концевой области плазминогена.
Ферментативно активный центр находится на В-цепи, тогда как A-цепь содержит центр связывания лизина. Этот центр позволяет плазмину связываться с фибрином, т.е. в физиологических условиях фибринолиз зависит от присутствия фибрина. Сериновая протеаза плазмин обладает и другими эффектами: играет существенную роль в эмбриогенезе, ремоделировании тканей, заживлении ран, ангиогенезе и миграции клеток.
Основными физиологическими активаторами плазминогена, которые превращают плазминоген в плазмин, являются ТАП и активатор плазминогена урокиназного типа. Эндотелиальные клетки выделяют обе эти сериновые протеазы в кровь в небольшом количестве. Плазмин конвертирует ТАП из одноцепочечной в двухцепочечную молекулу, в которой легкая и тяжелая цепи связаны дисульфидным мостиком. И одноцепочечная, и двухцепочечная формы ТАП могут превращать плазминоген в плазмин. Одноцепочечная форма активатора плазминогена урокиназного типа обладает незначительной ферментативной активностью, она должна быть конвертирована в активную двухцепочечную форму путем гидролиза связи Lys158-I1e159.
Высвобождение ТАП и активатора плазминогена урокиназного типа из эндотелиальных клеток потенцируется различными гуморальными факторами (например, факторами роста, гормонами, цитокинами) и изменениями гемодинамических параметров, но многие из этих факторов также стимулируют продукцию ИАП.
Плазминоген и ТАП обладают специфическим аффинитетом к фибрину и вследствие этого избирательно связываются со сгустком крови. Образование тройного комплекса, состоящего из фибрина, плазминогена и ТАП, обусловливает взаимодействие между плазминогеном и ТАП, что существенно ускоряет процесс превращения плазминогена в плазмин. Более того, частичная деградация фибрина ведет к появлению новых центров связывания плазминогена и ТАП на поверхности фрагментов фибрина, что в еще большей степени увеличивает скорость этой реакции. Такая последовательность событий способствует образованию плазмина непосредственно в области фибринового сгустка, который превращается в субстрат для действия плазмина с образованием продуктов деградации фибрина.
Таким образом, сам фибрин регулирует процесс собственного разрушения, обеспечивая центры связывания фибринолитических белков.
Помимо влияния на фибрин компоненты фибринолитической системы могут группироваться на поверхности клеток, как и компоненты каскада коагуляции, чтобы локализовать и оптимизировать процесс образования плазмина. Центры связывания плазминогена и ТАП, катализирующие процесс активации плазмина и имеющиеся у аннексина II, присутствуют также на поверхности эндотелиоцитов и некоторых других клеток. В эндотелии выявляются и рецепторы к активатору плазминогена урокиназного ти па.
Способность эндотелиальных клеток синтезировать и высвобождать активаторы плазминогена, а затем соединять между собой различные компоненты фибринолитической системы представляет собой мощный паракринный механизм, направленный на активацию процессов фибринолиза непосредственно вблизи места формирования внутрисосудистого тромба. Рецепторы к фибринолитическим белкам локализованы и на поверхности других клеток, в т.ч. тромбоцитов и лейкоцитов, которые накапливаются внутри тромба.
Плазмин разрушает фибрин в разных участках молекулы с различной скоростью. Этот последовательный процесс приводит к образованию фрагментов фибрина. В результате конечного этапа протеолиза высвобождаются домены D и Е фибрина. Когда плазмин воздействует на фибрин, высвобождаются D-димеры, которые можно определить в плазме лабораторными методами. Определение D-димеров — относительно специфичный тест на деградацию фибрина. D-димер — чувствительный маркер образования сгустков в кровотоке, поэтому его используют для диагностики тромбозов глубоких вен и ТЭЛА. Продукты деградации фибрина могут оказывать мощное антикоагулянтное и антитромбоцитарное действие, что еще больше усиливает антитромботический эффект процессов фибринолиза.
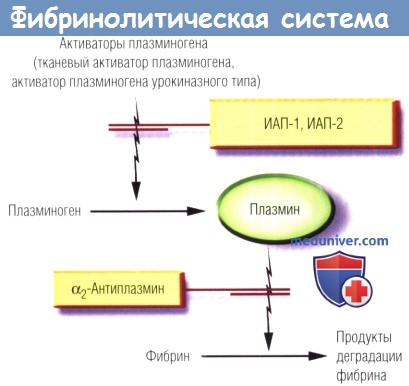
2. Ингибиторы фибринолиза. Как показано на рисунке выше, физиологический процесс регуляции фибринолиза идет на двух уровнях: (1) ИАП, а именно ИАП-1 и ИАП-2, подавляют функцию физиологических активаторов плазминогена; (2) α2-антиплазмин ингибирует плазмин.
ИАП-1 является основным ингибитором ТАП в крови. Этот ингибитор сериновых протеаз представляет собой одноцепочечный гликопротеин, высвобождаемый эндотелиоцитами и некоторыми другими клетками. ИАП-1 ингибирует ТАП путем образования соединения между активным центром ТАП и остатком ИАП-1 Arg346-Met347.
α2-Антиплазмин, также одноцепочечный гликопротеин, относится к классу серпинов и синтезируется в печени. Он является основным ингибитором плазмина в организме человека, образуя стехиометрическое соединение с плазмином в соотношении 1:1, что ведет к инактивации фермента. α2-Макроглобулин тоже ингибирует плазмин, но со значительно меньшей скоростью, чем α2-антиплазмин. Таким образом, α2-антиплазмин играет ключевую роль в процессе физиологической регуляции фибринолиза.
Дальнейшая регуляция фибринолиза осуществляется по уникальному механизму обратной связи образования тромбина через активируемый тромбином ингибитор фибринолиза. Тромбин активирует этот фермент, и данная реакция усиливается в 1000 раз в присутствии тромбомодулина эндотелиальных клеток. Тромбомодулин обеспечивает прямую молекулярную связь между системами коагуляции и фибринолиза - он превращает тромбин в антифибринолитический фермент. Активируемый тромбином ингибитор фибринолиза подавляет процесс фибринолиза путем отщепления концевого фрагмента от фибрин-мономера, удаляя центры связывания плазминогена и ТАП, которые обеспечивают превращение плазминогена в плазмин.
Повышение уровня активируемого тромбином ингибитора фибринолиза и полиморфизмы его генов могут быть ФР венозных тромбозов, а также могут увеличивать риск рецидивов тромбозов глубоких вен у пациентов с высоким уровнем факторов VIII, IX или XI. В настоящее время наличие связи повышения уровня активируемого тромбином ингибитора фибринолиза и полиморфизмов его генов с развитием ИБС не доказано.
- Читать "Тромбоциты в гемостазе: механизмы адгезии, активации, агрегации"
Редактор: Искандер Милевски. Дата публикации: 22.2.2019
