Влияние щитовидной железы на печень
а) Введение. Ключевая роль печени в поддержании системного гомеостаза и метаболизма делает этот жизненно важный орган особой мишенью для ряда эндокринных заболеваний. Это верно также с учетом широкого спектра функциональных взаимоотношений с множеством эндокринных органов. С другой стороны, нарушение функции печени ведет к нарушению активности гормонов. Эта возможность зависит от центральной роли печени в регулировании метаболизма нескольких гормонов и от способности печени взаимодействовать с ключевыми сигнальными путями. Гормоны щитовидной железы участвуют в регулировании метаболических процессов в печени, и наоборот, тироксин и трийодтиронин подвергаются метаболизму в печени, поэтому печень играет ключевую роль в регулировании системных эффектов этих гормонов.
Точно так же сложные пути регулируют взаимодействие надпочечников с печенью, и нарушения в работе этих двух органов часто сильно взаимосвязаны.
Гипопитуитаризм определяет фенотип, сходный с метаболическим синдромом, с повышенным риском гепатоза печени. С другой стороны, нарушение функции печени (например, при циррозе) может стимулировать секрецию гормонов гипофиза. Наконец, существует сильная корреляция между метаболической функцией печени и половыми гормонами у мужчин и женщин, при этом как эстрогены, так и андрогены, при наличии дисбаланса, способны влиять на функцию печени и вызывать ее повреждение. В свою очередь, при хронических заболеваниях печени нарушается функционирование оси гипоталамус-гипофиз-половые железы.
Более детальное изучение молекулярных механизмов, связывающих работу печени и разных гормональных систем, могло бы предоставить в будущем полезные терапевтические инструменты для предотвращения или ограничения повреждения печени, вторичного по отношению к гормональной дисфункции, или, наоборот, для коррекции гормональных нарушений у пациентов с хроническими заболеваниями печени.
Половые железы, гипоталамус, гипофиз, щитовидная железа, паращитовидные железы, шишковидная железа, поджелудочная железа и надпочечники представляют собой сложную сеть органов эндокринной системы. Основная функция эндокринных органов — выработка и секреция гормонов.
Адекватный гомеостаз эндокринной системы требует эффективной метаболической функции печени, которая действует как вторичный эндокринный орган. Действительно, печень играет важную роль в передаче сигналов эндокринной системы и находится на перекрестке между эндокринными органами, а также между эндокринными органами и их мишенями. Печень также влияет на метаболизм некоторых гормонов (в частности, гормонов щитовидной железы, надпочечников, половых гормонов и гормона роста).
Следовательно, нарушение метаболической функции печени приводит к заметным последствиям с точки зрения изменения уровня циркулирующих гормонов и нарушения гормональной передачи сигналов.
Некоторые заболевания, затрагивающие первичные эндокринные органы, часто способствуют повреждению печени с рядом нарушений, начиная от накопления липидов и заканчивая холестатическим повреждением, гепатитом, фиброзом, циррозом и злокачественными новообразованиями.
В частности, неалкогольная жировая болезнь печени (НАЖБП) стала наиболее частой причиной хронических заболеваний печени во всем мире и затрагивает около 30% западного населения [Bellentani и соавт., 2010; Европейская ассоциация по изучению болезней печени (EASL) и соавт., 2016]. Термин «НАЖБП», недавно переименованный в «метаболически ассоциированную жировую болезнь печени», охватывает несколько состояний, от простого стеатоза без воспаления (неалкогольная жировая дистрофия печени) до некроза и воспаления при НАСГ и «криптогенного» цирроза печени (Sattar и соавт., 2014; Eslam и соавт., 2020). Эти заболевания развиваются у людей, которые не страдают вирусным гепатитом и не употребляют алкоголь (Европейская ассоциация по изучению болезней печени и соавт., 2016; Ludwig и соавт., 1980). Растущая распространенность НАЖБП во всем мире связана с увеличением смертности и заболеваемости из-за тесной связи с ожирением, сердечно-сосудистыми заболеваниями, метаболическим синдромом, сахарным диабетом 2-го типа и гепатоцеллюлярной карциномой (Molina-Molina и соавт., 2018, 2019; Schwimmer и соавт., 2008).
НАЖБП также связана с другими эндокринными заболеваниями, такими как синдром поликистозных яичников (Hossain и соавт., 2011), гипогонадизм (Mintziori и соавт., 2017), дефицит гормона роста (Хи и соавт., 2012) и нарушение функции щитовидной железы (Chung и соавт., 2012; Geach, 2016). Причинами развития НАЖБП служат высокий уровень жирных кислот в пище и их приток из жировой ткани, повышенный внутрипеченочный липогенез de novo и нарушение экспорта липопротеинов очень низкой плотности (Европейская ассоциация по изучению болезней печени и соавт., 2016). Изменения происходят в рамках сценария повышенной инсулинорезистентности и системного неспецифического «метаболического» воспаления из-за увеличения висцерального ожирения и высвобождения нескольких провоспалительных адипоцитокинов (Grattagliano и соавт., 2019; Molina-Molina и соавт., 2018, 2019).
Следует отметить, что накопление жира в печени играет ключевую роль в развитии инсулинорезистентности на системном уровне и в других областях, таких как скелетные мышцы. Печень — это орган, вырабатывающий несколько белков, которые могут попадать в кровоток (до 25%). Примером может служить синтез и секреция альбумина, С-реактивного белка и фибронектина, белков, участвующих в регуляции гемостаза и фибринолиза, а также аполипопротеинов, функционирующих в качестве переносчиков. Другие белки регулируют метаболические пути и действуют как гепатокины и провоспалительные агенты, то есть во время развития стеатоза печени или у пациентов с сахарным диабетом 2-го типа. Некоторые из этих активированных гепатокинов (например, α2-макроглобулин, церулоплазмин, фетуин А, фетуин В, ретинол-связывающий белок 4, селенопротеин Р, α1-антитрипсин) обогащают аномальный протеом и играют роль системных медиаторов. Эти изменения приводят к нарушению метаболической/гликоль-липидной функции и развитию инсулинорезистентности в тканях вне печени (Kaur и соавт., 2012; Меех и Watt, 2017).
В этой и последующих статьях на сайте приведен обзор сложных взаимодействий, связывающих работу эндокринной системы и печени, а также взаимных эффектов заболеваний, затрагивающих как первичные эндокринные органы, так и гепатоциты.
б) Заболевания печени и щитовидной железы. Между щитовидной железой и печенью существует двунаправленное взаимодействие как в норме, так и при патологии. Гормоны щитовидной железы, с одной стороны, регулируют и координируют метаболизм печени на клеточном уровне, а с другой стороны, печень участвует в деградации гормонов щитовидной железы, действуя таким образом как регулятор в механизме обратной связи системы гипоталамус—гипофиз—щитовидная железа (Malik и Hodgson, 2002). Более того, многие препараты, применяемые у пациентов с заболеваниями щитовидной железы (например, тионамиды), могут по-разному влиять на функцию печени. Наконец, системные заболевания могут одновременно поражать оба органа.
Гормоны щитовидной железы (Т4: 3,5,30,50-тетрайодтиронин; Т3: 3,5,30-L-трийодтиронин) являются аминопроизводными тирозина и проявляют свою биологическую активность, связываясь с ядерным рецептором к тиреоидным гормонам (THR), который действует как активируемый лигандом фактор транскрипции для генов-мишеней гормонов щитовидной железы. Этот рецептор имеет две изоформы, α (THRα) и β (рецептор к тиреоидным гормонам β), кодируемые генами THRA и THRB соответственно (Jakobsson и соавт., 2017). В печени в основном экспрессируется изоформа THRβ. Экспрессия генов регулируется элементами ответа щитовидной железы, расположенными в регуляторных областях. Эти механизмы сходятся в координации уровня основного обмена. В печени гормоны щитовидной железы регулируют центральные пути синтеза и метаболизма триглицеридов и холестерина. Гормоны щитовидной железы стимулируют липолиз из жировых запасов и пищевых источников, в результате чего свободные жирные кислоты достигают гепатоцитов через переносчики, такие как белки-переносчики жирных кислот, белки, связывающие жирные кислоты печени, и транслоказа жирных кислот.
Экспрессия этих переносчиков зависит от THR. Тем не менее точные механизмы до конца не изучены. Дальнейшее усиление липогенеза de novo происходит за счет активации специфических генов, включая ацетил-КоА-карбоксилазу 1, синтазу жирных кислот, яблочный фермент, и рецепторов гормонов щитовидной железы. Следует отметить, что гормоны щитовидной железы усиливают не только поглощение жирных кислот и липогенез, но и их деградацию посредством β-окисления. Это объясняет общее снижение уровня триглицеридов в печени при некомпенсированном гипертиреозе. Биосинтез холестерина и его клиренс, а также более сложные метаболические пути обмена липидов (липофагия, пероксисомальное окисление митохондриального жира) также находятся под контролем гормонов щитовидной железы. Это играет важную роль в патофизиологии НАЖБП, которая является компонентом метаболического синдрома, начиная от отложения липидов в гепатоцитах и заканчивая индукцией воспаления, фиброза и, наконец, цирроза печени (Eshraghian и соавт., 2014). Последние данные перекрестных исследований указывают (хотя и не доказывают причинно-следственную связь) на положительную корреляцию НАЖБП с уровнем ТТГ и отрицательную корреляцию с уровнем циркулирующих гормонов щитовидной железы, даже для показателей в пределах референсных диапазонов, с более тесной связью при манифестном гипотиреозе (Bano и соавт., 2016; Chung и соавт., 2012; Ludwig и соавт., 2015; Хu и соавт., 2011).
У пациентов с ожирением уровень ТТГ в крови положительно коррелирует со степенью поражения печени, что было показано даже у детей (Тогип и соавт., 2014). Интересно отметить, что невозможно четко определить, какие эффекты гипотиреоза являются следствием снижения уровня тиреоидных гормонов, а какие — повышения уровня ТТГ. В этих условиях проводятся клинические исследования для оценки потенциального влияния аналога гормона щитовидной железы или THRβ-специфических агонистов на течение НАЖБП. Интересно, что испытание двух тиромиметических соединений, а именно эпротирома (КВ2115) и собетирома (GC-1), показало, что их применение приводит к улучшению липидного профиля (Sinha и соавт., 2018). Тем не менее исследование КВ2115 было прекращено в 3-й фазе из-за выявления гепатотоксичности препарата, а исследование GC-1 было прекращено в 1-й фазе из-за плохой переносимости препарата (Sinha и соавт., 2018; Vatner и соавт., 2013). Еще два агента, VK2809/MB07811 (Cicatiello и соавт., 2018) и MGL-3196, находятся во второй фазе испытаний (Sinha и соавт., 2018). Есть опасения, что длительное использование агонистов THRβ может вызвать состояние гипертиреоза в THRβ-зависимых тканях.
Активация и инактивация гормонов щитовидной железы в основном происходит в печени за счет каталитического действия дейодиназных систем (Bianco и соавт., 2002; Cicatiello и соавт., 2018). Превращение Т4 в ТЗ, который представляет собой биологически более активный гормон, происходит посредством дейодирования, катализируемого ферментной селенодейодиназной системой типа 1, которая в основном локализована в печени и почках и отвечает за 30—40% внетиреоидного синтеза Т3. Хотя эта система также может инактивировать Т3 и Т4, основным инактиватором является ферментная селено-дейодиназная система 3-го типа (обнаруженная в печени, коже и центральной нервной системе), которая путем деиодирования внутреннего кольца превращает Т4 в реверсивный Т3 (рТ3), Т3 в Т2 и рТ3 в рТ2, каждый из которых представляет собой неактивный метаболит. В связи с этим важно подчеркнуть, что последняя система почти не обнаруживается в печени здоровых людей, но активируется при регенерации печени и наличии опухолей в печени, а также выявляется в сыворотке крови и ткани печени тяжелобольных пациентов.
Полученные данные указывают на возможное усиление инактивации тиреоидных гормонов в качестве реакции на воспаление или повреждение печени. Кроме того, печень синтезирует многочисленные белки, такие как тироксин-связывающий глобулин, тироксин-связывающий преальбумин и альбумин, связывающий циркулирующие гормоны щитовидной железы и тем самым влияющий на размер их активной фракции. Еще одним важным вкладом гепатоцитов в метаболизм гормонов щитовидной железы является их избирательное поглощение через полипептиды, транспортирующие органические анионы (OATPS, например, NTCP, ОАТР1В1 и ОАТР1В3), что приводит к повышению их внутриклеточных концентраций по сравнению с концентрацией в плазме крови (Hennemann и соавт., 2001). Кроме того, имеются данные, указывающие на то, что желчные кислоты, которые синтезируются в печени, не только способствуют абсорбции и метаболизму липидов, но и действуют как сигнальные молекулы, активируя пути, индуцирующие выработку фермента дейодиназы 2-го типа и, таким образом, местное преобразование Т4 в Т3 (Watanabe и соавт., 2006). Этот путь может служить в качестве местного механизма, предотвращающего накопление жира, ожирение или инсулинорезистентность, что в будущем может представлять цель для медикаментозной терапии.
Нарушения функции щитовидной железы у лиц с заболеваниями печени следует интерпретировать в контексте «синдрома эутиреоидной патологии», что означает снижение общего и свободного ТЗ и Т4 и повышение уровня рТЗ, вторичное по отношению к изменениям селено-дейодиназы и концентраций в плазме тироксин-связывающих белков и липидов, а также последствиям острого стресса для системы гипоталамус—гипофиз—щитовидная железа. Предполагается, что эти изменения приводят к адаптивному снижению уровня основного обмена. Тироксин-связывающий глобулин представляет собой белок острой фазы, который снижает количество биоактивных гормонов щитовидной железы, что, как было показано, имеет клиническое значение при остром гепатите независимо от его этиологии.
Интересно, что у пациентов с хроническими заболеваниями печени существует отрицательная корреляция между Т3, Т4 и уровнем ТТГ в крови, что коррелирует с тяжестью заболевания и уровнем смертности от осложнений цирроза, например, печеночной энцефалопатии. Многие аутоиммунные заболевания печени сосуществуют или предсказывают наличие сопутствующего аутоиммунного поражения щитовидной железы (Kus и соавт., 2017). В тяжелых случаях печеночной недостаточности имеющиеся данные скудны и противоречивы, чтобы указать на причинно-следственные связи или клинические преимущества фармакологической модификации.
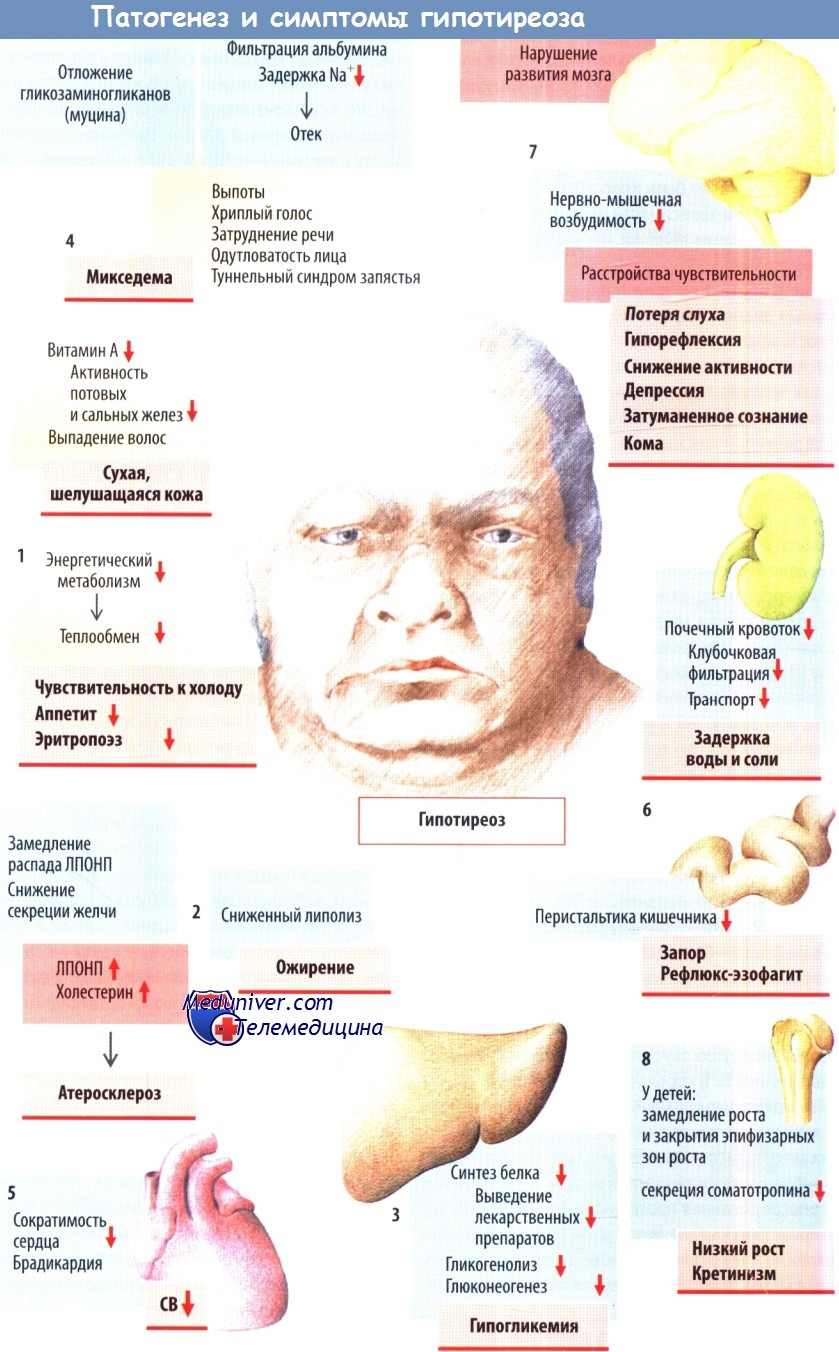
Тяжелый гипотиреоз может проявляться выраженными симптомами и признаками, имитирующими острое заболевание печени, такими как асцит у пациентов с микседемой или холестатическая желтуха, вызванная нарушением секреции желчи, сопутствующая гиперхолестеринемия и снижение моторики желчного пузыря. Также было высказано предположение, что печеночные проявления гипотиреоза могут быть вторичными по отношению к первичному поражению других органов-мишеней, например, правожелудочковой недостаточности, ведущей к застою в печеночных венах, портальной гипертензии и развитию асцита. Более легкие формы гипотиреоза редко влияют на функцию печени, хотя они могут предрасполагать, как упоминалось выше, к развитию жирового гепатоза или сопутствующего аутоиммунного поражения печени в случае тиреоидита Хашимото. Гипертиреоз и, в частности, тиреотоксикоз по крайней мере частично связаны с повышенной активностью аминотрансфераз в 40% случаев в результате гипоксического стресса из-за повышенной потребности в кислороде и воспалительной инфильтрации. Трудно отличить первичное поражение печени от вторичных проявлений, вызванных застойной сердечной недостаточностью, катаболическим состоянием или осложнениями сердечно-легочных нарушений.
Существует ряд состояний, одновременно влияющих на печень и щитовидную железу. Системные заболевания, такие как амилоидоз или наследственный гемохроматоз, могут поражать оба органа, вызывая неспецифические симптомы на начальных стадиях, что может привести к поздней постановке диагноза. Прием амиодарона является наиболее ярким примером, предрасполагающим к развитию гипо- или гипертиреоза и фиброза печени. Лучевая терапия и химиотерапия могут привести к тяжелому токсическому поражению обоих органов. Тионамиды уже много лет используются для лечения гипертиреоза, при этом точно установлено, что они могут вызывать острое повреждение печени, начиная от повышенного уровня ферментов до развития молниеносной печеночной недостаточности. Обычно метамизол натрия и Мерказолил (карбимазол) вызывают холестатическую картину повреждения печени, тогда как применение пропилтиоурацила ассоциировано с гепатоцеллюлярным повреждением. Следовательно, после начала лечения важно контролировать ферменты печени. Также соответствующим образом должен быть оценен предшествующий анамнез заболевания печени или ее лекарственного поражения.
Видео гормоны щитовидной железы в норме и при болезни
- Читать "Влияние надпочечников на печень"
Редактор: Искандер Милевски. Дата публикации: 14.1.2023
