Механизмы индукции апоптоза при ВИЧ-инфекции
Апоптоз CD4+-клеток, вызванный ВИЧ, реализуется за счет двух основных механизмов: прямого инфицирования ВИЧ и непрямых эффектов, к которым относят нарушение вирусом процессов регенерации Т-лимфоцитов; «попутное» повреждение клеток отдельными вирусными продуктами; гибель клеток как результат ее активации через «рецепторы смерти» (внешний путь индукции апоптоза); гибель активированной Т-клетки, опосредованная белками группы Bcl-2 (внутренний путь индукции апоптоза).
Последний механизм может активироваться при взаимодействии неинфицированной CD4+-клетки с антигенпредставляющими клетками, например макрофагами. Некоторые исследования показали, что гибель клеток по механизму апоптоза затрагивает преимущественно неинфицированные CD4+-клетки.
Апоптоз связан с некоторыми клеточными «рецепторами смерти», в том числе с рецептором Fas (CD95), р55-рецептором для фактора некроза опухоли (TNF) и TRAIL/APO-2-L (TNF-зависимый апоптоз-индуцирующий лиганд) рецепторами 1 и 2 (DR5).
Связывание рецепторов со своими лигандами (Fas-лигандом, TNF или TRAIL, соответственно) приводит к активации семейства цистеиновых протеаз, называемых каспазами (caspases), которые расщепляют пептидные связи между остатками цистеина и аспартата (т.е. представляют собой цистеин-зависимые аспартат-специфические протеазы).
Эти ферменты (которых насчитывают около 15) активируются путем протеолитического отщепления концевого продомена от их молекулы. Некоторые из них влияют на процессинг молекул цитокинов и, соответственно, на развитие воспаления, и по меньшей мере семь каспаз (каспазы 2, 3, 6, 7, 8, 9 и 10) участвуют в процессе гибели клетки.
Причины апоптоза при ВИЧ-инфекции:
• Прямой цитопатогенный эффект ВИЧ.
• Активация иммунной системы; TCR-опосредованная вызванная активацией гибель клетки (A1CD).
• Взаимодействие белка оболочки ВИЧ с молекулой CD4 (поперечное сшивание) или хемокиновым корецептором.
• Действие вирусных белков ( Nef, Tat, Vpu и Vpr).
• Увеличение экспрессии на клетке «рецепторов смерти»: Fas (CD95), р55 TNFR, TRAIL/APO-2-LR1, АРО-2-LR2.
• Взаимодействие цитокинов или лигандов (например, TNF, FasL и TRAIL) со специфическими рецепторами (например, Fas, рецепторами TNF и DR5).
• Экспрессия TNF и FasL ВИЧ-инфицированными макрофагами.
• Высвобождение цитохрома с митохондриями или нарушения экспрессии регуляторного белка Bcl-2.
• Высвобождение гранулолизина NK-клетками или ЦТЛ
• Взаимодействие CXCR4 с CD4 или SDF-1
• Суперантигены
Каспазы, принимающие участие в апоптозе, делят на инициаторные каспазы, к которым относят каспазы 2, 8, 9 и 10, и эффекторные каспазы, включающие каспазы 3, 6 и 7. Обычно каспаза 8 (еще одно название FLICE) и каспаза 3 вовлечены в большинство процессов при апоптозе.
Активированные каспазы расщепляют другие каспазы, которые, в свою очередь, активируют эндонуклеазы, которые осуществляют фрагментацию ядерной ДНК, что влечет за собой развитие морфологических, кариотипических и молекулярных изменений, характерных для апоптоза. Важную роль в реализации апоптоза играют митохондрии, в первую очередь за счет высвобождения цитохрома c.
Кроме того, из митохондрий высвобождаются регуляторные белки семейства Bcl, которые обладают как проапоптозным (например, Вах и Bid), так и антиапоптотическим (например, Bcl-2 и Bcl-xL) действием.
Усиление апоптоза Т-клеток при ВИЧ-инфекции может быть связано с различными механизмами. К ним относят индукцию апоптоза специфическими белками вируса (например, Tat), индукцию апоптоза в результате перекрестной сшивки оболочечных белков вируса с молекулами CD4 на клетках, а также индукцию апоптоза при взаимодействии цитокинов со специфическими рецепторами (в особенности, Fas-лиганда [FasL], TNF и TRAIL).
Кроме того, усиление апоптоза Т-лимфоцитов может быть связано с их гиперактивацией под влиянием измененных инфекцией антигенпредставляющих клеток (например, макрофагов и дендритных клеток), а также гмперактивирующего действия на Т-лимфоциты суперантигенов вирусного происхождения. Обычно усиление апоптоза в клетках иммунной системы (В- и Т-лимфоцитах), находящихся в периферической крови или в периферических лимфоидных органах, при ВИЧ-инфекции сопровождается активацией иммунной системы в целом.
Эти данные говорят в поддержку того, что усиление апоптоза связано с повышением чувствительности лимфоцитов к сигналам с «рецепторов смерти», в том числе Fas-рецепторов Т- и В-лимфоцитов.
В связи с этим большинство исследований показывают, что пролиферация клеток сама по себе не приводит к апоптозу клеток, выделенных от ВИЧ-инфицированных пациентов; необходима дополнительная активация клеток. В поддержку такого заключения свидетельствуют факты усиления на 40% апоптоза CD4+-лимфоцитов, выделенных от пациентов на бессимптомной стадии развития инфекционного процесса, под влиянием таких стимулирующих воздействий как перекрестная сшивка молекул CD4, обработка «знакомыми» антигенами в комплексе с молекулами главного комплекса гистосовместимости II класса (МНС-П) (например, столбнячным токсином) или митогеном из фитолакки американской (PWM).
Обычно считают, что механизм индукции апоптоза CD4+-клеток, связанный с взаимодействием Fas с Fas-лигандом, играет наиболее важную роль в случае ВИЧ-инфекции, но, возможно, он не влияет на гибель клетки на фоне прямого цитопатогенного воздействия вируса.
Таким образом, усиление экспрессии Fas-лиганда и продукции TNF ВИЧ-инфицированными макрофагами и дендритными клетками может привести к усилению апоптоза инфицированных и неинфицированных CD4+-Т-лимфоцитов, экспрессирующих CD95. Гранулолизин, высвобождаемый NK-клетками или цитотоксическими Т-лимфоцитами (ЦТЛ), также может активировать механизм, связанный с каспазой 3, и вызывать апоптоз клеток. Апоптоз можно заблокировать с помощью анти-CD95-нейтрализующих антител или антител к CD95-лиганду.
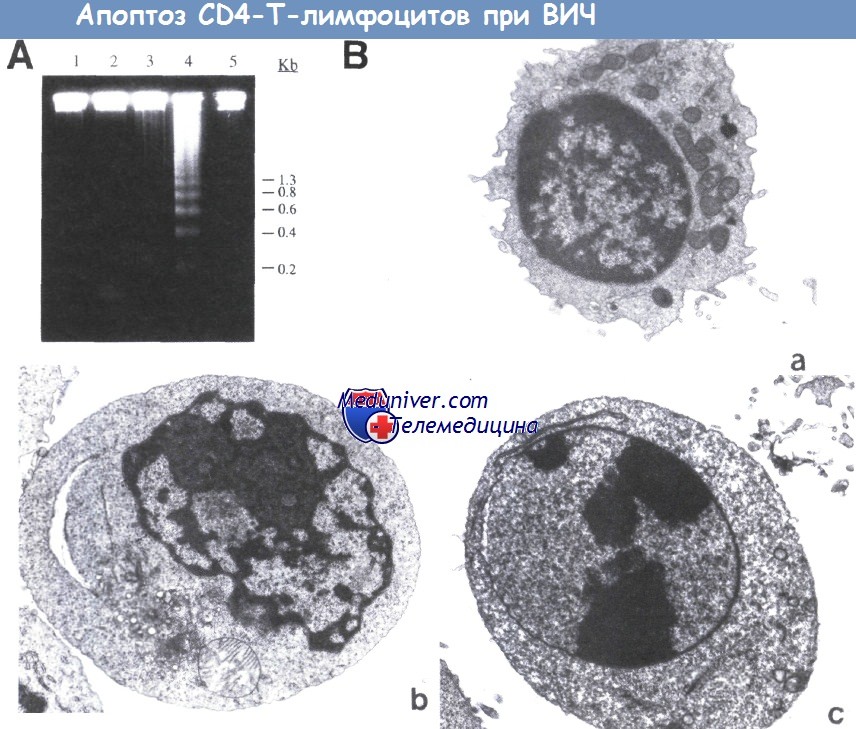
(А) Электрофорез в агарозном геле общей ДНК после обработки клеток антителами против Т-клеточного рецептора (антиTCR) (дорожка 2),
gpl20, поперечно сшитым с поликлональным анти-gр120-антителом, а затем проинкубированный с анти-TCR (дорожка 3),
500 рад гамма-облучения (дорожка 4) и gp120, поперечно сшитым с поликлональным анти-gp120 антителом (дорожка 5). На дорожке 1 представлены необработанные клетки.
Типичный для апоптоза лестничный характер расщепления ДНК наблюдается только после гамма-облучения и экспериментов с поперечной сшивкой с aнти-gp120- и анти-TCR-антителами.
(В) Ультраструктурная морфология апоптоза Т-клетки, вызванного лигированием TCR после взаимодействия gp120 с CD4.
(а) Необработанные CD4+-клетки;
(b и с) CD4+-Т-клетки, обработанные рекомбинантным химерным белком gp120 в сочетании с антителами к gpl20, а затем проинкубированные с анти-TCR.
В контрольном образце (а) апоптотические клетки отсутствуют. В обработанных образцах можно наблюдать клетки на ранней (b) и поздней (с) стадиях апоптоза. Шкала, 1 мкм.
- Читать "Типы клеток подвергающихся апоптозу при ВИЧ-инфекции"
Оглавление темы "Цитотоксическое действие ВИЧ":- Взаимодействие клетки с белками оболочки ВИЧ - gp120 и gp41
- Повреждение мембраны и гибель клетки под действием белков ВИЧ
- Апоптоз клеток под действием ВИЧ
- Механизмы индукции апоптоза при ВИЧ-инфекции
- Типы клеток подвергающихся апоптозу при ВИЧ-инфекции
- Значение цитокинов в апоптозе при ВИЧ-инфекции
- Значение белков ВИЧ в апоптозе клеток
- Апоптоз клеток приматов при ВИЧ
- Основные моменты по апоптозу клеток при ВИЧ
- Механизмы активации клеток при ВИЧ
