Антигены и генетика эшерихий (E. coli)
а) Антигены. Антигенная структура Е. coli довольно сложна, у этих бактерий обнаружено много различных антигенов. Антигенно-диагностическая схема базируется на определении О-, Н- и К-антигенов. К настоящему времени описано более 170 соматических О-антигенов, около 100 разновидностей К-антигена и более 50 Н-(жгутиковых) антигенов. О-, К- и Н-антигены имеют сложный факторный состав, чем обусловлены многочисленные внутри- и межродовые антигенные связи. Так, описаны перекрестные реакции по О-антигену внутри вида и между О-антигенами Escherichia и Klebsiella, Citrobacter, Providencia, Salmonella, Shigella и Yersinia.
Бактериальные клетки E. coli в составе клеточной стенки и капсулы могут иметь как нейтральные, так и кислые полисахариды. В большинстве случаев кислотными компонентами являются гексуроновые кислоты.
Большинство из известных Н-антигенов E.coli монофазные. Имеются сообщения о редких штаммах с двуфазными Н-антигенами. Перекрестные реакции по Н-антигену с представителями других родов энтеробактерий слабо выражены.
Понятие «К-антиген» первоначально использовали для обозначения поверхностных или капсульных антигенов, которые препятствуют О-агглютинабельности. В прошлом эти антигены были разделены на три группы (L, А, В в зависимости от действия нагревания), придающие агглютинабельные, агглютиногенные и агглютининсвязывающие свойства бактериям, обладающим данными антигенами. В настоящее время к К-антигенам относятся кислые полисахаридные капсульные антигены. У Е. coli они могут быть подразделены на две группы, различающиеся по мол. массе, составу кислот, термостабильности, электрофоретической подвижности и температурному режиму для проявления.
Кроме того, у Е. coli описаны нитевидные антигенные белковые структуры — фимбрии, или pili, и прочие факторы колонизации (CFA — Colonization factor antigen, англ.). Они играют важную роль в патогенезе диарейных заболеваний. К ним относят К88-антиген, обнаруженный у штаммов, вызывающих энтериты у свиней, К99-антиген, обнаруженный у штаммов, вызывающих энтериты у телят и ягнят, и факторы колонизации (CFA-I, CFA-II, CFA-III, CFA-1V), обнаруживаемые у выделенных от больных энтеротоксигенных эшерихий, детальное описание патогенетической роли которых приводится ниже.
б) Факторы патогенности и генетический контроль. Процесс взаимодействия диареегенных эшерихий с эпителием слизистой кишечника начинается с адгезии, основанной на избирательном взаимодействии бактерий с рецепторами эпителиоцитов и/или покрывающим их слоем слизи (муцинами), с последующим размножением бактерий в зоне инфицирования. Адгезины могут быть собраны в поверхностные фимбрии (pili) или ассоциированы с нефимбриальными адгезинами: белками наружной клеточной стенки. Описаны также завитки (curli), представляющие собой иррегулярные высокоагрегативные поверхностные структуры, способствующие прикреплению бактерий к белкам макроорганизма — фибронектину и плазминогену.
ЭПКП синтезируют пили, формирующие пучок, обозначенные как Bfp (Bundle forming pili, англ.), которым приписывается роль в первичном прикреплении эшерихий к эпителию. Однако основную роль в адгезии играют другие белковые образования. Механизм адгезии включает два этапа: обратимый и необратимый. Обратимая фаза обеспечивается гидрофобным взаимодействием и электростатическим притяжением, а необратимая — специфическим лиганд-рецепторным взаимодействием. Адгезины патогенных штаммов Е. coli представляют собой D-маннозочувствительные (MS) либо D-маннозорезистентные (MR) пили или фимбрии, при этом один штамм способен синтезировать различные типы фимбрий. MS фимбрии (I типа) связываются с остатками D-маннозы на поверхности клеток. Этот тип адгезина получил название MS, так как D-манноза препятствует связыванию бактерий с рецепторами на поверхности клеток.
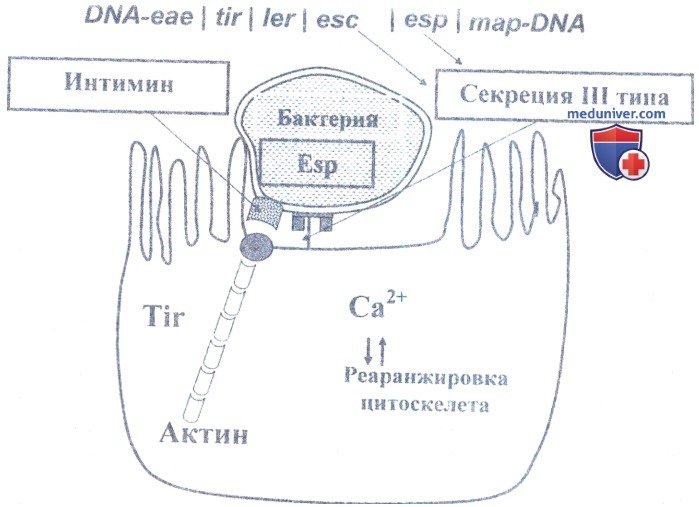
Механизм повреждающего действия энтеропатогенных E.coli связан с А/Е-ак-тивностью (от англ. Attaching — Effacing — «прикрепление - сглаживание»), обнаруженной у энтеропатогенных Е. coli, детерминируемой «островом патогенности». Эта активность связана с белком интимином, белком-рецептором для транслокации интимина, который инициирует реорганизацию актина, и митохондриальным протеином, нарушающим мембранную целостность и участвующим в образовании возвышения. Начальная стадия прикрепления бактерий к энтероцитам осуществляется через плазмидоопосредованные пучок-формирующие пили А — BfpA. После адгезии возбудителя активируется III тип секреции, посредством которого в цитоплазму клетки поступает транслокационный рецептор для интимина (Tir) и эффекторные белки, вызывающие нарушение цитоскелета, слущивание микроворсинок и деполимеризацию актина.
Рецептор для интимина видоизменяется и вклинивается в клеточную мембрану. Интимин соединяется с рецептором, концентрирует F-актин и некоторые другие элементы цитоскелета под областью прикрепления бактерии; в результате этого мембрана эпителия локально возвышается в характерный пьедестал. А/Е-активность изменяет мембранный потенциал клетки и повышает концентрацию внутриклеточного Са2+. Это приводит к изменению функции транспортеров и усиливает секрецию хлоридов. Протеинкиназа С и внутриклеточный Са2+ инициируют фосфорилирование миозина и повышают клеточную проницаемость. Пораженная клетка «складывается» и затем слущивается. Механизм повреждающего действия ЭПКП представлен на рисунке 14.1.
Ведущая роль в развитии секреторной диареи принадлежит энтеротоксинам. Различают LT — термолабильный и ST — термостабильный энтеротоксины. Среди термолабильных энтеротоксинов дифференцируют LT-I и LT-II, в патологии человека значим LT-1. Ген, кодирующий LT-I (ell или etx), расположен на плазмиде, которая также содержит гены ST и/или колонизирующего фактора. LT-I — высокомолекулярный белок 86 кД, состоящий из субъединицы А (28 кД) и пяти идентичных субъединиц В (11,5 кД). Ферментативная активность токсина связана с субъединицей А, состоящей из А1 и А2 пептидов, объединенных дисульфидными связями. По механизму действия и иммунологическим свойствам LT-I гомологичен (80%) холерогену. После связывания субъединицы В с рецепторами ганглиозидов, расположенных на базолатеральной мембране энтероцитов, субъединица А проникает в клетку.
При этом активируется аденилатциклаза и повышает внутриклеточный уровень циклического аденозинмонофасфата (цАМФ), который, в свою очередь, активирует цАМФ-связанную протеинкиназу. Активация каналов приводит к подавлению всасывания натрия, хлоридов и воды каемчатыми клетками на вершине ворсинок и одновременно стимулирует их секрецию в криптах. Под влиянием энтеротоксина происходит высвобождение медиаторов серотонина, нейротензина и вазоактивного интестинального полипептида из энтерохромаффинных клеток, стимулирующих секрецию электролитов и перистальтику.
Возможен также ответ в виде слабой интестинальной воспалительной реакции, опосредованной стимуляцией токсинами продукции провоспалительных цитокинов, активирующих иммунную систему кишечника и способствующих образованию метаболитов арахидоновой кислоты, что повышает проницаемость кишечника.
Среди термостабильных токсинов различают STa (ST-I) и STb (ST-II). STa-ток-сины продуцируют ЭТКП, выделенные от человека, STb-токсин обнаруживают преимущественно у штаммов, изолированных от свиней, значительно реже — выделенных от человека. STa — цистеин-содержащий термостабильный белок с мол. массой 2 кД. Основу действия STa составляет замещение гуанидина бокаловидных клеток. STa обладает большим сродством к рецепторам, чем гуанидин, так как содержит на 2 молекулы цистеина больше. Соединяясь с белковым рецептором щеточной каймы энтероцитов, гуанилатциклазой типа С (GC-C), токсин увеличивает внутриклеточную концентрацию циклического гуанозинмонофосфата (цГМФ). Это стимулирует секрецию хлоридов и/или ингибирует абсорбцию хлорида натрия, приводя к потере жидкости кишечником (диарее).
Рецепторы к данному энтеротоксину обнаруживаются на всех эпителиальных клетках кишечника. Однако в большей степени они сконцентрированы на энтероцитах тонкой кишки, что является причиной ее преимущественного вовлечения в патологический процесс. Количество рецепторов к данному токсину уменьшается с возрастом; это, по-видимому, объясняет более тяжелое течение подобных инфекций у детей.
Другой диареегенный механизм STa связан с вовлечением в процесс нервной системы кишечника. Энтеротоксины взаимодействуют с эндокринными (энтерохромаффинными) клетками на поверхности ворсин кишечника, повышая уровни цАМФ и цГМФ, что приводит к выходу серотонина, нейротензина и других пептидов в субэпителиальное пространство. Последние, в свою очередь, обусловливают секреторный невральный рефлекс, заключающийся в высвобождении вазоинтестинального пептида рядом с базолатеральной поверхностью эпителия. Вазоинтестинальный пептид связывается с рецепторами эпителиоцитов, повышает уровень цАМФ и нарушает ионый транспорт. Другим механизмом действия STa является вовлечение простагландинов (за счет активации фосфолипазы С) и провоспалительных цитокинов, аналогичных LT-I.
Увеличение клеточной проницаемости может быть связано с изменением цитоскелета и функции плотных контактов, опосредованных повышением концентрации внутриклеточного кальция и реорганизацией филаментозного (F) актина плотных контактов.
STb-белок секретируется в виде молекулы-прекурсора, которая в периплазматическом пространстве протеолитически превращается в полипептид с двумя дисульфидными связями, определяющими биологическую активность токсина, детерминирующим геном estB, расположенным на плазмидах, которые одновременно могут детерминировать другие энтеротоксины, колонизационный фактор, лекарственную устойчивость, продукцию колицинов. Токсин взаимодействует с рецептором, управляющим Са2+-каналами, что приводит к повышению уровня внутриклеточного Са2+. Одновременно токсин стимулирует секрецию бикарбонатов, напрямую воздействует на гладкомышечные клетки, усиливая перистальтику кишечника с явлениями диареи. Патогенные варианты могут продуцировать термостабильные или термолабильные энтеротоксины, в ряде случаев те и другие одновременно.
Цитолетальный дилатирующий токсин (CLDT) обнаружен у клинических штаммов E.coli, выделенных от детей, страдающих диареей. Токсин вызывает увеличение клетки, фрагментацию ядра и ее гибель в течение 96-120 ч, что связано с блокадой клеточного цикла, поэтому к нему особо чувствительны делящиеся клетки крипт. Кодируется геном cdt, выявленным также у шигелл, ЭИКП и кампилобактера.
Шига-подобные токсины (SLT), или веротоксины, обнаружены у энтерогеморрагических Е. coli, вызывающих острые кишечные инфекции с явлениями геморрагического колита, нередко осложняющегося гемолитико-уремическим синдромом. Дифференцируют SLT-I и SLT-II, идентичные на 55-57%, но различающиеся по антигенному строению. Они кодируются генами соответствующих профагов. SLT-I полностью идентичен шига-токсину, продуцируемому Shigella dysenteriae 1. Каждый токсин состоит из А и В субъединиц. Субъединица В связывает мембранный гликолипид, субъединица А поступает в клетку, в эндоплазматический ретикулум и, обладая N-гликозидазной активностью, блокирует синтез белка. Вклад шига-токсинов в патогенез диареи опосредуется через снижение абсорбции NaCl, посредством селективного повреждения абсорбирующих ворсин. Эпителий ворсин содержит больше мембранного гликолипида (Gb;) чем эпителий крипт, вследствие чего ворсины более чувствительны к SLT. Одновременно SLT вызывает повреждение сосудов, подслизистый отек, стимулирует локальную секрецию интерлейкина-1, интерлейкина-8 и фактора активации тромбоцитов, что приводит к инфильтрации слизистой нейтрофилами.
Липополисахарид размножившихся в продукте эшерихий может сам по себе обусловить диарею: большие дозы всасывающегося ЛПС вызывают повреждение сосудов микроциркуляторного русла слизистой оболочки, и это ведет к экссудации жидкости. В эксперименте показан еще один потенциальный диареегенный механизм ЛПС: экспрессия цитокинов и молекул адгезии на эпителиоцитах и фибробластах в собственной пластинке тонкого кишечника сопровождается активацией нейтрофилов, макрофагов и эозинофилов с выходом лейкоцитов из сосудов, инфильтрацией ими кишечной стенки и развитием инфекционно-воспалительного типа диареи.
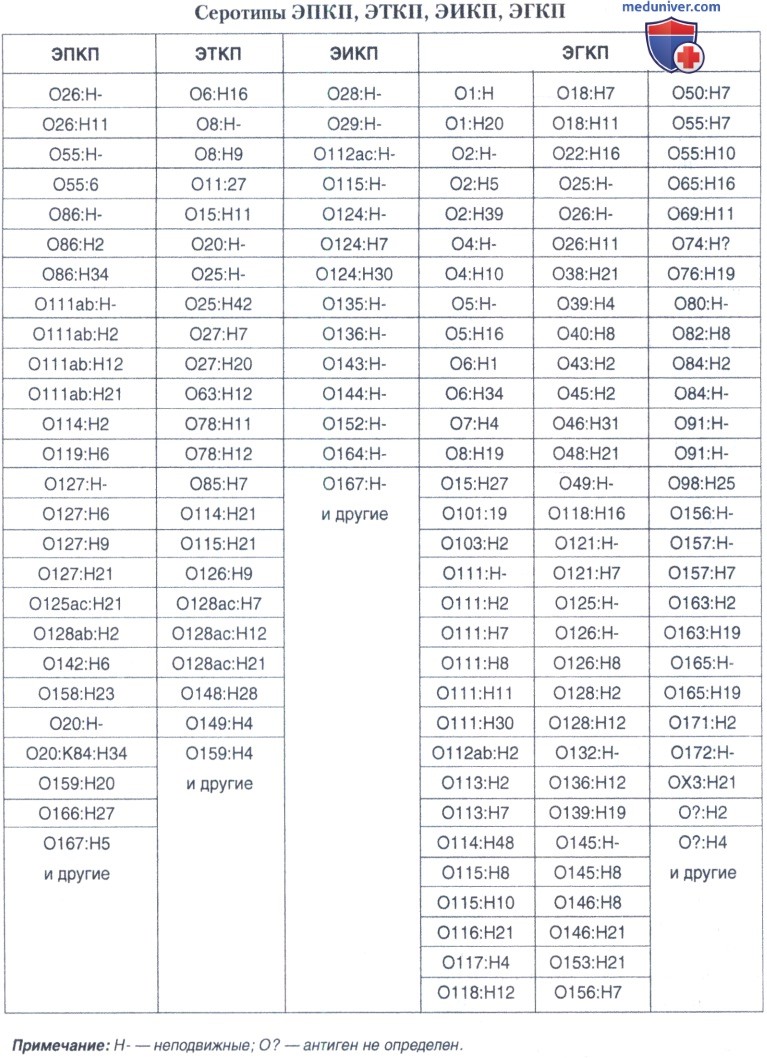
Штаммы определенных серологических О-групп продуцируют термолабильные (LT) и/или термостабильные (ST) энтеротоксины, шига-подобный цитотоксин (SLT), а-гемолизины. К настоящему времени накоплено достаточно сведений о конкретных серотипах, обладающих теми или другими факторами патогенности. Некоторые серотипы Е. coli, относимые разными исследователями к основным группам диареегенных эшерихий, представлены в таблице ниже.
В настоящее время предполагают, что сигналы, генерируемые при адгезивном взаимодействии с клеточными рецепторами, могут напрямую индуцировать диарею через воздействие на ядерный фактор NFKappaB, инактивирующий рецептор галанин-1, расположенный на базолатеральной поверхности энтероцитов, что приводит к Са2+ зависимой секреции хлоридов.
Диареегенный эффект могут вызывать E. coli, продуцирующие гемолизин (Hly), в том числе энтерогемолизин (Ehx), которые формируют образование каналов (пор) в мембране клеток, нарушающих вход-выход ионов через плазматическую мембрану. Полагают, что гемолизин, образуя поры в мембране энтероцитов с нарушением ионного равновесия в клетке и повышением концентрации внутриклеточного Са2+, способствует образованию метаболитов арахидоновой кислоты, нарушающих секрецию ионов, сопровождающихся развитием диареи инфекционно-воспалительного типа.
В качестве фактора патогенности у диареегенных эшерихий может выступать ЛПС клеточной стенки и некоторые ферменты. Их непосредственный эффект реализуется в ходе связывания возбудителя с кишечным эпителием. При адгезии бактерий на эпителиоцитах последние вырабатывают провоспалительные цитокины, а ЛПС индуцирует экспрессию цитокинов и молекул адгезии на энтероцитах и фибробластах собственной пластинки тонкой кишки. Указанные молекулы и цитокины активируют нейтрофилы, макрофаги, эозинофилы, стимулируют выход лейкоцитов из сосудов и инфильтрацию ими кишечной стенки, что, в итоге, способствует развитию воспалительной реакции. При первичном контакте синтезируются различные интерлейкины (IL), в том числе, IL-8,IL-1β, IL-6, IL-12, фактор некроза опухоли α(ФНО-α), граиулоцитарно-моноцитарный колониестимулирующий фактор и ряд хемокинов.
Локально синтезированные цитокины регулируют эпителиальную проницаемость и ионный транспорт. ФНО-α совместно с γ-интерфероном напрямую повышает проницаемость плотных контактов, разрушая F-актин, стимулирует секрецию ионов, воздействуя на мускариновые рецепторы. IL-1β и ФНО-α активируют фермент циклооксигеназу 2, что приводит к нарушению проницаемости плотных контактов, понижению адсорбции Na+ и повышению секреции Cl-. Локальный ФНО-а считается ключевым в патогенезе инфекционных колитов, так как стимулирует выработку эпителиоцитами и нейтрофильными лейкоцитами антимикробных белков — дефенсинов, которые прекращают размножение возбудителя в цитоплазме, ускоряя гибель инфицированных колоноцитов.
- Читать далее "Микробиологическая диагностика эшерихий (E. coli)"
Редактор: Искандер Милевски. Дата публикации: 27.12.2019
