Современные аспекты систематики микроорганизмов
Функция систематики не ограничивается только правильным и полным описанием изучаемых организмов, составлением каталогов, ключей, таблиц; основная ее задача — объяснить, почему организмы похожи или не похожи друг на друга, почему их следует объединить или разделить и почему они должны занять в системе именно то, а не иное место. Решение этой задачи невозможно без использования самых современных знаний. Поэтому в настоящее время систематика развивается в комплексе с такими науками, как генетика, молекулярная биология, экология, физиология, биохимия, биофизика, иммунология, цитология и др.
Для таксономической дифференциации патогенных, условно-патогенных и сапрофитных микроорганизмов, а также представителей симбиотической нормальной микрофлоры человека и животных потребовалось изучение огромного числа признаков.
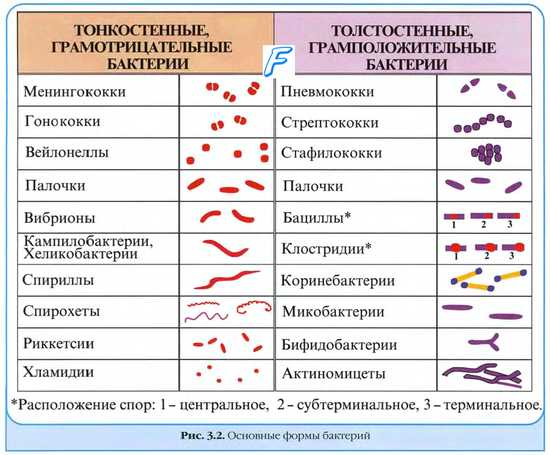
По морфологическим особенностям — характеристике поверхностного слоя клеток прокариоты разделены на микоплазмы (внешний слой — мембрана), организмы с однослойной клеточной стенкой (окрашивающиеся по Граму положительно) и организмы, характеризующиеся более сложной структурой (гра-мотрицательные бактерии). Наличие в клеточной стенке бактерий своеобразных гетерополимеров, включающих белки, липиды, углеводы и их компоненты (липо-полисахариды, липопротеиды, насыщенные и ненасыщенные жирные кислоты), позволяет дифференцировать различные группы бактерий. В качестве дополнительного таксономического критерия при дифференциации микрококков, стафилококков, стрептококков и вейллонелл с успехом была использована структура межпептидных мостиков в пептидогликане.
Числовая таксономия требует наиболее полной характеристики фенотипа, включающей морфологические, биохимические, серологические признаки, а для ряда видов патогенных бактерий — характер потребностей для роста in vitro. Так, для роста бруцелл требуется инозит, брюшнотифозных бактерий — триптофан, шигелл — никотиновая кислота и т. п.
Компьютерная технология обеспечила возможность обработки в короткие сроки полученных данных и изучения большого числа признаков у множества штаммов. Определение соотношения числа общих признаков к числу изученных позволило построить дендрограммы, отражающие степень близости сравниваемых видов. Однако для этого потребовалось оперировать большим числом штаммов и широчайшим набором правильно отобранных признаков.
В настоящее время полагают, что эволюция бактериальной клетки охватывает период более 3 млн. лет и может быть понята лишь в самых общих чертах. Так, анализ связи между генной функцией и локализацией генов у кишечной палочки показал, что только гены метаболизма глюкозы более или менее одинаково распределены. Расположение гомологичных генов на карте хромосом у кишечной палочки, шигелл, сальмонелл и клебсиелл близко, у энтерококков — совершенно иное. Это расценивают как следствие удвоения первичного генома на ранних этапах эволюции. В связи с этим трудно сделать заключение, является ли тот или иной отрицательный признак у данного вида бактерий следствием отсутствия соответствующей генетической информации или такая информация, хоть и неполная, существует.
Возможность приобретения новой информации при передаче плазмид еще более осложняет ситуацию. Общеизвестны плазмиды, сообщающие атипичные для данного вида биохимические признаки — способность утилизировать лактозу, сахарозу, раффинозу, продуцировать сероводород и др. Недавно в составе ДНК различных видов бактерий обнаружены геномные «острова» и «островки» патогенности, фланкированные (ограниченные по краям) прямыми нуклеотидными повторами, что обеспечивает их способность к распространению среди одного или родственных видов бактерий при конъюгации, трансдукции или трансформации. Такая мобильность «островов» патогенности связана с тем, что они могут входить в состав транспозонов, плазмид, включаться в геном бактериофагов. «Острова» патогенности, как правило, интегрированы в районах хромосомы вблизи генов, кодирующих специфичные транспортные РНК, что обеспечивает возможность горизонтального переноса генетической информации.
Именно интеграция, стабилизация и экспрессия генов вирулентности, входящих в состав «островов» патогенности, и лежат в основе формирования новых свойств, в том числе вирулентных, у родственных непатогенных видов бактерий, что приводит к возникновению новых штаммов и высоко патогенных эпидемических клонов. Известны «острова» патогенности, несущие гены, контролирующие синтез адгезинов, инвазинов, токсинов (гемолизина, цитотоксина, некротизирующего фактора1, энтеротоксина и др.), лекарственную устойчивость, транспорт ионов железа и др. Их функции достаточно разнообразны. Важно отметить, что геномные «острова» патогенности включают гены системы секреции III типа, ответственной за одноэтапный транспорт эффекторных молекул из бактериальной клетки в цитоплазму эукариотной клетки с последующим изменением цитоплазматических белков поражаемых мишеней. Все сказанное свидетельствует о значительной вариабельности многих признаков у штаммов одного и того же вида. Поэтому при недостаточном количестве изученных штаммов и/или признаков возможны неверные выводы.
Большое значение для развития современной таксономии и классификации имеет метод газожидкостной хроматографии. Этот метод применяется для анализа различных компонентов бактериальной клетки, внеклеточных продуктов их метаболизма и для обнаружения метаболитов, образующихся в результате деградации определенных субстратов, например, глюкозы.
Для таксономической дифференциации используют гидролиз клеточного материала (пиролиз) — масс-спектрометрию. При помощи этого метода можно анализировать целые клетки, гликолипидные и гликопротеидные компоненты клеточной стенки, капсул или цитоплазмы и специфические классы соединений, например, жирные кислоты, промежуточные продукты цикла Кребса, спирты, сахара, аминокислоты, амины и др. Метод характеризуется высокой чувствительностью, позволяющей определять нано- и субнанограммы веществ и дифференцировать штаммы на уровне рода или вида. Определенную популярность приобрело изучение жирно-кислотного состава основных компонентов клеточной стенки — фосфолипидов, которые уникальны у микобактерий, микоплазм, протея и др. Так, в результате изучения жирно-кислотного состава Mycobacterium tuberculosis, Mycobacterium hominis и Mycobacterium bovis установлено отсутствие у них ненасыщенной жирной кислоты С18, в то время как у Mycobacterium avium имеются все жирные кислоты от С12 до С18 и варианты С18:1, С18:2.
При помощи метода хромато-масс-спектрометрии определены длиноцепочечные клеточные жирные кислоты, насчитывающие 135 веществ, что дает информацию о 170 таксонах микроорганизмов. Известно, что у разных микроорганизмов в составе липидов клеточной стенки в сумме имеется около 200 жирных кислот, это отличает их от клеток организма человека. Причем оказалось, что в группе клинически значимых микроорганизмов некоторые вещества соотносятся только с одним таксоном. Число клеток или вес таких микроорганизмов вычисляют по концентрации вещества-маркера, используя известные данные, касающиеся содержания жирных кислот в микробной клетке и калибровки прибора. На основе метода определения микроорганизмов по жирно-кислотным маркерам построена хемодифференциация микроорганизмов, которая широко используется как метод их идентификации и подтверждения таксономического положения. Метод применяется для работы с микроорганизмами, изолированными в чистых культурах, и использует базы данных, содержащие сведения о составе жирных кислот нескольких тысяч штаммов бактерий и микроскопических грибов.
Особенности состава жирных кислот рекомендуется использовать наряду с другими параметрами в бактериальной таксономии и клинической бактериальной диагностике. Так, при помощи метода хромато-масс-спектрометрии показано, что, по данным молекулярного спектра клеточных жирных кислот, 50% пристеночной микрофлоры тонкой кишки составляют аэробные актинобактерии и факультативно анаэробные бифидобактерии, около 25% — стафилококки, стрептококки, энтерококки и коринеформные бактерии.
Изучение конечных продуктов метаболизма сыграло большую роль в определении родовой принадлежности анаэробов. Так, внутри семейства Bacteroidaceae микроорганизмы, продуцирующие масляную кислоту без изомасляной или изовалериановой, отнесены к роду Fusobacterium, а не образующие масляной кислоты или продуцирующие ее вместе с изомасляной и изовалериановой — к роду Bacteroides. У Clostridium botulinum обнаружено уникальное соединение — гидрокоричная кислота, которая, однако, присутствует только в некоторых штаммах клостридий, включая токсигенные.
Таксономическое значение имеет и изучение мембранных белков и пептидов методом электрофореза в додецил-сульфат-полиакриламидном геле. В частности, использование этого метода применительно к микоплазмам позволило внести уточнение в классификационное положение различных их подвидов и видов. Изучение спектров белков стафилококков и сравнение денситограмм позволило разделить их на группы, совпадающие с их подразделением, установленным другими методами.
Для дифференциации микроорганизмов по их антигенным характеристикам используются различные серологические методы (иммуноэлектрофорез, иммунофлюоресценция, иммуноферментный анализ и пр.). Известная классификация семейства кишечных F. Kauffmann основана на дифференциации полисахаридных компонентов липополисахарида (ЛИС) их О-антигена при помощи реакции агглютинации.
Все перечисленные признаки, выявляемые различными методами, дают в основном фенотипическую характеристику той или иной группе микроорганизмов.
Новую информацию в систематику и классификацию микроорганизмов внесла геносистематика, использующая следующие методы:
1. Один из методов — определение нуклеотидного состава ДНК. Хотя ДНК всех живых существ содержит 4 азотистых основания — аденин (А), тимин (Т), гуанин (Г) и цитозин (Ц), которые в двойной спирали спариваются — АТ и ГЦ, величина молярного отношения (Г+Ц) : (А+Т) у различных организмов значительно варьирует. О нуклеотидном составе судят по результатам химического исследования, определения температуры плавления, молекулярной гетерогенности ДНК. Анализ нуклеотидного состава ДНК у эукариотов и прокариотов показал, что у первых он варьирует в узких пределах — 35-40 мол.%, у прокариотов — в значительных — от 30 до 75 мол.%. У бактерий одного и того же вида среднее содержание ГЦ в ДНК близко. Тем не менее внутри рода этот показатель варьирует в пределах 10-15 мол.%. Сегодня очевидно, что при определении нуклеотидного состава ДНК сравниваемых групп только значительное различие в процентом содержании ГЦ убедительно указывает на отсутствие родства. Однако подобие указанного признака не является мерилом истинной генетической и эволюционной близости.
2. Более точные сведения дают, как полагают, результаты молекулярной гибридизации ДНК. По числу последовательностей у испытуемого организма, совпадающих с эталоном, определяют степень дивергенции (расхождения). Однако правомерность выводов, полученных в опытах по реассоциации нуклеиновых кислот, в значительной степени зависит от числа изученных штаммов и видов. Получены четкие данные в отношении энтеробактерий и аэробных псевдомонад.
3. Для оценки степени генетического родства используют также биологическую гибридизацию сравниваемых групп в опытах трансформации, трансдукции или конъюгации. Так, данные трансформации позволили перевести Neisseria catarrhalis в ранг рода Moraxella. Однако, если эффективного скрещивания не наблюдается, окончательный вывод об отсутствии родства можно сделать только при условии представления доказательств, что это не было следствием различий в поверхностных структурах, мешающих конъюгации или трансдукции.
4. Увеличивается число случаев определения генетического родства микроорганизмов на уровне трансляции генов. Изучают иммунологические характеристики различных ферментов (методом двойной диффузии в геле, количественной комплементфиксации и др.), например, щелочной фосфатазы и триптофансинтетазы. Изменение структуры аналогичных по функции ферментов отражает, как полагают, эволюцию энзимов.
5. Для классификации бактерий широко применяется каталогизация рибосомальных РНК-нуклеотидов. Этот метод использовался при определении филогенетического статуса большинства патогенных бактерий и представителей нормальной микрофлоры человека и животных. Строение рибосом является определяющим для функции клетки. Рибосома взаимодействует с большим числом молекул, включая молекулы мРНК и тРНК. Последовательности молекул основной рРНК высоко консервативны. Для исследования используется небольшая субъединица (чаще 16S, реже 23S рРНК). В молекулах 16S рРНК, помимо консервативных участков, имеются высоко вариабельные области (длиной 20-30 нуклеотидных пар), которые уникальны для любого вида бактерий. ДНК-зонды, основанные на последовательностях этих уникальных областей-мишеней, помогают идентифицировать и генотипировать изоляты.
6. Новейшей молекулярной техникой является секвенирование определенного гена или полного бактериального генома. Наибольшее распространение получили секвенирование рРНК и генов, кодирующих рРНК, оценка полиморфизма длины рестрикционных фрагментов, амплифицированных произвольными праймерами, идентификация при помощи ПЦР-секвенирования амплифицированной рРНК и сравнение полученной последовательности с известной, депонированной в генобанке (GenBank) Интернета.
В последнее десятилетие определились два направления исследований микробиоты человека:
1) совершенствование таксономии и классификации различных представителей нормальной микрофлоры;
2) использование методов геноиндикации и геноидентификации, разработанных для характеристики патогенных микроорганизмов и представителей нормобиоценоза. Интеграция и анализ данных по фенотипическим, генотипическим и филогенетическим характеристикам исследуемых микроорганизмов, получившие название много- или полифазной таксономии, позволили упорядочить таксономию и классификацию многих видов микробиоты, в том числе представителей родов Bifidobacterium и Lactobacillus. Новые методологические подходы помогли получить данные о выраженном видовом разнообразии молочно-кислых бактерий, в группу которых входят представители следующих 11 родов: Lactobacillus, Lactococcus, Leuconostoc, Carnobacterium, Enterococcus, Streptococcus, Pediococcus, Tetragenococcus, Vagococcus, Oenococcus, Weissella. Представители родов Bifidobacterium, Aerococcus, Alloicoccus, Atopobium, Dolosignarium, Gemella, Globicatella, Helcococcus, Melissococcus и Saccharococcus из группы молочно-кислых бактерий были исключены. В настоящее время работа над номенклатурой и систематическим положением представителей родов Bifidobacterium и Lactobacillus продолжается; она идет в трех направлениях: описываются новые виды, некоторые реклассифицируются в новые либо в уже существующие виды или даже роды. Молекулярно-генетические походы позволили уточнить и реклассифицировать представителей рода Bifidobacterium, насчитывающего 32 вида, и рода Lactobiculus, включающего 120 видов.
7. К генетическим критериям можно отнести и разработанный отечественными микробиологами при корректировке классификации шигелл подгруппы В (Shigella flexneri) таксономический принцип подразделения сероваров Shigella flexneri на моно- и дилизогенные (подсеровары а и b соответственно). Как было установлено иммунохимическими и генетическими исследованиями, ЛПС О-антигена S. flexneri включает основной компонент (первичные S-специфические цепи — фактор 3,4), контролируемый хромосомой. Все остальные варианты шигелл этого вида возникли в результате модификаций основной структуры (гликозилирования или ацетилирования), контролируемых соответствующими профагами. Основные специфические профаги (I, II, IV, V) ведут себя как аллели, т. е. взаимозамещаемы. Профаги, контролирующие синтез антигенов 6, 7 и 8, включаются по типу, допускающему формирование специфического дилизогенного состояния. Проведенный анализ показал возможность разделения сероваров Shigella flexneri на моно- и дилизогенные.
Предложенная отечественными исследователями классификация шигелл подгуппы В (Shigella flexneri), основанная на данных генетического контроля синтеза их специфических полисахаридных антигенов, была включена в IX издание Руководства Берги (Bergey’s Manual of Systematic Bacteriology, 1984) и утверждена Международным подкомитетом по таксономии Enterobacteriaceae (1986).
Для внутривидовой дифференциации штаммов одного вида микробиологи используют ряд признаков, в том числе специфические биохимические свойства, антигенные особенности, спектр чувствительности к фагам или бактериоцинам, генотип, профиль плазмидной ДНК, электрофоретип, характер вызываемого патологического процесса и т. д.
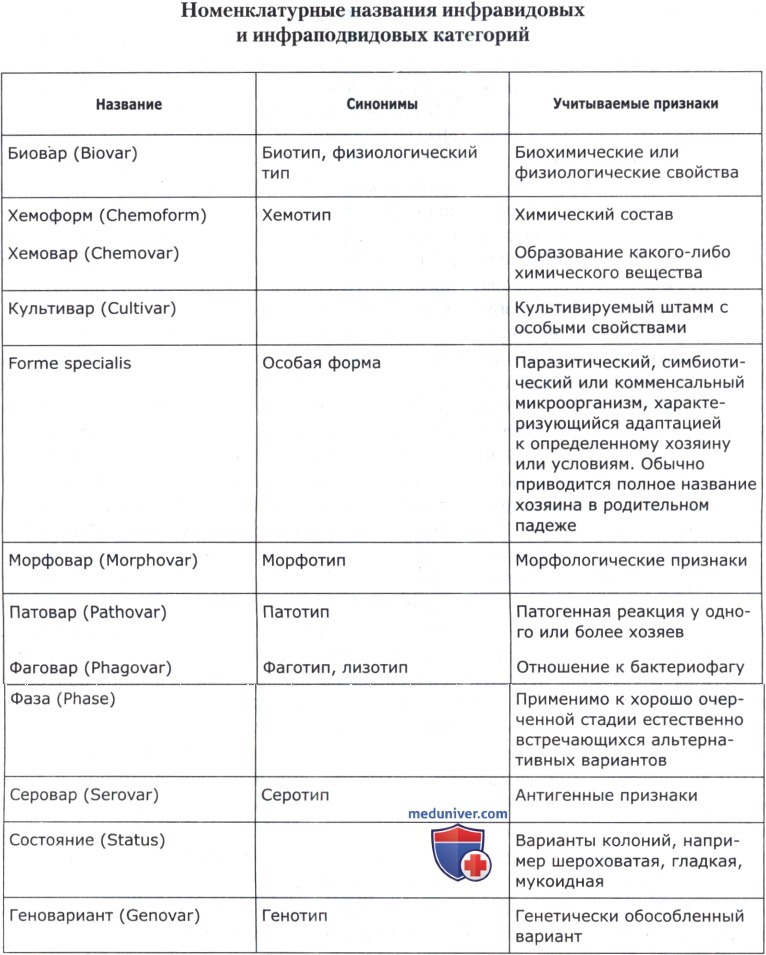
В таблице представлены номенклатурные коды основных инфравидовых и инфраподвидовых категорий — биовар, хемовар, фаговар, серовар, патовар и др.
Следует подчеркнуть, что в таксономии при классификации ряда возбудителей инфекционных заболеваний используется экологический критерий. Это возбудители инфекций только человека — антропонозов, только животных — зоонозов, способные сохраняться и накапливаться во внешней среде и вызывать заболевания — сапронозы и сапрозоонозы.
Известно подразделение патогенных кишечных палочек с учетом патоморфологического характера вызываемого ими инфекционного процесса: УПКП — уропатогенные, ЭПКП — энтеропатогенные, ЭИКП —энтероинвазивные, ЭТКП — энтеротоксигенные, ЭГКП — энтерогеморрагические кишечные палочки, вызывающие урологические и острые кишечные инфекции с характерными для них клиническими симптомами.
Заключая эту статью, хочется еще раз подчеркнуть следующее. Несмотря на то, что современная таксономия микроорганизмов обогатилась новыми принципами дифференциации (генетическими и молекулярно-биологическими), позволяющими отразить в какой-то мере связи между микроорганизмами в эволюционном аспекте, новыми методами и техникой (секвенированием генов, пульс-электрофорезом, геномной дактилоскопией, газожидкостной хроматографией, масс-спектрометрией, компьютерным анализом, разнообразными иммунологическими методами), чтобы сделать правильный вывод при использовании самых современных методов требуется максимально полная фенотипическая характеристика с изучением максимально возможного количества признаков и штаммов. Даже методы геносистематики имеют свои ограничения. Таким образом, суждения о возможности выделения определенных видов и выяснение их систематического положения правомерно делать только при совокупном использовании фенотипических и генетических критериев — полифазной таксономии.
- Читать далее "Связь таксономии микроорганизмов с медицинской микробиологией"
Редактор: Искандер Милевски. Дата публикации: 6.05.2019
