Метилирование генов-супрессоров как причина гемобластозов - опухолей крови
В последнее время все большее значение в возникновении злокачественных новообразований придают нарушению эпигенетической регуляции активности генов. Эпигенетические нарушения не затрагивают самой последовательности нуклеотидов, а связаны в большой степени с изменением метилирования 5'-цитозин-полигуаниновых последовательностей молекулы ДНК («CpG-островки»).
В норме метилирование ДНК играет важную роль в таких биологических процессах, как регуляция экспрессии тканеспецифических генов, клеточная дифференцировка, геномный импринтинг (феномен уникальной памяти блокирования отцовских или материнских генов), инактивация Х-хромосомы, регуляция структуры хроматина, репликация ДНК, латентный период у вирусов, старение клеток и т. д. Единичные CpG-последовательности в геноме эукариот принадлежат эндогенным ретровирусам и транспозонам и практически все метилированы.
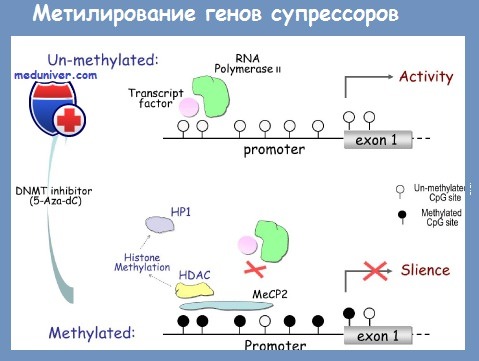
Расположенные же в проксимальных областях промоторов ~ 40—50 % человеческих генов многократно повторяющиеся последовательности, образующие «CpG-островки» протяженностью от 0,5 до нескольких килобаз, защищены от метилирования. Полностью метилированы только «CpG-островки» в промоторах импринтных генов. Гипометилирование CpG-последовательностей в промоторах генов приводит к активации транскрипции, а гиперметилирование — к ее подавлению и, следовательно, снижению экспрессии гена. При злокачественной трансформации наблюдается нарушение равновесия метилирование/деметилирование, что выражается в глобальном деметилировании генома опухолевой клетки и локальном гиперметилировании «CpG-островков», локализованных в промоторных областях генов-супрессоров опухолевого роста.
В лимфоцитах периферической крови здоровых доноров аномальное метилирование генов-супрессоров опухолевого роста практически отсутствует.
Выявление генов, характеризующихся высокой частотой аномального метилирования в опухоли, позволяет использовать эти гены в качестве маркеров начавшегося злокачественного процесса, выявить опухоль на ранней стадии и подобрать адекватное лечение. Снижение экспрессии различных генов как следствие аномального метилирования регуляторных областей может свидетельствовать о преимущественных путях их инактивации, позволяет определить основные и еще не изученные звенья патогенеза опухолей.
Как уже отмечалось, характерными чертами активного хроматина являются гиперацетилирование гистонов и отсутствие 5-метилцитозина, а неактивного — гиперметилирование цитозина и деацетили-рование гистонов. Интересно, что химерный белок PML-RARA индуцирует гиперметилирование генов, влияя на транскрипцию метилтрансфераз. Воздействие ретиноевых кислот вызывает деметилирование генных промоторов, реэкспрессию генов и реверсию трансформированного фенотипа клеток.
Частота метилирования генов при опухолях системы кроветворения значительно отличается от таковой при солидных опухолях. Для гемопоэтических заболеваний характерна инактивация сигнального пути CDK-RB-E2F, скорее всего, в результате метилирования гена р15, задействованного в указанном пути. Уровень метилирования этого ингибитора циклинза-висимых киназ при гемобластозах очень высок, и его инактивация происходит на ранних стадиях развития болезни. Метилирование гена р15 определяется в 60 % В-клеточных и 40 % Т-клеточных лимфом, в 50—80 % случаев ОЛЛ, ОМЛ и бифенотипических лейкозов, несущих на лейкозных клетках маркеры как миелоидного, так и лимфоидного ряда.
Обращает на себя внимание тот факт, что уровень метилирования гена р15 в подгруппе M1 — М2 ОМЛ достоверно выше, чем в подгруппе М3—М4.
Метилирование другого представителя ингибиторов циклинзависимых киназ, гена р16, столь характерное для большинства солидных опухолей, достаточно редко наблюдается при острых лейкозах. Ген метилирован в лимфоцитах периферической крови только у 1—6 % взрослых больных ОЛЛ. Однако частота метилирования гена р16 в образцах костного мозга значительно выше: так, при исследовании образцов костного мозга аномальное метилирование данного гена выявляют у 16—30 % больных ОМЛ.
В опухолях разных типов характер метилирования генов, вовлеченных в регуляцию клеточного цикла и канцерогенез, различен. Для характеристики профиля метилирования генов было введено гипотетическое понятие «метилотип». «Метилотип» опухолей определенного гистологического типа включает гены, характеризующиеся повышенной частотой метилирования при данной патологии.
По данным разных групп исследователей, так называемый метилотип гемобластозов выглядит следующим образом: р15 (31-62%), CDH1 (40%), ТР73 (31%), ER (16-47%), MDR1 (24%), MYF (20%), RB (17%) и HIC1 (11%). Кроме различий в уровне метилирования, обращает на себя внимание тот факт, что ряд генов (ТР73, MDR1, MYF3) в солидных опухолях не метилируется, в то время как ген HIC1 метилирован в 80—100 % солидных образований.
При изучении метилирования очень важно учитывать стадию заболевания, при которой происходит забор образцов, и подробную морфологическую характеристику опухолевого материала. Показано, что уровень метилирования ряда генов в образцах ДНК крови и костного мозга, полученных от больных в период ремиссии, значительно ниже, чем в образцах, взятых в стадии рецидива. Так, метилирование р15 в образцах костного мозга больных ОЛЛ в стадии ремиссии составило 11,3 %, а в стадии рецидива — 60 %. При ОЛЛ у взрослых и детей гиперметилирование гена CALCA ассоциировано с высоким риском развития рецидива и высокой смертностью.
При изучении связи между клиническими проявлениями заболевания и эпигенетическими изменениями J. P. Issa и соавт. выявили высокий уровень метилирования гена-супрессора HIC1 (hypermetilated in cancer) в образцах крови больных ХМЛ при бластном кризе и пришли к выводу, что метилирование HIC1 происходит во время прогрессирования заболевания. Установлено также, что повышенная экспрессия гена MDR1 является одной из основных причин устойчивости к химиотерапии гемопоэтических злокачественных новообразований и ассоциирована с их прогрессией. Метилирование гена MDR1 вызывает уменьшение продукции белка и, следовательно, может служить маркером благоприятного прогноза при опухолях данного типа.
Таким образом, определение частоты метилирования генов-супрессоров является важным звеном при характеристике различных типов злокачественных опухолей системы кроветворения и позволяет использовать этот феномен в качестве диагностического и прогностического маркера.
В заключение хотелось бы подчеркнуть, что, несмотря на безусловную важность онкосупрессоров, участвующих в регуляции клеточного цикла, при изучении гемобластозов имеют значение и исследования таких генов, как WT1, NF1, PML, а также поиск потенциальных антионкогенов, нарушения в которых ассоциированы с развитием конкретных типов гемопоэтических заболеваний. Следует учитывать, что гемопоэтические предшественники и стволовые клетки — очень хорошая модель для экспериментального исследования генов-супрессоров в клинике, так как эти клетки легко получить, они хорошо размножаются и генетически модифицируются in vitro, а затем могут быть реинъецированы, в связи с чем служат наилучшей мишенью для индивидуальной химио- и генотерапии.
- Читать "Теломераза - синтез, функции"
Оглавление темы "Онкогенез":- Метилирование генов-супрессоров как причина гемобластозов - опухолей крови
- Теломераза - синтез, функции
- Теломера - молекулярная структура
- Что такое теломерный эффект положения?
- Альтернативные способы удлинения теломер у человека - иммортализация
- Значение теломеразы в диагностике опухолей
- Методы лечения рака влиянием на теломеры и теломеразу
- Теломеризация клеток - не ведет к злокачественной трансформации
- Адгезия клеток - последствия нарушения адгезивных взаимодействий
- Актиновые микрофиламенты - структура, функции
