Строение молекулы иммуноглобулина
Иммуноглобулины представляют собой семейство структурно сходных белков (гликопротеинов), обладающих свойствами антител.
По современным представлениям, в основе строения молекулы иммуноглобулина лежит симметричная четырехцепочечная структура, состоящая из двух вариантов полипептидных цепей. Две более длинные цепи получили название тяжелых, или Н-цепей (от англ. heavy), а более короткие — легких, или L-цепей (от англ. light). Молекулярная масса Н-цепей составляет 50 000-77 000 Д, а легких - 22 000-25 000 Д.
Стабильность молекулы поддерживается как за счет дисульфидных мостиков, связывающих Н-цепи друг с другом и с L-цепями, так и с помощью нековалентных взаимодействий. Каждая L-цепь связана с амино(N)-концевой частью одной из Н-цепей. Таким образом, вся молекула имеет Y-образную форму.
Воздействием протеолитического фермента папаина молекулу иммуноглобулина в точке соединения ветвей можно расщепить на три фрагмента. Два из них, структурно идентичные, содержат L-цепь и аминоконцевую половину Н-цепи, а третий состоит из карбокси(С)-концевых половин Н-цепей. При исследовании их функции оказалось, что два идентичных фрагмента, содержащие L-цепи, связывают комплементарный антиген, поэтому они получили название Fab-фрагментов (от англ. fragment antigen binding — фрагмент, связывающий антиген).
Третий фрагмент, не обладающий способностью реагировать с антигеном, легко может быть получен в кристаллической форме и поэтому был назван Fc-фрагментом (от англ. fragment crystallizable — фрагмент кристаллизуемый). В дальнейшем было установлено, что именно он отвечает за выполнение так называемых эффекторных функций иммуноглобулина, т. е. за взаимодействие с другими молекулами и клетками собственного организма в процессе реализации иммунного ответа. Таким образом, структура антител отражает их двойственную биологическую роль: с одной стороны, они обеспечивают распознавание и связывание чужеродного материала, с другой — участвуют в реализации механизмов его инактивации и элиминации из организма.
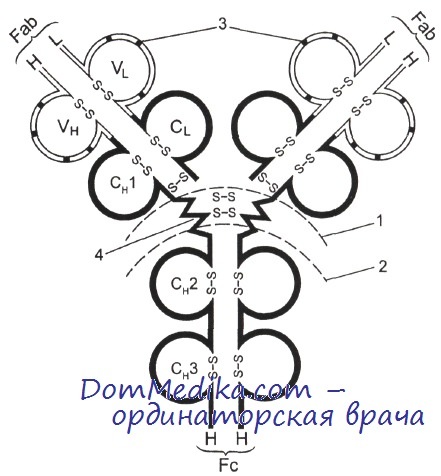
1 — место расщепления папаином; 2 — место расщепления пепсином; 3 — гипервариабельные участки V-доменов; 4 — шарнир.
Анализ структуры различных моноклональных иммуноглобулинов позволил выявить в N-концевой части Н- и L-цепей (район Fab-фрагмента) участок, из 100—110 аминокислотных остатков, высоковариабельный по аминокислотному составу, тогда как структура остальной части цепей обоих типов отличается относительной консервативностью. Участок с высокой степенью изменчивости получил название вариабельной области, или V-области (от англ. variable). Остальная часть белковых цепей иммуноглобулинов была названа константной, или С-областью (от англ. constant).
При исследовании полипептидных цепей иммуноглобулинов с помощью рентгеноструктурного анализа оказалось, что они организованы определенным образом и имеют своеобразную пространственную структуру. Внутрицепочечные дисульфидные мостики замыкают петли из 60—70 аминокислотных остатков. Участки цепей, входящие в состав петель, сложены с помощью специфичной для иммуноглобулинов укладки в компактные глобулярные структуры — домены, соединенные не столь плотно упакованными участками полипептидной цепи. L-цепи имеют два домена — вариабельный (VL) и константный (CL), а Н-цепи — один вариабельный (VH) и три (иногда четыре) константных (Сн1, Сн2 и т. д.).
Участки цепей, входящие в константные домены, характеризуются высокой степенью гомологии (сходной последовательностью аминокислотных остатков).
У большинства иммуноглобулинов между доменами Сн1 и Сн2 находится участок полипептидной цепи, обогащенный остатками пролина и не имеющий упорядоченной пространственной структуры. От этого участка зависит подвижность Fab- и Fc-фрагментов относительно друг друга, поэтому он носит название шарнира. Такое изменение трехмерной конформации молекулы необходимо для реакции с поливалентными антигенами, особенно корпускулярными. Шарнир наиболее чувствителен к воздействию протеолитических ферментов. Кроме того, именно в области шарнира Н-цепи связаны друг с другом ковалентно, через дисульфидные связи.
Рентгеноструктурными исследованиями показано, что Сн2-домены соседних Н-цепей не контактируют между собой, поскольку в пространстве между ними расположены разветвленные олигосахариды, которые обеспечивают гидратацию междоменного пространства. Вместе с тем существует латеральное нековалентное взаимодействие между Сн3-доменами и тесный контакт Н-цепей в районе шарнира за счет дисульфидных связей. Тем самым в Fc-участке молекулы создается кольцо, замкнутое с N- и С-конца Сн2-доменов.
Формируемый таким образом напряженный характер структуры имеет большое значение для обеспечения возможности передачи сигнала из N-концевой части молекулы, где расположен активный центр, в С-концевую половину, в пределах которой находятся области, ответственные за реализацию эффекторных функций иммуноглобулинов.
- Читать "Структурное разнообразие иммуноглобулинов"
Оглавление темы "Гематология":- Технологии получения дендритных клеток для создания вакцин
- Выбор антигена-мишени и введение его в дендритные клетки
- Способ введения вакцины дендритных клеток и их эффективность
- Результаты клинических испытаний вакцин на основе дендритных клеток
- Проблемы и дальнейшие перспективы использования дендритных клеток для иммунотерапии
- Строение молекулы иммуноглобулина
- Структурное разнообразие иммуноглобулинов
- Биосинтез иммуноглобулинов
- Генетика иммуноглобулинов - локализация генов
- Цитокины - рецепторы, функции
