Связь нейромедиаторных систем и поведения
Когда исследователи начали изучать синаптическую передачу, они предположили, что все терминали каждого отдельного нейрона используют один и тот же нейромедиатор. Современные методы анализа позволили доказать несостоятельность этой гипотезы. Нейрон может использовать один нейромедиатор в одном синапсе и другой нейромедиатор в другом синапсе.
Более того, в одной терминали или одном синапсе могут одновременно находиться разные нейромедиаторы. Было установлено, что нейропептиды могут сосуществовать с низкомолекулярными нейромедиаторами внутри одной терминали и что в отдельном синапсе может присутствовать более одного низкомолекулярного нейромедиатора. В ряде случаев внутри одного синаптического пузырька находится несколько нейромедиаторов.
Все эти открытия говорят в пользу существования множества комбинаций нейромедиаторов и их рецепторов. Они также говорят об отсутствии простой причинно-следственной связи между нейромедиатором и поведением. Каково функциональное значение всех этих комбинаций? Ответ на этот вопрос, скорее всего, будет зависеть от регулируемой формы поведения.
Традиционно исследователи концентрировались па нейромедиаторе, преобладавшем в отдельной терминали аксона, и пытались найти связь между нейромедиатором и определенной функцией или формой поведения.
В настоящей статье на сайте мы рассмотрим три отдела периферической нервной системы — СНС, ВНС и ЭНС. Затем мы рассмотрим процесс синаптической передачи в центральной нервной системе.
а) Синаптическая передача в соматической нервной системе (СНС). Аксоны мотонейронов головного и спинного мозга иннервируют скелетные мышцы, в том числе мышцы глаз и лица, туловища, конечностей, пальцев рук и ног. Без этих нейронов СНС выполнение движения было бы невозможным. Мотонейроны также называют холинергическими нейронами, поскольку их основным нейромедиатором является ацетилхолин. Холинергические нейроны обеспечивают возбуждение скелетных мышц, вызывая их сокращение.
Поскольку СНС использует один главный нейромедиатор, в ней присутствует один основной рецептор — лигандзависимый ионный канал, называемый никотиновым ацетилхолиновым рецептором (nAChr). Как показано на рис. 1, при связывании ацетилхолина с рецептором пора открывается, обеспечивая поток ионов и вызывая деполяризацию мышечного волокна. Пора никотинового рецептора достаточно велика, чтобы обеспечить одновременный отток ионов К+ и приток ионов Na+.
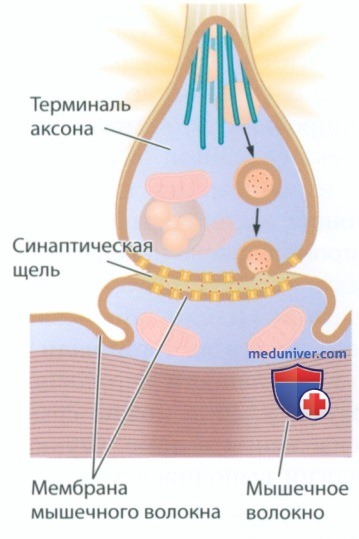
Молекулярная структура содержащегося в табаке никотина позволяет ему активировать никотиновый ацетилхолиновый рецептор вместо ацетилхолина — именно поэтому рецептор был назван никотиновым. По своей молекулярной структуре и действию никотин очень похож на ацетилхолин, поэтому он способен взаимодействовать с сайтом связывания ацетилхолинового рецептора.
Ацетилхолин представляет собой основной нейромедиатор скелетных мышц, однако помимо ацетилхолина в терминалях аксонов холинергических нейронов образуются и другие нейромедиаторы, которые выделяются в мышцу вместе с ацетилхолином. Одним из таких нейромедиаторов является кальцитонин-ген-связанный пептид (CGRP), который воздействует на метаботропные CGRP-рецепторы, увеличивая силу мышечных сокращений.
б) Две системы регуляции вегетативной нервной системы (ВНС). Дополняющие друг друга отделы ВНС — симпатический и парасимпатический — регулируют внутреннюю среду организма. Симпатический отдел мобилизует организм, обеспечивая реакцию «бей-или-беги». Пульс становится чаще, а пищеварение замедляется. Парасимпатический отдел отвечает за расслабление и реакцию «отдохни-и-перевари». Пищеварение активируется, а пульс снижается, готовя тело к отдыху.
На рисунке 2 представлена нейрохимическая организация ВНС. Работу обоих отделов ВНС контролируют ацетилхолиновые нейроны, которые отходят от ЦНС в области спинного мозга. Нейроны ЦНС образуют синаптические соединения с нейронами парасимпатического отдела, также содержащими ацетилхолин, и нейронами симпатического отдела, содержащими норадреналин. Другими словами, холинергические нейроны ЦНС образуют синаптические соединения с норадреналинергическими нейронами симпатического отдела, чтобы привести внутренние органы в состояние «бей-или-беги».
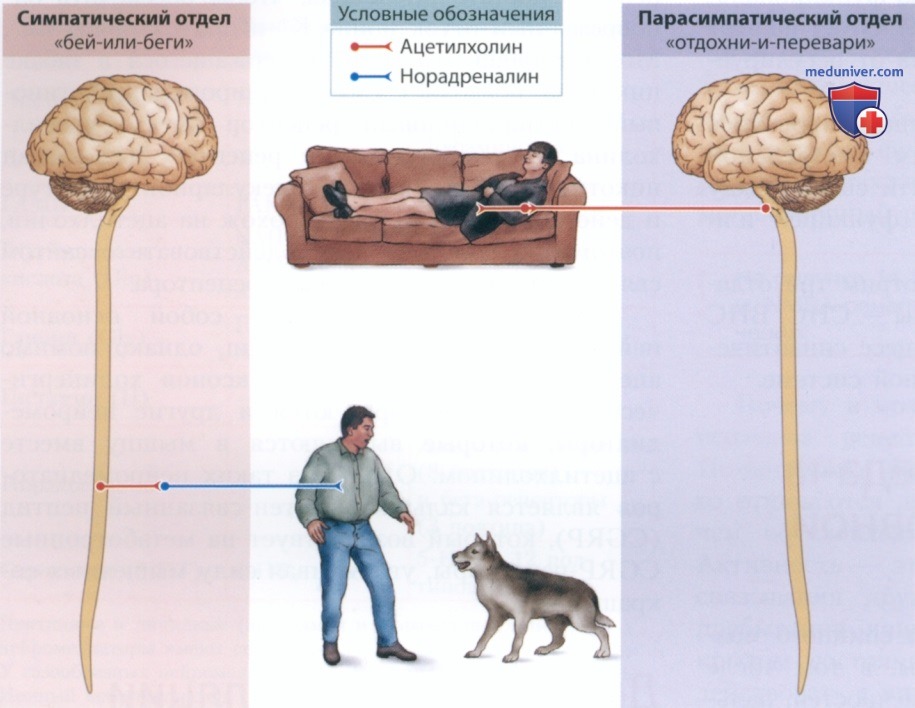
Холинергические нейроны ЦНС образуют синаптические соединения с ацетилхолиновыми нейронами парасимпатического отдела, чтобы привести внутренние органы в состояние «отдохни-и-перевари».
Будет ли синапс возбуждающим или тормозным, зависит от находящихся в определенном органе рецепторов. При возбуждении симпатического отдела норадреналин увеличивает частоту сердечных сокращений и замедляет пищеварение, поскольку рецепторы норадреналина в сердце являются возбуждающими, а рецепторы норадреналина в пищеварительном тракте — тормозными. Точно так же ацетилхолин снижает частоту сердечных сокращений и активирует пищеварение, поскольку ацетилхолиновые рецепторы сердца, напротив, являются тормозными, а ацетилхолиновые рецепторы пищеварительного тракта — возбуждающими.
Активность нейромедиатора, возбуждающая в одном отделе и тормозная в другом, опосредует симпатические и парасимпатические функции, формирует взаимодополняющие системы регуляции, которые обеспечивают поддержание гомеостаза в меняющихся условиях среды.
в) Автономия энтеральной нервной системы (ЭНС). ЭНС может функционировать, не получая сигналов из ЦНС, — именно поэтому ее называют вторым мозгом. Она использует нейромедиаторы всех основных групп — всего более 30 нейромедиаторов. Большинство нейромедиаторов ЭНС идентичны задействованным в ЦНС. Наиболее распространенными в ЭНС низкомолекулярными нейромедиаторами являются серотонин и дофамин.
Чувствительные нейроны ЭНС улавливают механические и химические стимулы в пищеварительном тракте. Через мышцы кишечника мотонейроны ЭНС контролируют перемешивание содержимого кишечника. ЭНС также регулирует секрецию пищеварительных ферментов.
г) Четыре системы регуляции центральной нервной системы. Нейрохимические системы существуют как в ПНС, так и в ЦНС. Эти системы у разных видов животных удивительно похожи, что позволило сначала идентифицировать их в мозге крысы, а затем в мозге человека (Hamilton et al., 2010).
В каждой из описанных в настоящем разделе систем регуляции аксоны сравнительно небольшого числа нейронов, расположенных в одном или нескольких ядрах ствола мозга, соединяются с различными отделами ЦНС — это позволяет предположить, что эти ядра и их терминали обеспечивают синхронизацию активности в головном и спинном мозге. Систему регуляции можно сравнить с системой электроснабжения в доме. Функцию источника электроэнергии выполняет электрощиток, от которого провода тянутся в каждую комнату.
Как и в ВНС, действие нейромедиатора в ЦНС зависит от иннервируемой области мозга и типа рецептора, с которым нейромедиатор взаимодействует в этой области. Точно так же действие электричества в каждой комнате зависит от установленных в ней электрических устройств.
Принцип 7. Все отделы нервной системы содержат структуры с сенсорными и двигательными функциями.
Каждый из четырех низкомолекулярных нейромедиаторов действует в пределах отдельной системы регуляции холинергической, дофаминергической, норадренергической или серотонинергической. На рисунке 3 представлены схемы расположения ядер, принадлежащих к каждой из указанных систем. Древко стрелки демонстрирует направление аксона, а кончик стрелки показывает расположение терминали аксона.
Как показано на рис. 3, каждая система регуляции ЦНС связана со множеством форм поведения. Связи между системами регуляции, поведением и заболеваниями мозга неочевидны, они по-прежнему являются предметом активного изучения. Установить связи между системами регуляции, поведением и заболеваниями сложно, поскольку аксоны указанных систем проецируются практически на все отделы головного и спинного мозга. По-видимому, они одновременно выполняют специфические функции и играют некую роль в модуляции нервной системы. Ниже мы расскажем о научно доказанных связях между системами регуляции, поведением и заболеваниями.
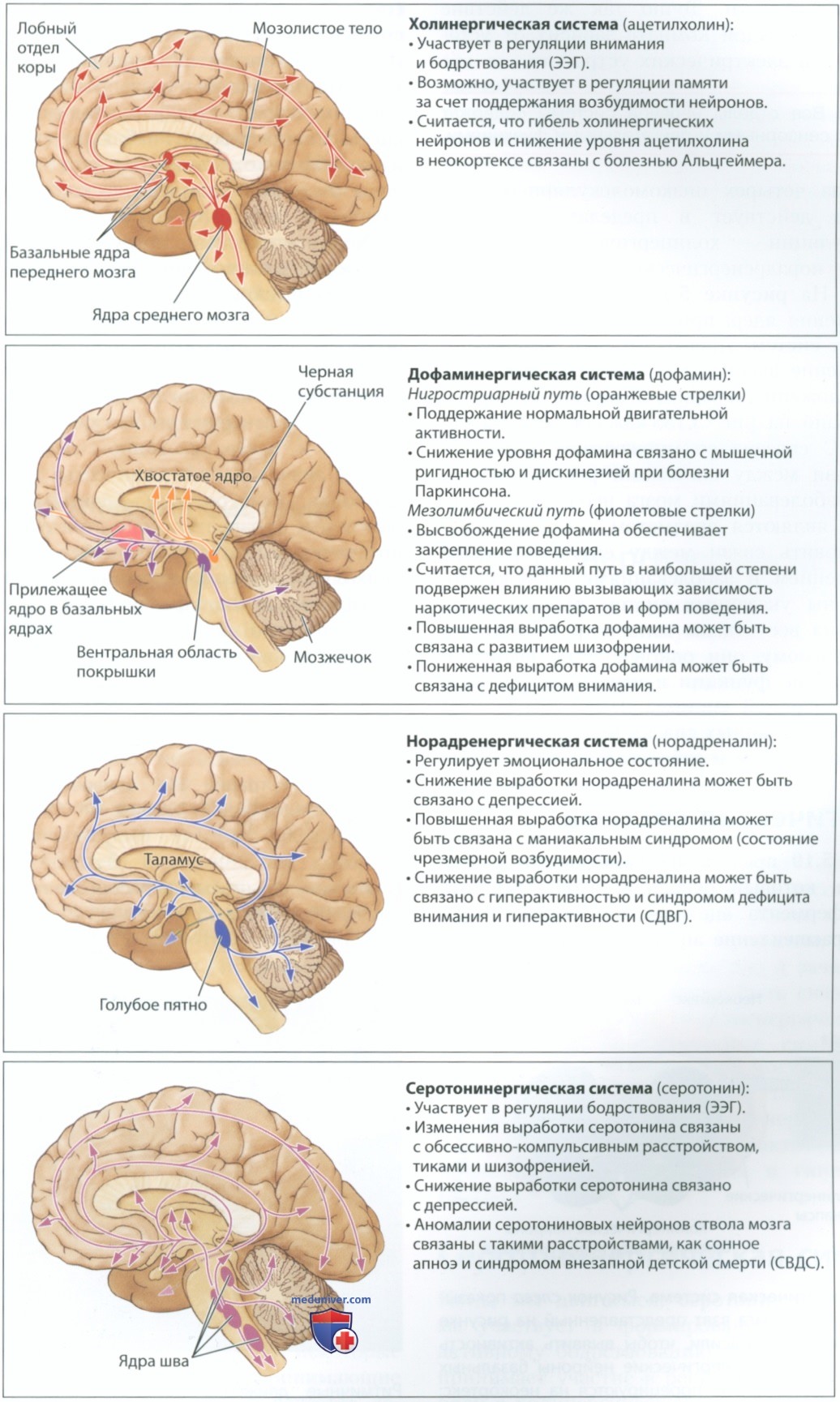
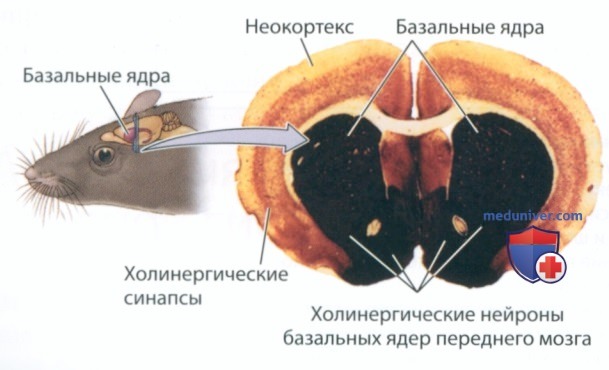
1. Холинергическая система. На рисунке 4 представлен поперечный разрез мозга крысы, который окрасили, чтобы выявить активность фермента ацетилхолинэстеразы, отвечающего за расщепление ацетилхолина в синапсах. Темные участки соответствуют высокой концентрации ацетилхолинэстеразы, которая говорит о присутствии холинергических терминалей. Ацетилхолинэстераза проникает в кору больших полушарий, а особенно высокая концентрация ацетилхолинэстеразы наблюдается в базальных ядрах. Многие холинергические синапсы образованы аксонами холинергических нейронов ствола мозга (см. рис. 3, вверху).
Холинергическая система участвует в регуляции бодрствования, внимания и памяти. Например, холинергические нейроны участвуют в формировании ритма ЭЭГ, соответствующего активному бодрствованию. Патоморфологическое исследование образцов пациентов, умерших от болезни Альцгеймера, которая начинается с небольшой забывчивости и приводит к тяжелому расстройству памяти и генерализованной деменции, выявило утрату значительного количества холинергических нейронов.
При болезни Альцгеймера применяют различные терапевтические стратегии — используют препараты, которые ингибируют фермент ацетилхолинэстеразу, обеспечивая повышение уровня ацетилхолина, или препараты, которые увеличивают количество никотиновых рецепторов (Anand et al., 2017). Напомним, что ацетилхолин синтезируется из поступающих с пищей веществ. Роль диеты в регуляции уровня ацетилхолина находится на стадии изучения.
Связанные с болезнью Альцгеймера аномалии мозга не ограничиваются нарушениями функции холинергических нейронов. Посмертные патологоанатомические исследования выявили обширное поражение неокортекса и других отделов головного мозга, поэтому пока не ясно, какую роль в развитии заболевания могут играть холинергические нейроны. Возможно, их разрушение вызывает дегенерацию коры больших полушарий. Возможна и обратная причинно-следственная связь — дегенерация коры больших полушарий может приводить к гибели холинергических клеток.
Следовательно, потеря холинергических нейронов — лишь один из множества симптомов болезни Альцгеймера. Вот почему предотвращающие гибель клеток лекарственные препараты также применяют для замедления прогрессирования указанного заболевания (Anand et al., 2017).
2. Дофаминергическая система. На рисунке 2 представлены схемы двух различных дофаминергических нервных путей. Нигро-стриарный дофаминергический путь играет ключевую роль в координации движений. В посвященных болезни Паркинсона разделах этой главы мы уже писали о том, что гибель дофаминергических нейронов черной субстанции приводит к мышечной ригидности. Мышцы-агонисты и антагонисты сокращаются одновременно, не позволяя больному свободно двигаться.
У пациентов с болезнью Паркинсона также наблюдается ритмический тремор, прежде всего тремор конечностей, возникновение которого свидетельствует о высвобождении подавленного движения. Хотя причины развития болезни Паркинсона не до конца понятны, известно, что к ее появлению может привести употребление ряда токсичных наркотических препаратов — об этом можно прочитать ниже. Такие наркотические препараты могут действовать как селективные нейротоксины, которые убивают дофаминергические нейроны черной субстанции.
Дофамин мезолимбического пути может быть нейромедиатором, наиболее зависимым от еды, наркотических веществ и других форм поведения, предполагающих потерю контроля над импульсивным поведением. Общей чертой всех форм зависимого поведения является усиление ответа на внешний стимул при стимуляции мезолимбического дофаминергического пути, которое делает этот стимул еще более привлекательным. Действительно, некоторые пациенты с болезнью Паркинсона, принимающие агонисты дофаминовых рецепторов в качестве лекарств, демонстрируют потерю контроля над импульсами, которая проявляется в таком поведении, как увлечение азартными играми, гиперсексуальность и компульсивные покупки (Moore et al., 2014).
Ученые предполагают, что чрезмерная активность мезолимбической дофаминергической системы может играть определенную роль в развитии шизофрении — психического расстройства, сопровождающегося бредом, галлюцинациями, нарушениями речи, эмоциональной тупостью, возбуждением или неподвижностью, а также множеством других симптомов. Шизофрения является самым распространенным и наиболее тяжелым инвалидизирующим психическим заболеванием, которое встречается примерно у одного из 100 человек.
3. Норадренергическая система. Норадреналин (норэпинефрин) может участвовать в обучении, стимулируя нейроны и заставляя их менять свою структуру. Норадреналин также может способствовать развитию здорового мозга и участвовать в производстве движений. Нейроны, которые используют норадреналин в качестве нейромедиатора, называют норадренергическими.
Формы поведения и расстройства, имеющие отношение к норадренергической системе, затрагивают эмоциональную сферу. Некоторые симптомы депрессии, или большого депрессивного расстройства, — аффективного расстройства, сопровождающегося чувством вины и самоуничижением, проблемами с аппетитом, нарушением сна, общей заторможенностью и зачастую суицидальными мыслями, могут быть связаны со снижением активности норадренергических нейронов. И наоборот, некоторые симптомы мании (чрезмерной возбудимости) могут быть связаны с повышенной активностью тех же нейронов. Снижение активности норадренергических нейронов также связывают с гиперактивностью и синдромом дефицита внимания и гиперактивности (СДВГ).
4. Серотонинергическая система. Когда мы двигаемся, серотонинергическая система участвует в формировании соответствующего активному бодрствованию ритма ЭЭГ, то есть она принимает участие в регуляции бодрствования наряду с холинергической системой. Как и норадреналин, серотонин играет определенную роль в обучении — об этом можно прочитать в отдельной статье на сайте - просим пользоваться формой поиска выше. Некоторые симптомы депрессии могут быть связаны со снижением активности серотонинергических нейронов, а препараты, обычно используемые для лечения депрессии, воздействуют на серотониновые рецепторы.
Следовательно, возможно существование двух форм депрессии — одна из них может быть связана с норадреналином, а другая с серотонином.
Аналогичным образом результаты некоторых исследований указывают на то, что различные симптомы шизофрении могут быть связаны с повышенной активностью серотонинергических нейронов. Это значит, что могут существовать разные формы шизофрении. Снижение активности серотонинергической системы связывают с симптомами обсессивно-компульсивного расстройства (ОКР), для которого характерно присутствие повторяющихся нежелательных мыслей (обсессий) и повторяющегося навязчивого поведения (например, навязчивого мытья рук). Некоторые данные также говорят о связи между аномалиями серотонинергических ядер и таких состояний, как сонное апноэ и синдром внезапной детской смерти (СВДС).
д) Клинические аспекты. Случай застывшего наркомана. «Пациент 1. В начале июля 1982 г. 42-летний мужчина в течение 4 дней употребил 4,5 г «нового синтетического героина»... он вводил его внутривенно три или четыре раза в день... Эффект вещества отличался от героинового, вызывая необычный «космический» кайф, а также временные визуальные искажения и галлюцинации». (Ballard et al., 1985, р. 949.)
Пациент 1 был одним из семи молодых людей, госпитализированных в течение одного и того же периода в Калифорнии. У всех молодых людей были симптомы болезни Паркинсона, которые появились вскоре после внутривенного введения наркотика. Очнувшись, они обнаружили, что «заморожены» — они могли двигаться только как в замедленной съемке. По словам Пациента 1, ему приходилось обдумывать каждое движение. В описании своего состояния Пациент использовал слова «застывший», «медленный», «немой», «кататонический». Такие симптомы крайне необычны для людей этой возрастной группы. Стало известно, что все пострадавшие употребляли синтетический героин, который купили на улице летом 1982 г.
Дж. Уильям Лэнгстон (J. William Langston, 2008) и его коллеги установили, что «синтетический героин» содержал примесь (1-метил-4-фенил-1,2,3,6-тетрагидропиридина (МФТП), появившегося из-за нарушения технологии синтеза наркотика. Эксперименты на грызунах показали, что МФТП сам по себе не способен вызывать симптомы болезни Паркинсона, однако в организме он метаболизируется в нейротоксин (1-метил-4-фенилпиридиний (МФП+).
Вскрытие пациента, предположительно, умершего от отравления МФТП, выявило гибель дофаминергических нейронов черной субстанции. Остальные области мозга выглядели здоровыми. Введение МФТП обезьянам, крысам и мышам приводило к появлению схожих симптомов и к гибели дофаминергических нейронов черной субстанции. Таким образом, клинические и экспериментальные данные показывают, что токсин может избирательно уничтожать дофаминергические нейроны и что гибель таких нейронов может вызывать болезнь Паркинсона.
В 1988 г. Пациент 1 прошел экспериментальный курс лечения в Университетской клинике в Лунде (Швеция). Живые дофаминергические нейроны из мозга зародыша человека были пересажены в хвостатое ядро и скорлупу (Widner et al., 1992). Широкомасштабные исследования на грызунах и низших приматах, проведенные в ряде лабораторий, показали, что зародышевые нейроны, которые еще не отрастили аксоны и дендриты, способны пережить трансплантацию, созреть и начать вырабатывать нейромедиатор.
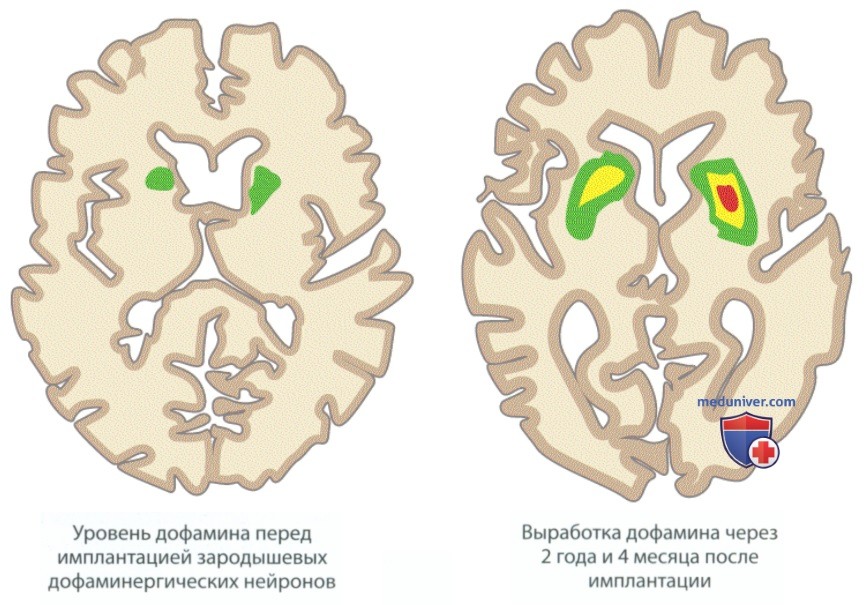
У Пациента 1 не было серьезных послеоперационных осложнений. Через 24 мес. после операции его состояние значительно улучшилось. Он мог самостоятельно одеваться и принимать пищу, хотя для посещения ванной ему требовалась помощь. Кроме того, он мог гулять вокруг дома. Он стал более восприимчив к медикаментозному лечению. Приведенный ниже рисунок демонстрирует различия в уровне дофамина в мозге пациента с болезнью Паркинсона до имплантации (слева) и через 2 года и 4 мес. после имплантации (справа).
Трансплантация зародышевых нейронов пациентам с болезнью Паркинсона обычно не дает эффекта. В случаях, отличных от случая застывшего наркомана, болезнь Паркинсона связана с непрерывным процессом разрушения дофаминергических нейронов (в том числе имплантированных) в черной субстанции. Поскольку болезнь Паркинсона поражает примерно 20 человек из 100 000, ученые продолжают эксперименты по поиску новых подходов к трансплантации и способов генетической модификации оставшихся в живых дофаминергических нейронов (Lane et al., 2010).
е) Контрольные вопросы. Прежде чем продолжить, проверьте себя.
1. Хотя нейроны могут содержать более одного ___________ , их обычно идентифицируют по основному ___________ , преобладающему в отдельной терминали аксона.
2. В соматической нервной системе основным нейромедиатором скелетных мышц является ___________ ; в вегетативной нервной системе ___________ нейроны спинного мозга образуют синаптические соединения с ___________ нейронами парасимпатического отдела и ___________ нейронами симпатического отдела.
3. Основные низкомолекулярные нейромедиаторы энтеральной нервной системы (ЭНС) — это ___________ и ___________ .
4. Четыре основные системы регуляции ЦНС -это ___________ , ___________ , ___________ и ___________ .
5. Как вы можете прокомментировать утверждение, что поведение обусловлено исключительно химическим дисбалансом в мозге?
ж) Ответы на вопросы для самоконтроля:
1. Нейромедиатора; нейромедиатору:
2. Ацетилхолин (АСh); ацетилхолиновые; норадренергическими; ацетилхолиновые.
3. В любом порядке: серотонин (5-НТ); дофамин.
4. В любом порядке: холинергическая; дофаминергическая; норадренергическая; серотонинергическая.
5. Данная идея остается популярной на протяжении длительного времени благодаря очевидной связи между снижением выработки дофамина в черной субстанции и болезнью Паркинсона, а также благодаря связи ацетилхолина и норадреналина с соматическими и вегетативными реакциями. Однако для других нейромедиаторных систем мозга проследить такую связь с поведением оказалось не так просто.
- Читать далее "Роль синапсов в обучении и памяти"
Редактор: Искандер Милевски. Дата публикации: 19.7.2023
