Нейромедиаторы и их рецепторы
После того как в 1921 г. Отто Леви установил, что с помощью возбуждающих и тормозящих химических веществ можно контролировать сердечный ритм, многие исследователи утверждали, что в мозге должна действовать аналогичная система двойного контроля. Они пришли к выводу, что норадреналин и ацетилхолин — это нейромедиаторы, которые опосредуют работу возбуждающих и тормозных клеток мозга.
Они не могли себе представить все то, что нам известно сейчас — то, что человеческий мозг задействует огромное количество нейромедиаторов и рецепторов. Нейромедиаторы еще более универсальны — например, они могут обеспечивать возбуждение в одном месте и торможение в другом. Два или более нейромедиаторов могут объединяться в одном синапсе, потенцируя действие друг друга. Кроме того, каждый нейромедиатор способен взаимодействовать с различными рецепторами, которые выполняют разные функции.
В этой статье мы расскажем о том, как идентифицируют и классифицируют нейромедиаторы в соответствии с их химической структурой. Функциональные аспекты нейромедиаторов взаимосвязаны и чрезвычайно сложны — невозможно проследить связь между отдельным нейромедиатором и определенной формой поведения. Разнообразие рецепторов возникает благодаря уникальным комбинациям белковых молекул, которые объединяются, образуя функциональный рецептор.
а) Критерии отнесения к нейромедиаторам. Какие именно из тысяч присутствующих в нервной системе химических веществ являются нейромедиаторами?
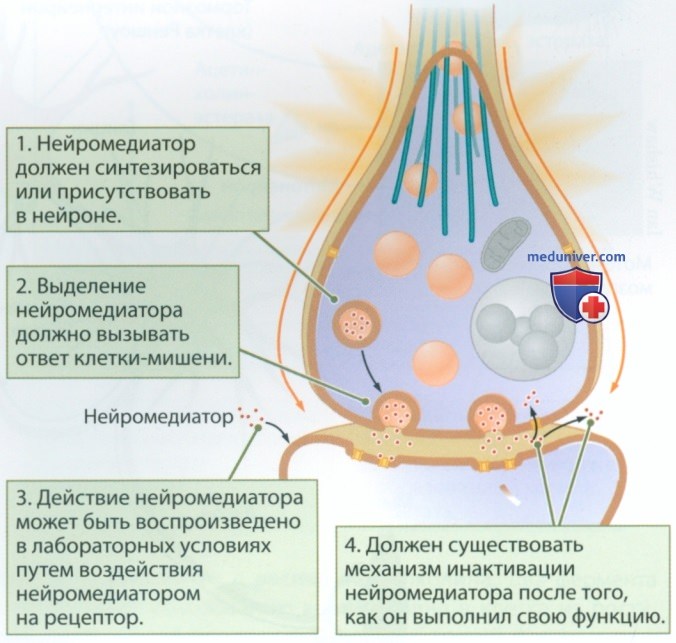
На рисунке 1 представлены четыре критерия отнесения вещества к нейромедиаторам:
1. Нейромедиатор должен синтезироваться или как-либо иначе присутствовать в нейроне.
2. Когда нейрон активен, он должен выделять нейромедиатор, вызывающий ответ определенной мишени.
3. Такой ответ может быть воспроизведен в лабораторных условиях путем воздействия нейромедиатором на мишень.
4. Должен существовать механизм инактивации нейромедиатора после того, как он выполнил свою функцию.
Эти критерии легко применимы к соматической нервной системе, в особенности к нервно-мышечному соединению с одним основным нейромедиатором — ацетилхолином. Однако идентифицировать нейромедиаторы в ЦНС не так просто. В головном и спинном мозге каждый нейрон образует тысячи синапсов, что затрудняет исследование отдельных синапсов и их активности. Поэтому для идентификации веществ, которые могут быть нейромедиаторами в ЦНС, применяют различные методы, в том числе окрашивание, стимуляцию и выделение.
Сомнительное химическое вещество, соответствие которого критериям нейромедиатора не доказано, называют предполагаемым нейромедиатором.
Пытаясь идентифицировать новый нейромедиатор ЦНС, исследователи могут использовать микроэлектроды для стимуляции и регистрации ответа отдельных нейронов. Малый размер стеклянного микроэлектрода позволяет установить его на специфическую нейронную мишень. Его можно заполнить исследуемым веществом. При пропускании электрического тока через электрод химическое вещество будет попадать внутрь или на поверхность нейрона, имитируя процесс выделения нейромедиатора.
Существует множество методов окрашивания, позволяющих идентифицировать специфические химические вещества в клетке. Кроме того, были разработаны методы поддержания жизнедеятельности тканей нервной системы в физиологическом растворе во время экспериментов, направленных на исследование коммуникации нейронов. Применение таких срезов живой ткани облегчает проведение исследований, позволяя ученым наблюдать за подвергаемым стимуляции или используемым для регистрации сигнала нейроном с помощью микроскопа.
Ацетилхолин не только был первым веществом, которое признали нейромедиатором, но также первым нейромедиатором ЦНС, который удалось идентифицировать. Логический аргумент, предсказавший его существование еще до того, как были собраны экспериментальные доказательства, значительно облегчил этот процесс. Все аксоны мотонейронов, отходящие от спинного мозга, используют ацетилхолин в качестве нейромедиатора. У каждого аксона есть коллатераль в спинном мозге, которая образует синаптическое соединение со вставочным нейроном ЦНС.
Вставочный нейрон (клетки Реншоу, названные в честь открывшего их ученого), в свою очередь, образует синаптическое соединение с телом мотонейрона. Такое соединение, называемое гамма-петлей, представлено на рис. 2.
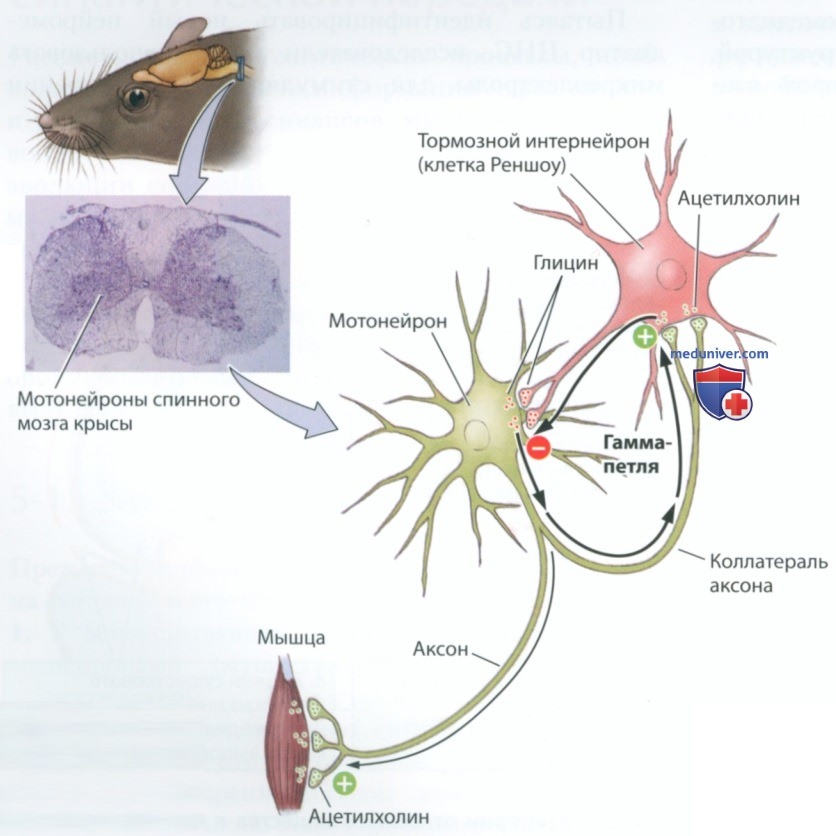
Поскольку, основной идущий к мышце аксон выделяет ацетилхолин, исследователи предположили, что коллатераль аксона также должна выделять ацетилхолин. Использование разных нейромедиаторов двумя терминалями одного аксона казалось маловероятным. Знание того, какое химическое вещество нужно искать, упростило поиск и получение необходимых доказательств того, что ацетилхолин на самом деле выполняет функцию нейромедиатора в обоих местах.
Петля, которую образуют коллатераль аксона и вставочный нейрон спинного мозга, представляет собой цепь обратной связи, которая позволяет мотонейрону подавлять перевозбуждение, если он получает очень много возбуждающих сигналов от других отделов ЦНС. Схема функционирования гамма-петли представлена на рис. 2. Блокировка гамма-петли, например, с помощью токсина (стрихнина), вызывает перевозбуждение нейронов, приводя к судорогам, остановке дыхания и даже к летальному исходу.
В наше время термин «нейромедиатор» трактуют более широко, чем во времена, когда ученые только начали исследовать такие вещества. Нейромедиаторами называют химические вещества, которые:
• обеспечивают передачу сигнала от пресинап-тической мембраны одного нейрона к другому нейрону за счет воздействия на мембранный потенциал постсинаптической мембраны;
• изменяют структуру синапса;
• осуществляют обмен информацией за счет передачи сигналов в обратном направлении.
Такая ретроградная передача сигнала влияет на выделение или обратный захват нейромедиатора пресинаптическим нейроном.
б) Классы нейромедиаторов. Нейромедиаторы классифицируют в соответствии с их химическим составом — существуют низкомолекулярные, пептидные, липидные, газообразные и ионные нейромедиаторы.
1. Низкомолекулярные нейромедиаторы. Быстродействущие низкомолекулярные нейромедиаторы, такие как ацетилхолин, обычно синтезируются из поступающих с пищей веществ и накапливаются в терминалях аксона. При выделении низкомолекулярного нейромедиатора из терминального расширения его запасы на пресинаптической мембране быстро восполняются.
Поскольку низкомолекулярные нейромедиаторы и другие компоненты являются производными веществ, которые мы получаем с пищей, наш рацион может повлиять на количество и активность нейромедиаторов в организме. Этот факт важно учитывать при разработке препаратов, воздействующих на нервную систему. Многие нейроактивные препараты попадают в мозг тем же путем, что и низкомолекулярные нейромедиаторы и их предшественники, — через пищеварительный тракт.
P.S. Оральный способ введения лекарственных препаратов прост и сравнительно безопасен, однако не все препараты могут без изменений пройти через пищеварительный тракт.
В таблице 1 перечислены наиболее известные и хорошо изученные низкомолекулярные нейромедиаторы. Помимо ацетилхолина мы включили в этот список четыре амина (вещества, содержащие аминогруппу — NH), четыре аминокислоты и два пурина.

СИНТЕЗ АЦЕТИЛХОЛИНА. Ацетилхолин присутствует в нервно-мышечных соединениях, в том числе в сердце, а также в ЦНС. На рисунке 3 представлена схема синтеза молекулы ацетилхолина из холина и ацетата с участием двух ферментов, а также ее последующего расщепления. Холин представляет собой один из продуктов расщепления поступающих с пищей жиров, который мы получаем из яичных желтков, авокадо, лосося и растительного масла; ацетат — это соединение, которое мы получаем из кислых продуктов, таких как уксус и лимонный сок.
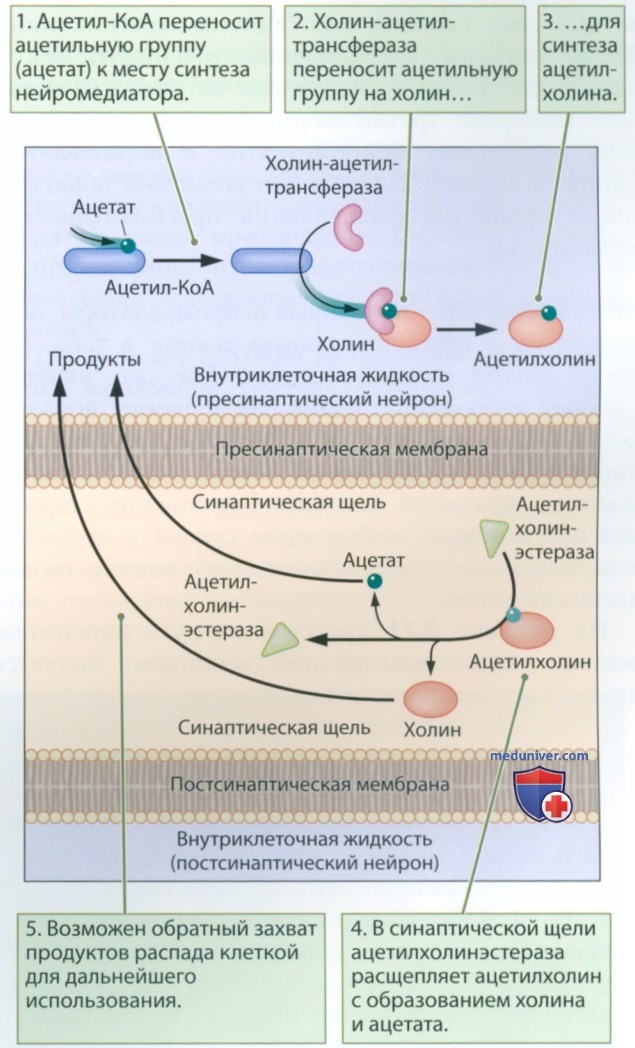
Как показано на рис. 7, в клетке ацетил-кофермент А (ацетил-КоА) переносит ацетильную группу к месту синтеза, а второй фермент, холинацетилтрансфераза, переносит ацетильную группу на субстрат (холин) для синтеза ацетилхолина. После выброса ацетилхолина в синаптическую щель и диффузии к рецепторам на постсинаптической мембране третий фермент, ацетилхолинэстераза, расщепляет нейромедиатор с образованием холина и ацетата. После этого возможен обратный захват продуктов расщепления пресинаптической терминалью.
СИНТЕЗ АМИНОВ. Некоторые нейромедиаторы, объединенные в соответствующую группу в табл. 1, имеют общий путь биосинтеза. Вы уже знакомы с такими нейромедиаторами, как дофамин, норадреналин (норэпинефрин) и адреналин (эпинефрин). Напомним, что снижение выработки дофамина является причиной болезни Паркинсона, адреналин обеспечивает возбуждение сердца у амфибий, а норадреналин обеспечивает возбуждение сердца млекопитающих.
На рисунке 4 представлен путь биосинтеза аминов. Веществом-предшественником является тирозин — аминокислота, которую мы получаем с пищей (в том числе из твердого сыра и бананов). Фермент тирозин-гидроксилаза (фермент 1 на рис. 4) преобразует тирозин в L-ДОФА, который другие ферменты преобразуют в дофамин, затем в норадреналин и, наконец, в адреналин.
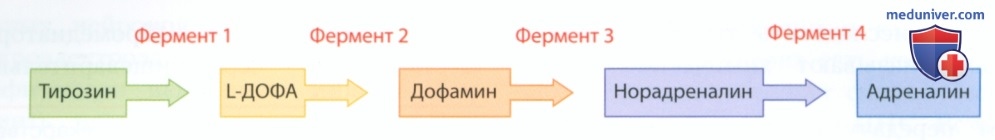
Следует отметить, что количество фермента тирозин-гидроксилазы является фактором, ограничивающим скорость реакции, поэтому выработка дофамина, норадреналина и адреналина также ограниченна, независимо от количества присутствующего в организме или поступающего в организм тирозина. Повлиять на их выработку можно путем орального введения L-ДОФА — препарата, используемого для лечения болезни Паркинсона.
СИНТЕЗ СЕРОТОНИНА. Нейромедиатор серотонин (5-гидрокситриптамин, 5-НТ) синтезируется из аминокислоты L-триптофана. Источником триптофана являются свинина, мясо индейки, молоко, бананы и другие пищевые продукты. Серотонин участвует в регуляции настроения и агрессии, аппетита и возбуждения, дыхания и восприятия боли.
СИНТЕЗ АМИНОКИСЛОТ. Две выполняющие функцию нейромедиаторов аминокислоты, глутаминовая кислота (Glu) и гамма-аминомасляная кислота (ГАМК), тесно связаны друг с другом. Как показано на рис. 5, ГАМК образуется в результате модификации молекулы глутаминовой кислоты. Эти два нейромедиатора являются главными «рабочими лошадками» головного мозга, поскольку они используются в огромном количестве синапсов.
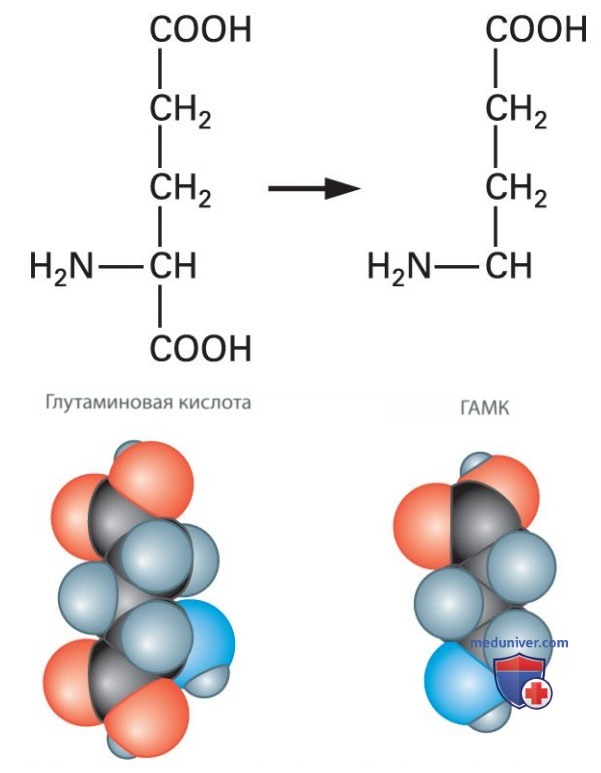
В переднем мозге и мозжечке глутаминовая кислота выполняет функцию основного возбуждающего нейромедиатора, а ГАМК — основного нейромедиатора тормозных синапсов. Таким образом, глутаминовая кислота представляет собой нейромедиатор возбуждающих синапсов, а ГАМК — нейромедиатор тормозных синапсов. Следует отметить, что присутствующая в большом количестве в нейронах ЦНС глутаминовая кислота превращается в нейромедиатор только после упаковки в синаптические пузырьки внутри терминали аксона.
Выполняющая функцию нейромедиатора аминокислота глицин (Gly) — это тормозной нейромедиатор, чаще встречающийся в стволе мозга и спинном мозге, который в том числе регулирует функции гамма-петли (см. рис. 2).
Гистидин — это аминокислота, из которой образуется нейромедиатор гистамин (Н). Гистидин преобразует в гистамин фермент гистидин-декарбоксилаза. Помимо выполнения других функций, среди которых контроль возбуждения и пробуждения, гистамин обеспечивает сокращение гладкой мускулатуры. Активация гистамина при аллергических реакциях приводит к астме, нарушению проходимости бронхов. Вы, вероятно, знакомы с антигистаминными препаратами, применяемыми для лечения аллергии.
ПУРИНЫ. Пурины синтезируются как нуклеотиды — молекулы, из которых состоят ДНК и РНК. Пурин аденозинтрифосфат (АТФ) состоит из молекулы аденина, соединенной с рибозой и тремя фосфатными группами. Отщепление трех фосфатных групп приводит к образованию аденозина молекулы, играющей ключевую роль в регуляции сна, подавлении возбуждения и регуляции кровоснабжения различных органов посредством вазодилатации (релаксации гладкой мускулатуры в стенках кровеносных сосудов).
Клинические аспекты. Пробуждение с L-ДОФА. «Он начал получать L-ДОФА в марте 1969 г. Дозу постепенно увеличивали до 4,0 мг в день в течение трех недель без какого-либо видимого эффекта. Я впервые обнаружил, что L-ДОФА оказывает положительный эффект на м-ра Э., когда шел мимо его палаты в непривычное для меня время и услышал шаги в палате. Я зашел внутрь и увидел, что м-р Э., который был прикован к инвалидному креслу с 1966 г., ходит взад и вперед по палате, демонстрируя отличную осанку и совершенно необычное для него осмысленное выражение лица.
Когда я задал ему вопрос об эффекте препарата, он немного смущенно ответил: «Да! Я почувствовал, что L-ДОФА начинает действовать, три дня назад. Казалось, что по телу разливаются энергия и сила. Я обнаружил, что могу самостоятельно стоять и ходить и что я могу полностью себя обслуживать. Но я боялся, что вы увидите, насколько улучшилось мое состояние, и выпишете меня из больницы». (Sacks, 1976.) В описании этого случая невролог Оливер Сакс (Oliver Sacks) рассказывает об эффекте введения L-ДОФА пациенту, у которого болезнь Паркинсона возникла после перенесенного в 1920-х гг. тяжелого гриппа.
Связь между гриппом и симптомами болезни Паркинсона позволяет предположить, что вирус гриппа попал в мозг и избирательно атаковал дофа-мннэргические нейроны черной субстанции. Препарат L-ДОФА устранил симптомы за счет увеличения количества дофамина в оставшихся синапсах.
Начиная с 1961 г. эксперименты с введением L-ДОФА пациентам с болезнью Паркинсона проводили две независимые группы исследователей (Barbeau et al., 1961; Birkmayer & Hornykiewicz, 1961). Ученые из обеих групп знали, что биосинтез дофамина происходит в дофаминэргических синапсах (см. рис. 4). Оказалось, что L-ДОФА способствует уменьшению мышечной ригидности.
Эта работа впервые показала, что симптомы неврологического заболевания может облегчить препарат, воздействующий на выработку нейромедиатора. Впоследствии L-ДОФА стал стандартным препаратом для лечения болезни Паркинсона. Его эффективность удалось повысить за счет введения препаратов, препятствующих превращению L-ДОФА в дофамин до прохождения через гематоэнцефалический барьер и попадания в дофаминергические нейроны головного мозга.
Тем не менее L-ДОФА не позволяет полностью излечить заболевание. Болезнь Паркинсона по-прежнему прогрессирует, несмотря на лечение. Постепенная утрата дофаминэргических синапсов приводит к снижению эффективности лечения. Кроме того, L-ДОФА может вызывать дискинезии — дистонические или хореиформные непроизвольные движения. В случае появления тяжелых побочных эффектов лечение этим препаратом необходимо прекратить.

2. Пептидные нейромедиаторы. Более 50 коротких пептидов различной длины (менее 100 аминокислотных остатков) входят в группу пептидных нейромедиаторов, нейропептидов, которые перечислены в табл. 2. Синтезируемые посредством трансляции мРНК в соответствии с инструкциями, записанными в ДНК нейрона, нейропептиды представляют собой многофункциональные полипептидные цепочки, которые выполняют функцию нейромедиаторов.

В некоторых нейронах синтез пептидных нейромедиаторов происходит в терминали аксона, однако в большинстве случаев их сборка осуществляется на рибосомах нейрона, а упаковка в мембрану — в аппарате Гольджи. За транспорт пептидных нейромедиаторов к терминали аксона отвечают микротрубочки. Процесс биосинтеза и транспорта нейропептидов идет очень медленно по сравнению с биосинтезом низкомолекулярных нейромедиаторов. Поэтому пептидные нейромедиаторы медленно действуют и их запасы медленно пополняются.
Тем не менее нейропептиды выполняют множество функций в нервной системе. Они действуют как гормоны, которые вырабатываются в ответ на стресс, способствуют формированию привязанности матери к ребенку, регулируют прием пищи и утоление жажды, удовольствие и боль, а также, по-видимому, участвуют в обучении.
Опиум, морфин и родственные им синтетические вещества, такие как героин, которые вызывают эйфорию и уменьшают боль, воспроизводят действие эндогенных опиоидных пептидов — энкефалинов, динорфинов и эндорфинов. (Название «энкефалин» происходит от фразы «in the cephalon», которую можно перевести как «в мозге или голове», а название «эндорфин» — это сокращенный вариант названия «эндогенный морфин».)
Как показано на рис. 6 для двух пептидов, все природные опиоидные пептиды содержат один и тот же фрагмент аминокислотной цепи. Морфин имитирует этот фрагмент цепи. Открытие природных морфинонодобных нейропептидов позволило предположить, что некоторые из них могут обладать анальгезирующим эффектом и вносить определенный вклад в восприятие боли. Оказалось, что обезболивающий эффект бета-эндорфина, который выделяется при физических упражнениях, и, по-видимому, отвечает за возникновение «эйфории бегуна», многократно превосходит обезболивающий эффект морфина.

Некоторые пептиды ЦНС отвечают за специфические формы периодического изменения поведения, которые могут возникать ежемесячно или ежегодно. Например, в организме самки оленя нейропептиды выполняют функцию гормонов (лютеинизирующий гормон), которые готовят ее к осеннему брачному периоду. Зимой другой набор гормонов способствует развитию плода. Весной, после родов, в игру вступают другие специфические нейропептиды — окситоцин, который отвечает за формирование привязанности между матерью и детенышем, и пролактин, который позволяет матери выкормить детеныша.
Те же самые нейропептиды выполняют аналогичные функции в организме человека. Другие нейропептиды, такие как гормоны роста, влияют на другие функции организма, регулируя рост. В отличие от многих нейромедиаторов, которые связываются с белками ионных каналов, нейропептиды являются метаботропными и не оказывают прямого влияния на мембранный потенциал постсинаптической мембраны. Вместо этого пептидные нейромедиаторы активируют синаптические рецепторы, которые оказывают непрямое влияние на структуру и функцию клетки. В отличие от низкомолекулярных нейромедиаторов, расщепляемые в пищеварительном тракте нейропептиды обычно не подходят для перорального приема.
3. Липидные нейромедиаторы. Среди липидных нейромедиаторов преобладают эндогенные каннабиноиды — группа нейромедиаторов, синтезируемых на постсинаптической мембране и воздействующих на рецепторы пресинаптической мембраны. Эндогенные каннабиноиды — это анандамид и 2-арахидоноилглицерин (2-AG), которые представляют собой производные арахидоновой кислоты, относящейся к ненасыщенным жирным кислотам. Основными источниками указанных веществ являются мясо птицы и яйца. Эндогенные каннабиноиды участвуют во множестве физиологических и психических процессов, связанных с аппетитом, болью, сном, настроением, памятью, тревогой и реакцией на стресс. История их изучения коротка, однако она наглядно демонстрирует прогресс науки.
Поскольку эндогенные каннабиноиды представляют собой липофильные молекулы, они не растворяются в воде и не накапливаются в везикулах. Ученые предположили, что эндогенные каннабиноиды синтезируются по запросу после деполяризации нейрона и притока ионов кальция. Кальций активирует фермент трансацилазу — это первый этап синтеза анандамида. Синтезированный анандамид или 2-арахидоноилглицерин диффундирует через синаптическую щель и взаимодействует с рецептором на пресинаптической мембране. Таким образом, обе молекулы действуют как ретроградные нейромедиаторы, на время уменьшая количество высвобождаемого низкомолекулярного нейромедиатора. Так постсинаптический нейрон снижает интенсивность входящего сигнала.
Мишенью всех каннабиноидов, эндогенных, растительных или синтетических, является рецептор СВ1. Да, наше тело буквально набито такими рецепторами (Scudellari, 2017). Рецепторы СВ1 встречаются в глутаматергических и ГАМКергических синапсах — это значит, что каннабиноиды действуют как нейромодуляторы, которые подавляют выброс глутаминовой кислоты и ГАМК. Так, каннабиноиды ослабляют возбуждение и торможение нейронов.
Растительные каннабиноиды получают из конопли Cannabis sativa и Cannabis indica. Эти растения тысячелетиями использовали в медицинских и рекреационных целях, однако получить экстракт конопли удалось совсем недавно. В конце прошлого века из конопли были выделены многие вещества, в том числе тетрагидроканнабинол и каннабидиол, была описана их химическая структура. В 1967 г. Иехиель Гаони (Yehiel Gaoni) и Рафаэль Мешулам (Raphael Mechoulam) опубликовали химическую формулу тетрагидроканнабинола (ТГК) — основного психоактивного компонента каннабиса. Позднее исследователи определили, как метаболизируется ТГК. (Процесс идет довольно медленно — это объясняет, почему ТГК продолжает выделяться с мочой в течение нескольких педель после употребления каннабиса.)
Исследования физиологических и психологических эффектов ТГК на человеке и животных, которые начались после выделения и очистки ТГК, продолжаются. Через 24 года после того, как была описана молекула ТГК, был обнаружен первый каннабиноидный рецептор (СВ1). Обычно активацию таких рецепторов обеспечивают эндогенные молекулы — именно это побудило исследователей начать поиск эндогенных каннабиноидов. Четырьмя годами позже, в 1992 г., удалось выделить и описать анандамид. Потребовалась еще пара десятилетий, чтобы понять, что эндоканнабиноиды действуют как ретроградные нейромедиаторы (Mechoulam et al., 2014).
4. Газообразные нейромедиаторы. Газы, оксид азота (NO), оксид углерода (СО) и сероводород (H2S), расширяют спектр используемых нейромедиаторами биохимических стратегий. Будучи водорастворимыми соединениями, они не накапливаются в синаптических пузырьках и не выделяются из клетки с помощью экзоцитоза. Вместо этого клетка синтезирует их по запросу. Вырабатываемый газ диффундирует из клетки, с легкостью проникая сквозь клеточную мембрану, и немедленно вступает во взаимодействие. NO и СО активируют метаболические (энергоемкие) процессы в клетке, в том числе процессы, модулирующие выработку других нейромедиаторов. H2S препятствует связыванию кислорода в митохондриях, таким образом замедляя метаболизм.
Все три газообразных нейромедиатора действуют как химические мессенджеры в разных отделах организма. NO и H2S контролируют мышцы стенок кишечника и обеспечивают расслабление гладкой мускулатуры кровеносных сосудов в активных отделах мозга, улучшая их кровоснабжение. Поскольку NO и H2S также обеспечивают расслабление гладкой мускулатуры кровеносных сосудов половых органов, они участвуют в эрекции полового члена. Лекарства, используемые для лечения эректильной дисфункции у мужчин, такие как виагра и сиалис, воздействуют на внутриклеточные каскады передачи сигнала от NO. Показано, что NO не действует сам по себе, вызывая сексуальное возбуждение.
5. Ионный нейромедиатор. Новейшие данные заставили ученых признать цинк (Zn2+) нейромедиатором. Ионы цинка не синтезируются в организме. Как и атомы всех прочих элементов, атомы цинка образовались в результате ядерных реакций в недрах звезд. Ионы цинка активно транспортируются, упаковываются в синаптические пузырьки (обычно вместе с другим нейромедиатором вроде глутаминовой кислоты) и выделяются в синаптическую щель.
Цинк взаимодействует с несколькими различными рецепторами, вызывая определенные биологические изменения. Нарушение обмена цинка приводит к возрастным или связанным с болезнью Альцгеймера когнитивным нарушениям. Поддержание гомеостаза цинка или медикаментозная коррекция способствует сохранению когнитивных функций (McAllister & Dyck, 2017).
в) Типы рецепторов. Белки, которые принадлежат к двум основным классам рецепторов, действуют по-разному: некоторые белки влияют непосредственно на мембранный потенциал постсинаптической мембраны, а другие белки оказывают непрямое воздействие на нейроны. Изучение различных подтипов рецепторов позволяет выявить небольшие различия в функциях рецепторов.
1. Два основных класса рецепторов. Когда в одном из множества различных синапсов происходит выделение нейромедиатора на одну из множества мишеней, нейромедиатор пересекает синаптическую щель и связывается с рецептором. Его дальнейшая судьба зависит от типа рецептора.
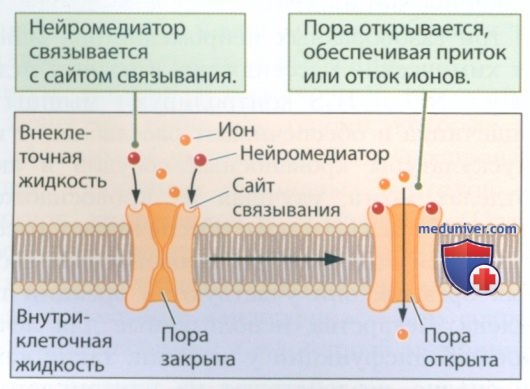
Ионотропные рецепторы позволяют ионам, таким как Na+, К+, Cl- и Са2+, течь через мембрану.
Как показано на рис. 7, ионотропный рецептор состоит из двух частей: 1) сайта связывания нейромедиатора и 2) поры или канала. Когда нейромедиатор прикрепляется к сайту связывания, конфигурация рецептора меняется, в результате чего пора открывается, обеспечивая поток ионов через мембрану, или закрывается, препятствуя потоку ионов. Таким образом, ионотропные рецепторы обеспечивают быстрое изменение мембранного потенциала и обычно являются возбуждающими они запускают потенциал действия.
Метаботропный рецептор содержит сайт связывания нейромедиатора, но в нем отсутствует пора, через которую могли бы течь ионы. После активации метаботропные рецепторы оказывают непрямое воздействие на расположенные поблизости ионные каналы или на клеточный метаболизм. На рисунке 8 представлен пример такого непрямого воздействия. Метаботропный рецептор состоит из одного мембранного белка, а сайт связывания обращен в сторону синаптической щели. Каждый рецептор сопряжен с одним G-белком (гуанин-нуклеотидсвязывающим белком), который можно увидеть на внутренней стороне клеточной мембраны на рис. 8. При активации G-белок связывается с другими белками.
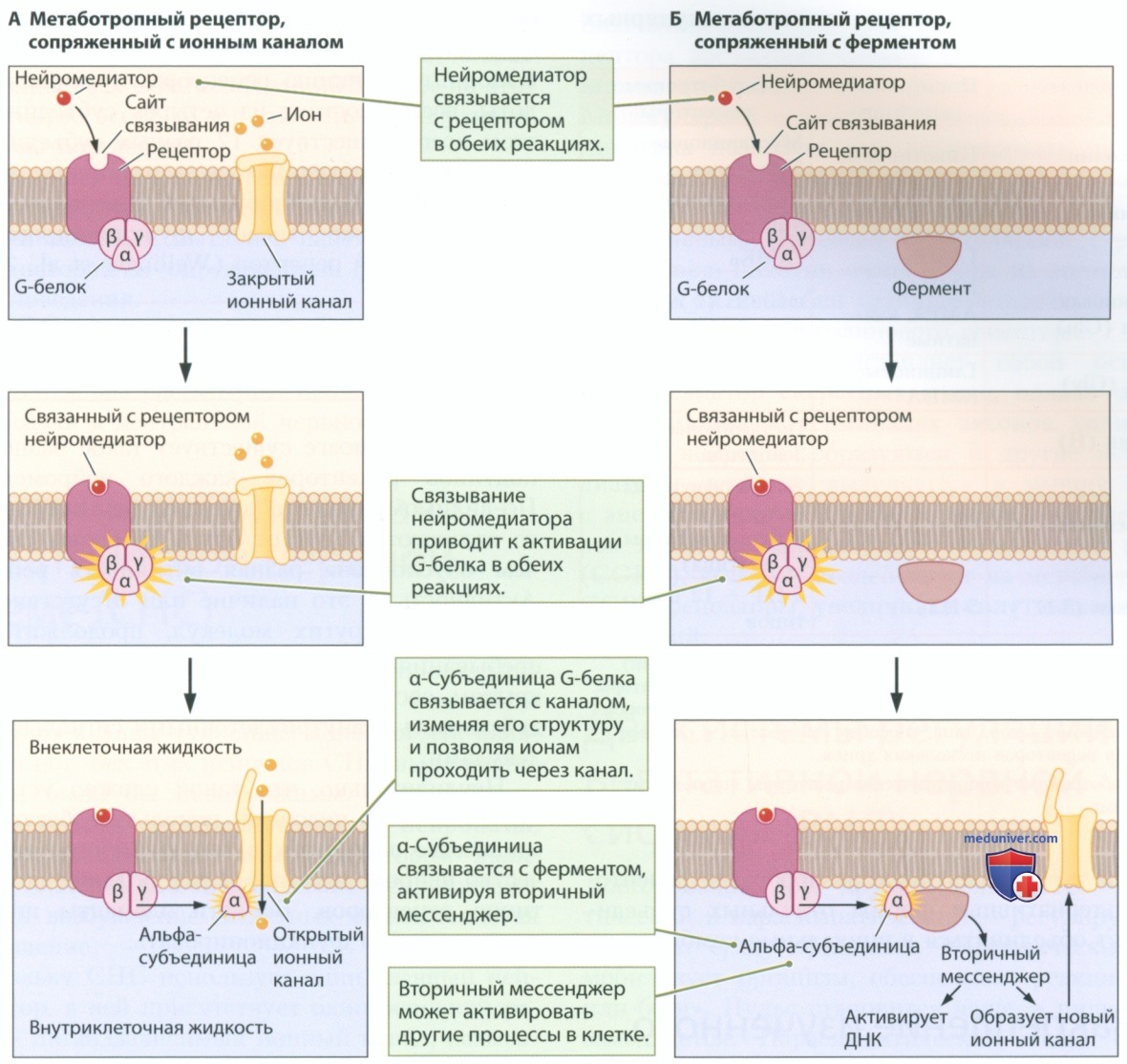
G-белок состоит из трех субъединиц — альфа, бета и гамма (субъединица — это белок, который образует комплекс вместе с другими белками). Альфа-субъединица отделяется, когда нейромедиатор связывается со связанным с G-белком метаботропным рецептором. Затем отделившаяся альфа-субъединица может связываться с другими мембранными белками или белками внутриклеточной жидкости. При связывании альфа-субъединицы с расположенным поблизости ионным каналом (рис. 8, внизу) конфигурация ионного канала меняется, изменяя поток ионов через мембрану. Если канал находится в открытом состоянии, альфа-субъединица может его закрыть, а если в закрытом, то открыть. Изменения конфигурации ионного канала и потока ионов через мембрану влияют на мембранный потенциал.
Связывание нейромедиатора с метаботропным рецептором может запускать более сложные каскады биохимических реакций, которые представлены на рис. 8. Запуск каскада происходит в момент связывания отделившейся альфа-субъединицы с ферментом. Фермент, в свою очередь, активирует вторичный мессенджер (первичный мессенджер — это нейромедиатор), который передает сигнал на другие клеточные структуры. Как показано на рис. 8 (внизу), вторичный мессенджер может:
• связываться с ионным каналом мембраны, меняя структуру ионного канала и таким образом изменяя поток ионов через мембрану;
• запускать реакции, приводящие к встраиванию внутриклеточных белков в клеточную мембрану с образованием, в том числе, новых ионных каналов;
• связываться с определенными сайтами ДНК клетки, запуская синтез или препятствуя синтезу специфических белков.
При связывании нейромедиатора с рецептором метаботропные рецепторы также запускают последовательность реакций, называемую амплифицирующим каскадом. Каскад приводит к активации или инактивации многих белков (вторичных мессенджеров, ионных каналов или и тех и других). Ионотропные рецепторы не обладают таким амплифицирующим эффектом.
Напомним, что ацетилхолин оказывает возбуждающее воздействие на скелетные мышцы, активируя ионотропный рецептор. При этом ацетилхолин оказывает тормозное воздействие на сердечную мышцу, активируя метаботропный рецептор. Кроме того, каждый нейромедиатор может связываться с ионотропными или метаботропными рецепторами нескольких типов. Например, в разных отделах нервной системы ацетилхолин активирует множество рецепторов обоих типов.
2. Подтипы рецепторов. Хотя основных классов рецепторов всего два (метаботропные и ионотропные), каждый нейромедиатор способен взаимодействовать со специфическими рецепторами нескольких подтипов.
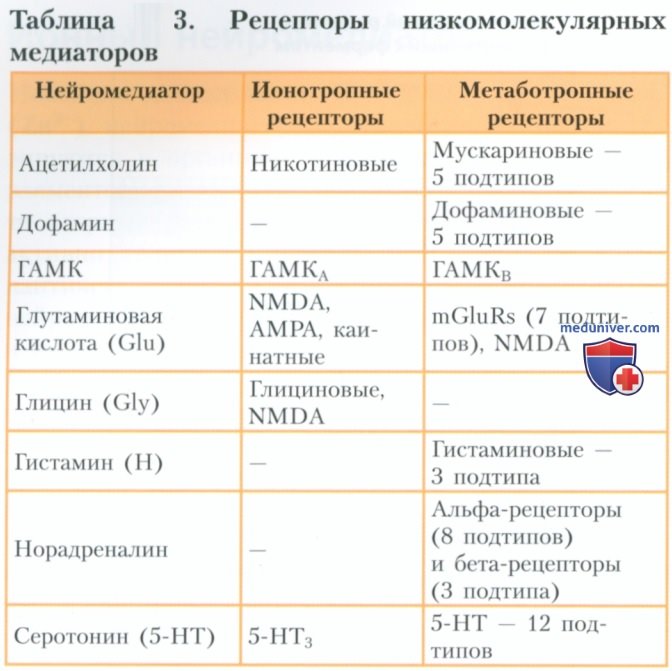
Например, серотонин (5-НТ) взаимодействует с одним подтипом ионотропных рецепторов (5-НТ3) и 12 подтипами метаботропных рецепторов. Подтипы рецепторов низкомолекулярных нейромедиаторов перечислены в табл. 3.
Откуда же взялось такое разнообразие рецепторов? Альтернативные формы отдельных субъединиц могут объединяться в уникальные комбинации, образуя функциональные рецепторы. Например, функциональный NMDA-рецептор, который может выполнять функцию рецептора глутаминовой кислоты, всегда состоит из четырех субъединиц. При этом всего существует 12 разных субъединиц, которые могут объединяться в различные комбинации, образуя функциональные рецепторы. NMDA-рецептор также может функционировать как метаботропный рецептор (Weilinger et al., 2016).
Почему в мозге существует такое разнообразие подтипов рецепторов каждого нейромедиатора? По-видимому, разные подтипы рецепторов немного отличаются друг от друга по своим свойствам, чем обусловлена разная активность рецепторов. Активность — это наличие или отсутствие сайтов связывания других молекул, продолжительность пребывания ионного канала в открытом или закрытом состоянии, а также способность взаимодействовать с внутриклеточными сигнальными молекулами.
Неудивительно, что такой сложно устроенный мозг, как мозг человека, использует бесчисленное множество элементов, в том числе огромное количество нейромедиаторов и еще большее количество типов рецепторов. Все эти элементы позволяют мозгу успешно функционировать.
г) Вопросы для самоконтроля. Прежде чем продолжить, проверьте себя.
1. Существуют следующие критерии отнесения вещества к нейромедиаторам: ________ , ________ , ________ и ________ .
2. Нейромедиаторы делят на следующие группы: ________ , ________ , ________ , ________ и ________ .
3. Ацетилхолин образуется из ________ и ________. После выделения в синаптическую щель ацетилхолин расщепляется ________ , после чего возможен обратный захват продуктов расщепления.
4. Эндогенные каннабиноиды — это ________ нейромедиаторы, которые синтезируются по запросу и выделяются из ________ мембраны.
5. Расскажите об основных особенностях ионотропных и метаботропных рецепторов.
д) Ответы на вопросы для самоконтроля.
1. Синтез в нейроне; высвобождение из нейрона; действие на мишень (рецептор); инактивация после выполнения своей функции.
2. В любом порядке: низкомолекулярные; пептидные; газообразные; липидные; ионные.
3. В любом порядке: ацетата, холина; ацетилхолинэстеразой (AChE).
4. Липидные; постсинаптической.
5. Ионная пора (ионный канал) ионотропных рецепторов может открываться (при действии нейромедиаторов) или закрываться (при инактивации нейромедиаторов), регулируя таким образом поток ионов. Эти рецепторы обеспечивают быстрые и чаще возбуждающие изменения потенциала постсинаптической клетки. Метаботропные рецепторы обычно обеспечивают медленные тормозные эффекты в результате инициации внутриклеточных химических каскадов с участием вторичных посредников, вызывая функциональные и структурные изменения в клетках.
- Читать далее "Связь нейромедиаторных систем и поведения"
Редактор: Искандер Милевски. Дата публикации: 19.7.2023
