Механизмы химической передачи информации нейронами
а) Исследование. Общение между нейронами и сердечный ритм. Понять, как нейроны общаются между собой, удалось благодаря экспериментам по изучению регуляции сердечного ритма у животных. Как и у других животных, наш сердечный ритм ускоряется, когда мы взволнованы или занимаемся спортом, и замедляется, когда мы отдыхаем. Частота сердечных сокращений меняется в зависимости от расхода энергии, чтобы удовлетворить потребности организма в питательных веществах и кислороде.
При погружении под воду частота сердечных сокращений постепенно меняется: сердечный ритм замедляется почти до остановки сердца. Такое замедление сердечного ритма, называемое рефлексом погружения, снижает расход кислорода, когда мы не можем дышать. Брадикардия (от лат. brady — медленный, cardia — сердце) — это стратегия, которая способствует выживанию. Такая реакция на погружение под воду встречается у многих животных. Что же регулирует наш сердечный ритм?
Отто Леви (Otto Loewi), великий фантазер, утверждал, что увидел во сне признанный классическим эксперимент, который в 1936 г. сделал его Нобелевским лауреатом. Как показано далее в эксперименте, Леви поместил изолированное сердце лягушки в физиологический раствор, а затем провел электростимуляцию блуждающего нерва — черепного нерва, который идет от головного мозга к сердцу. Жидкость, омывавшая подвергаемое стимуляции сердце, по трубке поступала в сосуд со вторым изолированным сердцем, которое не подвергали стимуляции.
Леви измерял частоту сокращений обоих сердец. Его наблюдения изложены далее в эксперименте. Электростимуляция приводила к снижению частоты сокращений первого сердца и, что еще важнее, снижала частоту сокращений второго сердца. Эксперимент показал, что жидкость, перенесенная из первого контейнера во второй, каким-то образом передавала сигнал о замедлении сердечного ритма.
Что же это был за сигнал? Леви пришел к выводу, что химическое вещество, высвобождаемое блуждающим нервом при стимуляции, попадало в раствор и влияло на работу второго сердца. Эксперимент Леви показал, что блуждающий нерв содержит вещество, способное заставить сердце биться реже.
Впоследствии Леви удалось идентифицировать это вещество. Позднее он также идентифицировал вещество, которое передавало сигнал об ускорении сердечного ритма. Частота сердечных сокращений меняется в ответ как минимум на два различных сигнала: возбуждающий сигнал, который заставляет сердце биться чаще, и тормозной сигнал, который заставляет его биться реже.

В предыдущих статьях на сайте мы рассказали о том, как нейроны передают информацию в виде электрических сигналов: сначала возникает потенциал действия, затем нервный импульс передается по аксону к синапсу. В этих статьях на сайте мы расскажем, как нейроны общаются друг с другом с помощью возбуждающих и тормозных сигналов. Кроме того, мы расскажем, как высвобождаемые одним нейроном химические вещества передают сигнал на рецепторы принимающих нейронов, которые генерируют ответ. В отдельной статье на сайте рассмотрены нейронные механизмы обучения — физической адаптации синаптических соединений к новому опыту.
б) Химическая передача информации. Успех эксперимента Отто Леви с регуляцией сердечного ритма, рассмотренный выше, положил начало исследованиям механизмов обмена информацией между нейронами нервной системы с помощью химических веществ. Леви был первым, кому удалось выделить химический мессенджер. Сейчас это вещество известно нам как ацетилхолин (АЦХ; ACh) - нейромедиатор, который активирует скелетные мышцы. Однако в эксперименте Леви ацетилхолин выступал в роли вещества, подавляющего сокращения сердечной мышцы и замедляющего сердечной ритм.
Известно, что ацетилхолин возбуждает скелетные мышцы через соматическую нервную систему, заставляя их сокращаться, а также возбуждает или тормозит функции различных внутренних органов через вегетативную нервную систему. Каким образом одно и то же химическое вещество может выполнять две функции одновременно? Оказывается, возбуждающее или тормозное действие мессенджера определяет не сама молекула, а ионный канал и соответствующий рецептор — об этом можно прочитать в отдельной статье на сайте - просим пользоваться формой поиска выше. Да, именно действием ацетилхолина объясняется замедление сердечного ритма при погружении под воду.
В последующих экспериментах, смоделированных по методике, описанной ниже, Леви стимулировал другой идущий к сердцу нерв, ускоряющий сердечный ритм, что приводило к увеличению частоты сердечных сокращений. Жидкость из контейнера с подвергаемым стимуляции сердцем точно так же увеличивала частоту сокращений второго сердца, не подвергавшегося электростимуляции. Леви удалось идентифицировать химическое вещество, которое у лягушек передает сигнал об ускорении сердечного ритма, адреналин, также называемый эпинефрином (от греч. epi - над и nephron — почка).
Адреналин (латинское название) и эпинефрин (греческое название) — это одно и то же вещество, вырабатываемое расположенными над верхней частью почек железами внутренней секреции надпочечниками. Название «адреналин» известно большему числу людей отчасти из-за того, что известная фармацевтическая компания использовала его в качестве торгового наименования, однако в западном научном сообществе принято употреблять название «эпинефрин».
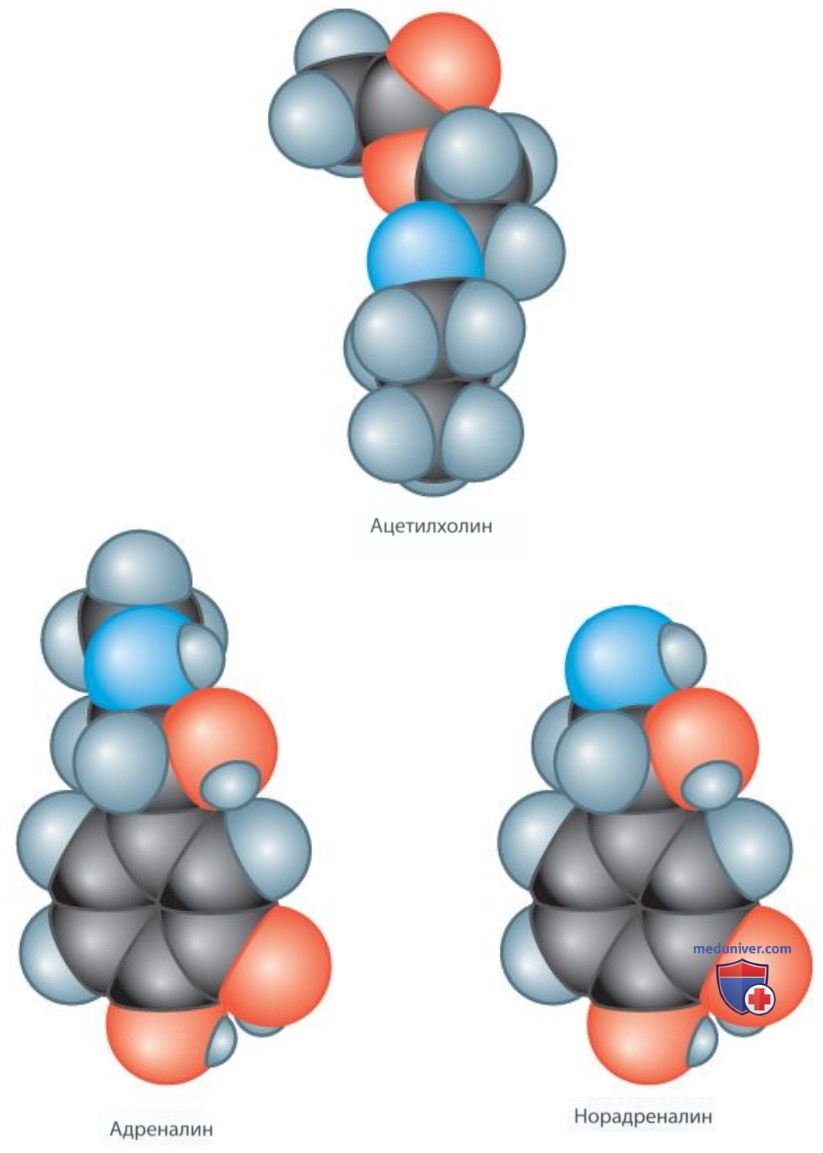
Дальнейшие эксперименты показали, что у млекопитающих веществом, ускоряющим сердечный ритм, является норадреналин (также называемый норэпинефрином) — вещество, по своей химической структуре похожее на адреналин. Результаты проведенных Леви дополнительных экспериментов показали, что высвобождаемый блуждающим нервом ацетилхолин тормозит сердечные сокращения, а высвобождаемый ускоряющим нервом сердца адреналин возбуждает их. Молекулы ацетилхолина, адреналина и норадреналина различаются по структуре (рис. 1), что позволяет каждому из них взаимодействовать со специфическим рецептором.
P.S. Блуждающий нерв влияет на работу сердца и другие процессы в организме.
Химические мессенджеры, которые нейрон выделяет, чтобы обеспечить возбуждение или торможение мишени, называют нейромедиаторами. Вне центральной нервной системы многие из этих веществ циркулируют в крови как гормоны. Под контролем гипоталамуса гипофиз выбрасывает в кровь гормоны, необходимые для возбуждения или торможения мишеней, в том числе внутренних органов и желез внутренней секреции, регулируемых вегетативной и энтеральной нервной системой. Отчасти из-за того, что гормоны путешествуют по организму к отдаленным мишеням, они действуют медленнее, чем нейромедиаторы в ЦНС, на которые воздействует молниеносно распространяющийся нервный импульс.
Однако в реальности нейромедиаторы отличает от гормонов расстояние, которое им приходится преодолевать на пути к рецептору.
После открытий Леви началось исследование других нейромедиаторов и их функций. Истинное число нейромедиаторов неизвестно — считается, что их не более 100. Удалось подтвердить существование 60 медиаторов, однако основную работу делают 10 веществ. Для того чтобы химическое вещество признали нейромедиатором, оно должно отвечать определенным критериям. В этой главе мы рассмотрим эти критерии, а также обсудим избранные нейромедиаторы и их функции. Вы узнаете, как группы нейронов формируют нейромедиаторные системы мозга, чтобы с их помощью управлять различными аспектами поведения.
Отдельные статьи на сайте рассказывают увлекательную историю изучения одного нейромедиатора (дофамина), позволившего прийти к пониманию различных функций мозга. Недостаточность этого нейромедиатора в определенных областях мозга связана со специфическими неврологическими нарушениями. Начало истории приведено ниже.
1. Эксперимент. Как нейрон передает сигнал?
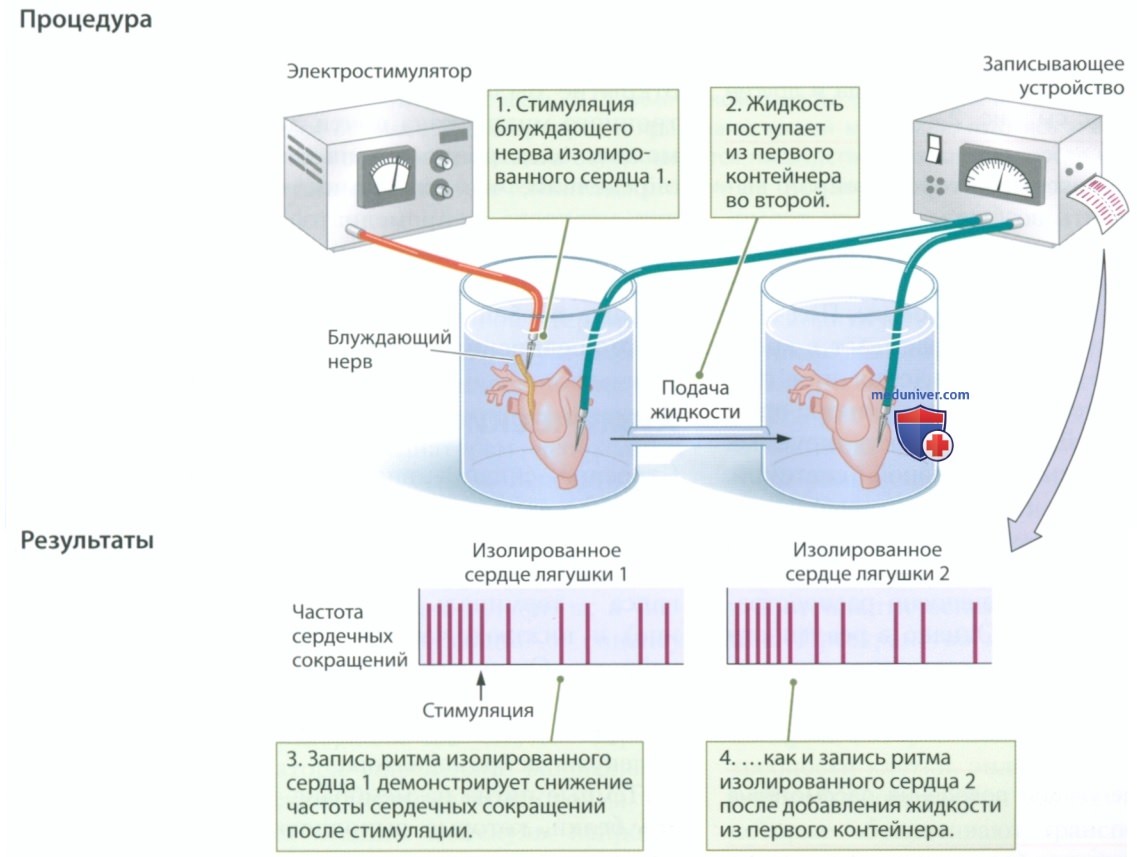
Вывод. Таким образом, жидкость, перенесенная из первого контейнера во второй передает сигнал о замедлении сердечного ритма. Сигналом является высвобождаемое нервом химическое вещество.
в) Структура синапса. Открытие Леви химических мессенджеров, способных регулировать сердечный ритм, было первым из двух важных открытий, которые составляют основу современного понимания механизмов обмена информацией между нейронами. Второе открытие было сделано после изобретения электронного микроскопа почти 30 лет спустя — с помощью электронного микроскопа исследователи определили, что на терминалях аксона происходит упаковка нейромедиаторов в пузырьки (везикулы). Окрашивание ткани веществом, которое отражает распределение электронов, позволяет изучить особенности ультраструктуры синаптического соединения.
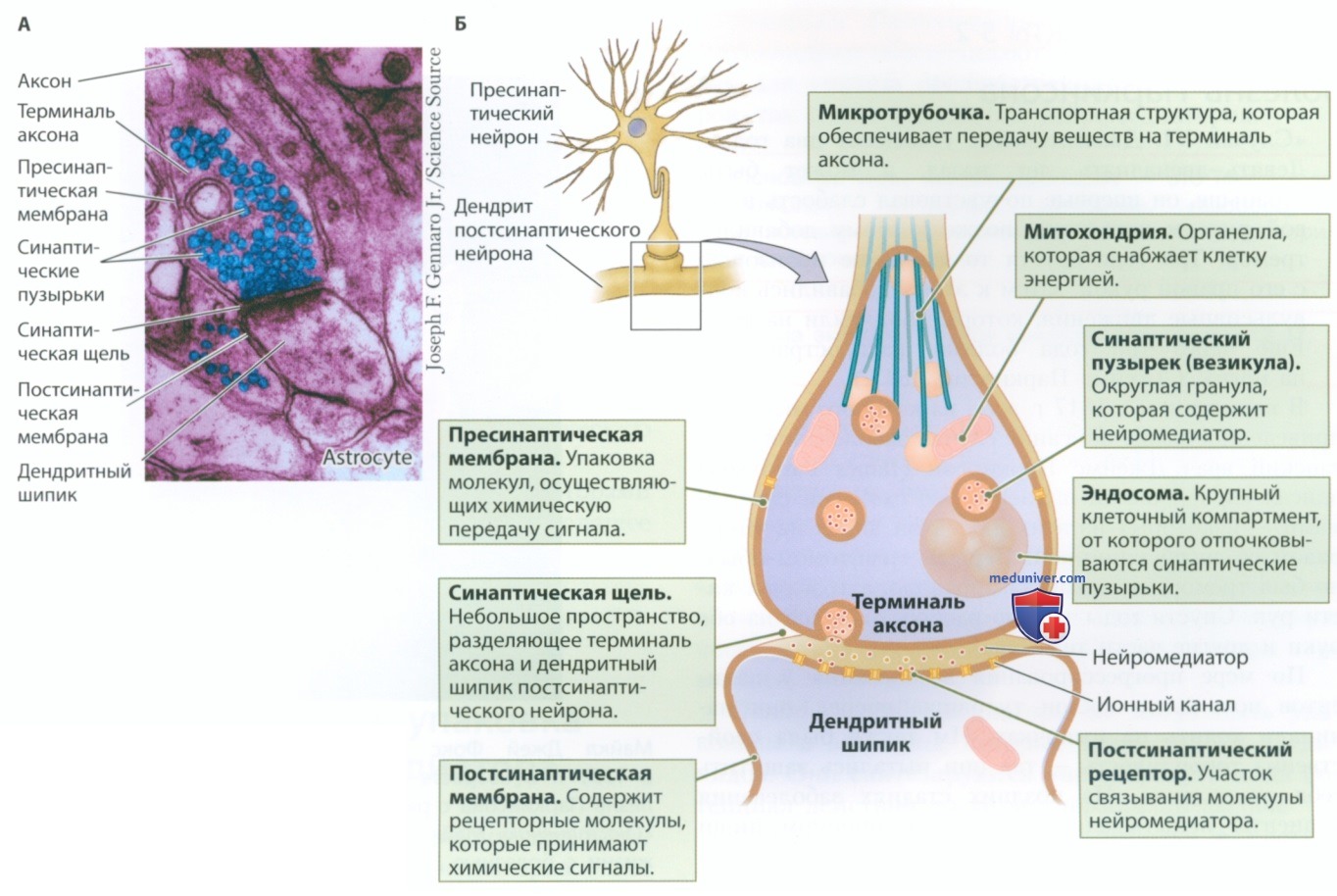
1. Химические синапсы. Строение синапса впервые удалось рассмотреть в 1950-х гг. с помощью электронного микроскопа. На микрофотографии, представленной на рис. 2, можно увидеть верхнюю часть синапса — терминаль аксона (синаптическое окончание) и нижнюю часть — дендрит принимающего нейрона. Округлые, похожие на гранулы структуры в области терминали это синаптические пузырьки (везикулы), внутри которых находятся молекулы нейромедиатора.
Темные пятна на мембране терминали аксона это белки, которые выполняют функцию ионных каналов, сигнализирующих о выбросе нейромедиатора, или насосов, которые осуществляют обратный захват высвобождаемого нейромедиатора. Темные пятна на дендрите — это в основном рецепторные молекулы, которые состоят из принимающих химические сигналы белков. Терминаль аксона и дендрит отделены друг от друга небольшим пространством — синаптической щелью. Синаптическая щель — основа функционирования синапса, поскольку нейромедиаторам необходимо преодолеть это пространство, чтобы передать сигнал от одного нейрона другому нейрону.
На микрофотографии (рис. 2) видно, что синапс окружен множеством структур, среди которых астроцит, другие аксоны и дендриты, а также другими синапсами. Прилегающий к синапсу астроцит вносит свой вклад в синаптическую передачу следующим образом: например, он поставляет строительные материалы для синтеза определенного нейромедиатора, определяет направление и ограничение движения нейромедиаторов в синапсе и утилизирует лишние молекулы нейромедиатора. Функциональная интеграция расположенных в непосредственной близости друг от друга пресинаптической и постсинаптической мембран, а также близлежащих астроцитов, представляют собой так называемый трехчастный синапс.
На рисунке 2 представлена схема передачи сигнала в химическом синапсе синаптическом соединении, где молекулы мессенджера, высвобождаемые одним нейроном, взаимодействуют со следующим нейроном. Здесь пресинаптическая мембрана представляет собой терминаль аксона, а постсинаптическая мембрана — дендритный шипик. Пространство между ними — это синаптическая щель. В пределах терминали аксона находятся специализированные структуры, в том числе митохондрии, которые обеспечивают энергетические потребности клетки, эндосома для хранения, от которой отпочковываются везикулы, и микротрубочки, которые обеспечивают транспорт веществ (в том числе нейромедиатора) к терминали аксона.
в) Клинические аспекты. Болезнь Паркинсона. «Случай VI. Джентльмену... семьдесят два года..., Девять-двенадцать лет назад, а может быть, и раньше, он впервые почувствовал слабость в левой руке и ноге, чуть позже к этому добавился тремор. Три года спустя то же самое произошло с его правой рукой, затем к этому добавились конвульсивные движения, которые повлияли на речь. Еще через три года болезнь распространилась на ноги». (Джеймс Паркинсон, 1817.)
В написанном в 1817 г. эссе, из которого мы взяли приведенное выше описание случая заболевания, британский врач Джеймс Паркинсон (James Parkinson) описал случаи шести пациентов со схожими симптомами — некоторых из этих людей он видел на улице рядом со своей клиникой. Первым симптомом обычно был тремор, который, как правило, затрагивал кисти рук. Спустя годы тремор распространялся на обе руки и другие части тела.
По мере прогрессирования заболевания у пациентов появлялся наклон туловища вперед, они начинали ходить на цыпочках. Им также была свойственна торопливость — так они пытались защитить себя от падения. На поздних стадиях заболевания пациенты испытывали трудности с приемом пищи и глотанием. Больные пускали слюни, и у них были проблемы с опорожнением кишечника. В конце концов пациенты полностью теряли контроль над своим телом, они не могли спать из-за сильного тремора.
Более чем через 50 лет после того, как Джеймс Паркинсон опубликовал описание заболевания, французский невролог Жан-Мартен Шарко дал ему название болезнь Паркинсона. Понять механизмы развития заболевания ученым помогли три открытия:
1. В 1919 г. Константин Третьяков (Constantin Treatikoff, 1974) провел патологоанатомическое исследование материалов девяти пациентов с болезнью Паркинсона и обнаружил дегенерацию черной субстанции — небольшого ядра среднего мозга. В мозге пациента, у которого симптомы болезни Паркинсона проявлялись только на одной половине тела, дегенерация присутствовала в контралатеральной части черной субстанции.
2. Химический анализ мозга пациентов с болезнью Паркинсона показал, что симптомы проявляются при снижении содержания в базальных ядрах дофамина (DA), позднее признанного нейромедиатором, до уровня, составляющего менее 10% от нормы (Ehringer & Hornykiewicz, 1960/1974).
3. Подтвердить участие дофамина в передаче сигнала от черной субстанции к базальным ядрам удалось Урбану Унгерштедту (Urban Ungerstedt) в 1971 г. Он обнаружил, что введение нейротоксина 6-гидроксидофамина крысам приводило к избирательной гибели дофаминсодержащих нейронов и появлению симптомов болезни Паркинсона.
Гибель дофаминсодержащих нейронов черной субстанции связывают с факторами внешней среды, в том числе с воздействием инсектицидов, гербицидов, фунгицидов, вируса гриппа и токсичных препаратов. Примерно у 10% пациентов с болезнью Паркинсона присутствуют мутации в одном или нескольких специфических генах. Возможно, люди, подверженные влиянию вредных факторов, также имеют генетическую предрасположенность к заболеванию.

Дофамин, который присутствует и в других отделах мозга, связан не только с двигательными функциями, но также с некоторыми формами обучения и нейронными структурами, которые опосредуют вознаграждение и формирование зависимости. Некоторые пациенты с болезнью Паркинсона, получающие дофаминергические препараты, внезапно становятся шопоголиками или компульсивными игроками.
Лечение неврологических заболеваний обычно наиболее эффективно на ранних стадиях, поэтому важно как можно раньше выявить заболевание. Джой Милн (Joy Milne) с ее феноменальным обонянием способна распознавать болезнь Паркинсона по запаху. Она чувствует «тяжелый мускусный запах», исходящий от пациентов с еще не диагностированной болезнью Паркинсона — иногда за 10 лет до диагноза. Ученые вместе с Джой пытаются создать тест для выявления болезни Паркинсона.
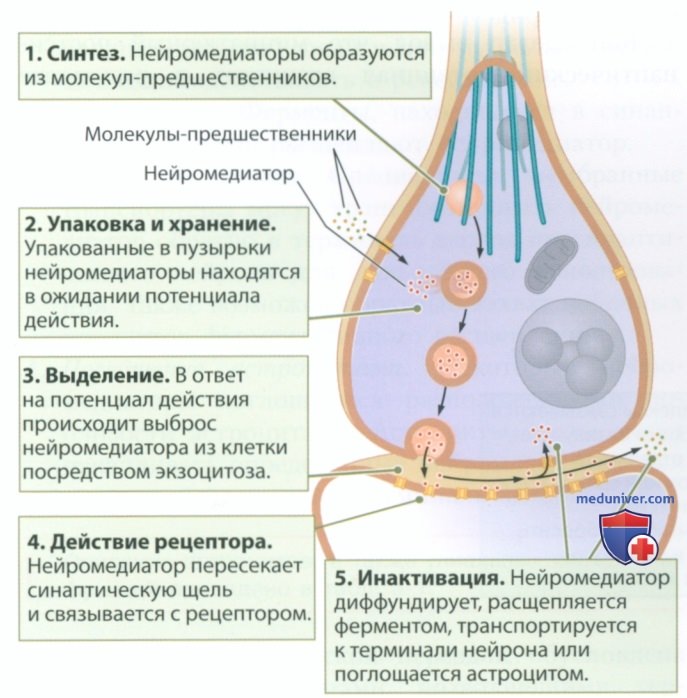
г) Этапы синаптической передачи. Антероградная синаптическая передача сигнала в химическом синапсе от пресинаптического нейрона к постсинаптическому происходит в пять этанов (рис. 3):
1. Синтез нейромедиатора внутри нейрона.
2. Упаковка нейромедиатора в везикулы и его хранение в области терминали аксона.
3. Транспорт нейромедиатора к пресинаптической мембране и его выделение в синаптическую щель в ответ на потенциал действия.
4. Связывание нейромедиатора с рецепторами на постсинаптической мембране, приводящее к их активации.
5. Расщепление или утилизация нейромедиатора, препятствующая его дальнейшему взаимодействию с рецептором.
Этапы 1 и 2. Синтез, упаковка и хранение нейромедиатора. Существует несколько классов нейромедиаторов. Синтез низкомолекулярных нейромедиаторов с использованием в основном поступающих с пищей «строительных материалов» происходит внутри терминали аксона. Транспортеры — это белковые молекулы, которые обеспечивают перемещение веществ между клеточными мембранами. Они отвечают за упаковку некоторых нейромедиаторов в пузырьки. Расположенные в терминали аксона митохондрии обеспечивают энергию, необходимую как для синтеза предшественников нейромедиаторов, так и для транспорта нейромедиаторов.
P.S. Основные типы нейромедиаторов — это низкомолекулярные, пептидные, липидные, газообразные и ионные нейромедиаторы. О них мы поговорим в следующей статье на сайте.
Упаковка в мембраны синтезируемых в теле нейрона в соответствии с записанными в ДНК инструкциями пептидных нейромедиаторов осуществляется в аппарате Гольджи, а за их транспорт к терминали аксона отвечают микротрубочки. Синтез пептидных нейромедиаторов с использованием транспортируемых в пресинаптическую часть мРНК обеспечивают рибосомы внутри терминали.
Липидные нейромедиаторы не могут быть упакованы в везикулы, которые тоже состоят из липидов. Они синтезируются «по запросу», когда потенциал действия достигает терминали аксона.
Ферменты обеспечивают выработку в клетках газообразных нейромедиаторов, однако они значительно отличаются от классических сигнальных молекул. Несмотря на регуляцию их выработки, газообразные нейромедиаторы способны проникать через клеточную мембрану, поэтому они не накапливаются внутри клетки.
Ионные нейромедиаторы не синтезируются в организме. Как и другие элементы тяжелее гелия, они образуются в недрах умирающих звезд. Тем не менее они могут накапливаться в синаптических пузырьках, зачастую вместе с нейромедиаторами других типов, а затем выделяться в синаптическую щель.
Независимо от происхождения нейромедиаторы, упакованные в везикулы для транспортировки, можно обнаружить на терминали аксона в трех положениях. Одни из них отпочковываются от эндосомы, другие прикрепляются к микрофиламентам (отдельный тип микротрубочек; см. рис. 2) внутри терминали, третьи располагаются на пресинаптической мембране — это соответствует этапам транспорта нейромедиатора к мембране для выброса в синаптическую щель.
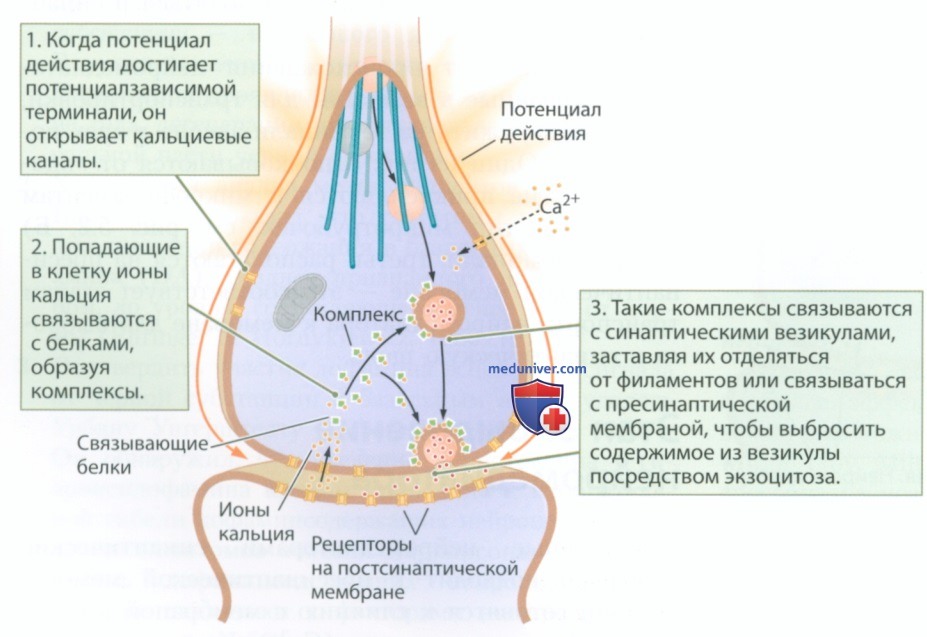
Этап 3. Выделение нейромедиатора. Заполненные нейромедиаторами синаптические пузырьки подходят к пресинаптической мембране. Они готовятся к слиянию с мембраной в ответ на приток ионов кальция (Са2+). Когда потенциал действия достигает пресинаптической мембраны, изменение мембранного потенциала запускает процесс выделения нейромедиатора. Ключевую роль играют катионы кальция. На пресинаптической мембране находится множество потенциалзависимых кальциевых каналов, а омывающая мембрану внеклеточная жидкость богата ионами Са2+. Как показано на рис. 4, потенциал действия открывает кальциевые каналы, обеспечивая приток ионов кальция в терминаль аксона.
Подготовленные синаптические пузырьки сливаются с пресинаптической мембраной в ответ на приток ионов кальция, выбрасывая содержимое в синаптическую щель посредством экзоцитоза. Везикулы из резервного пула или прикрепленные к филаментам (рециркулирующий или мобилизационный пулы) подходят к мембране, чтобы заменить опустевшие пузырьки.
Этап 4. Активация сайтов связывания на рецепторах. После выхода из синаптических пузырьков на пресинаптической мембране нейромедиатор диффундирует через синаптическую щель и связывается со специфическими белковыми молекулами, расположенными на постсинаптической мембране. Такие активируемые нейромедиатором рецепторы содержат сайты связывания нейромедиатора, о которых мы расскажем в отдельной статье на сайте. Свойства рецепторов постсинаптической мембраны определяют воздействие нейромедиатора на постсинаптическую клетку. Ионотропные рецепторы связаны с порами, которые обеспечивают транспорт ионов через мембрану, быстро изменяя мембранный потенциал одним из двух способов.
Такие ионные каналы могут вызывать приток в клетку ионов Na+, деполяризуя постсинаптическую мембрану и оказывая возбуждающее воздействие на постсинаптический нейрон. Они также могут создавать отток ионов К+ или приток ионов Cl+, обеспечивая гиперполяризацию постсинаптической мембраны и оказывая тормозное воздействие на постсинаптический нейрон.
При связывании с нейромедиатором рецепторы второго типа, называемые метаботропными рецепторами, могут активировать внутриклеточную систему вторичных посредников, которая, в свою очередь, может открывать ионные каналы, таким образом модулируя процессы возбуждения и торможения или воздействуя на другие функции воспринимающего нейрона.
Помимо рецепторов постсинаптической мембраны, нейромедиатор может взаимодействовать с рецепторами пресинаптической мембраны, воздействуя на только что выделившую его клетку. Таким образом, нейромедиатор может активировать пресинаптические рецепторы, называемые ауторецепторами, чтобы заставить их принимать сигналы от терминалей аксона той же клетки. Ауторецепторы выполняют важнейшую функцию — они являются компонентами механизмов отрицательной обратной связи, обеспечивающими передачу информации о необходимости настройки синаптической передачи.
Сколько нейромедиатора требуется для передачи сигнала? За ответ на этот вопрос Бернард Кац (Bernard Katz) был удостоен Нобелевской премии в 1970 г. При регистрации электрической активности постсинаптических мембран мышечных волокон он обнаружил кратковременную слабую деполяризацию, которая впоследствии была названа миниатюрным постсинаптическим потенциалом.
Кац сделал вывод, что миниатюрный постсинаптический потенциал возникает в результате выброса содержимого одного синаптического пузырька. Такую порцию молекул нейромедиатора он назвал квантом. Чтобы создать постсинаптический потенциал, достаточный для формирования постсинаптического потенциала действия, необходимо одновременное выделение пресинаптической клеткой множества таких квантов.
Результаты последующих экспериментов показали, что количество квантов нейромедиатора, высвобождаемых пресинаптической мембраной в ответ на отдельный потенциал действия, зависит от двух факторов: 1) количества ионов Са2+, поступающих внутрь терминали аксона в ответ на потенциал действия, и 2) числа подготовленных к выбросу синаптических пузырьков, скопившихся на мембране. Оба фактора имеют отношение к синаптической активности при обучении, которую мы рассмотрим в отдельной статье на сайте.
Этап 5. Инактивация нейромедиатора. Химический механизм синаптической передачи не был бы столь эффективным, если бы нейромедиатор задерживался в синаптической щели, продолжая стимулировать рецепторы. В этом случае постсинаптическая клетка не смогла бы ответить на сигнал, передаваемый пресинаптическим нейроном. Таким образом, выполнивший свою функцию нейромедиатор должен быть быстро удален от рецепторов и из синаптической щели. Инактивация нейромедиатора осуществляется не менее чем четырьмя способами:
1. Диффузия. Нейромедиатор диффундирует из синаптической щели и потому больше не может взаимодействовать с рецепторами.
2. Расщепление. Ферменты, находящиеся в синаптической щели, расщепляют нейромедиатор.
3. Обратный захват. Специфичные мембранные транспортеры могут транспортировать нейромедиатор обратно в терминаль аксона пресинапти-ческого нейрона для дальнейшего использования. Также возможен обратный захват побочных продуктов ферментативного расщепления.
4. Поглощение астроцитами. Некоторые нейромедиаторы поглощаются расположенными поблизости астроцитами. Астроциты также могут накапливать определенные нейромедиаторы для повторной доставки в терминаль аксона.
Гибкость синаптической передачи обусловлена химическими механизмами, позволяющими терминали аксона реагировать на частоту передаваемых ею сигналов. При высокой активности синапса выработка нейромедиатора увеличивается. При низкой активности синапса содержащиеся в пресинаптической терминали ферменты расщепляют излишки нейромедиатора. Побочные продукты расщепления используются повторно или удаляются из клетки. Терминаль аксона может передать в тело нейрона запрос на увеличение выработки нейромедиатора или молекул-предшественников.
г) Типы синапсов. Мы рассмотрели структуру типичного химического синапса и свойства, присущие большинству синапсов. В нервной системе встречается большое разнообразие синапсов.
Их классифицируют в соответствии с расположением, структурой, функцией и клеткой-мишенью. Рисунок 5 иллюстрирует разнообразие синапсов на примере одного нейрона.
Вы уже знакомы с двумя видами химических синапсов. Первый тип — это нервно-мышечный синапс, который образован окончанием аксона и концевой пластинкой мышечного волокна. Нейромедиатором в таком синапсе является ацетилхолин. Второй тип — это аксо-дендритный синапс, изображенный на рис. 2: терминаль аксона нейрона образует синаптическое соединение с дендритом или дендритным шипиком другого нейрона.
На рисунке 5 изображены аксо-дендритный (с дендритом), аксо-соматический (с телом нейрона), аксо-аксональный (с другим аксоном) и аксо-синаптический (с другой пресинаптической терминалью, то есть с синаптическим соединением между другим аксоном и его мишенью) синапсы. Аксо-внеклеточные синапсы не имеют специфических мишеней, вместо этого они выделяют нейромедиаторы во внеклеточную жидкость. А в аксо-вазальном синапсе (нейросекреторном) терминаль нейросекреторного нейрона образует синаптическое соединение с капилляром и выделяет нейромедиатор непосредственно в кровь. Следует отметить, что синаптические соединения могут образовывать не только терминали аксонов. Дендриты могут обмениваться информацией с другими дендритами, образуя дендро-дендритные синапсы.
Такое разнообразие соединений превращает синапс в универсальную систему доставки химических веществ. Синапсы могут доставлять нейромедиаторы к специфическим сайтам или обеспечивать их диффузию. Синаптические соединения с дендритами, телом нейрона или аксоном позволяют контролировать функции нейрона различными способами.
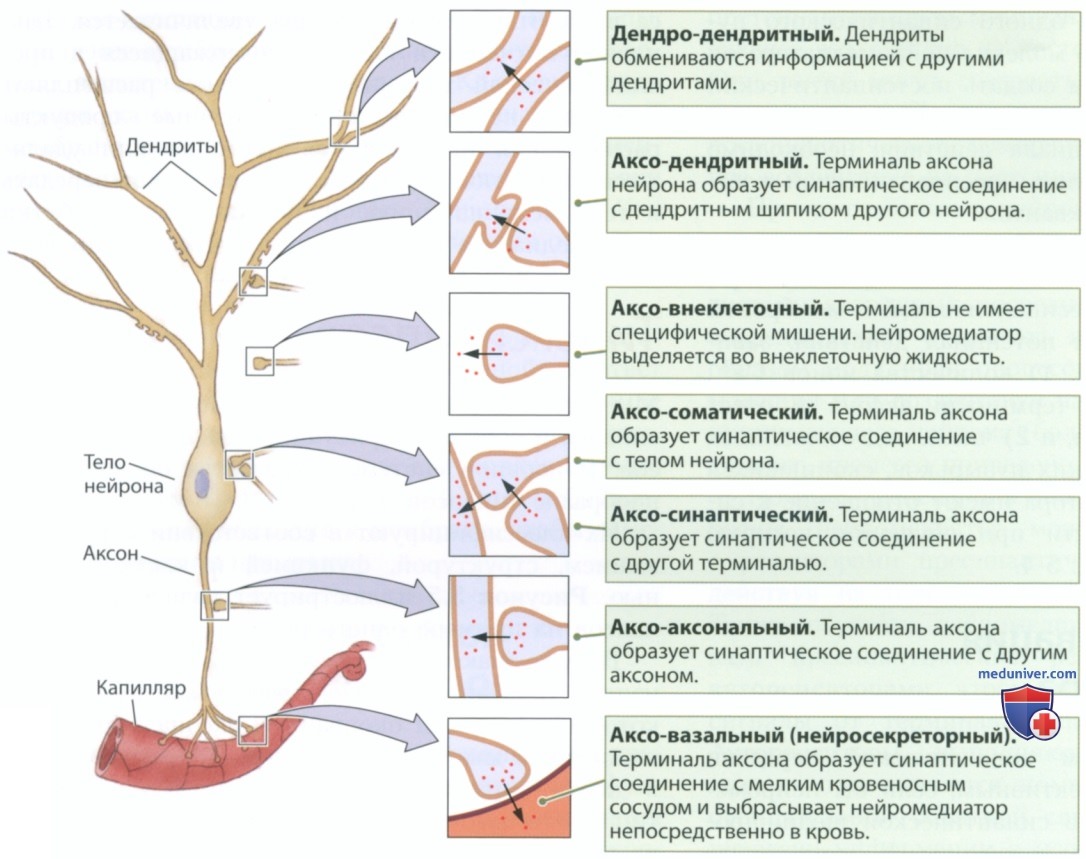
Аксо-синаптический синапс позволяет контролировать прием нейроном сигнала от другого нейрона. Экскреция нейромедиатора во внеклеточную жидкость или кровь в аксо-внеклеточных и аксо-вазальных синапсах позволяет модулировать функцию больших участков мозга и даже всего организма в целом. Многие секретируемые нейронами нейромедиаторы выполняют функцию циркулирующих в крови гормонов, которые влияют на все органы и системы организма.
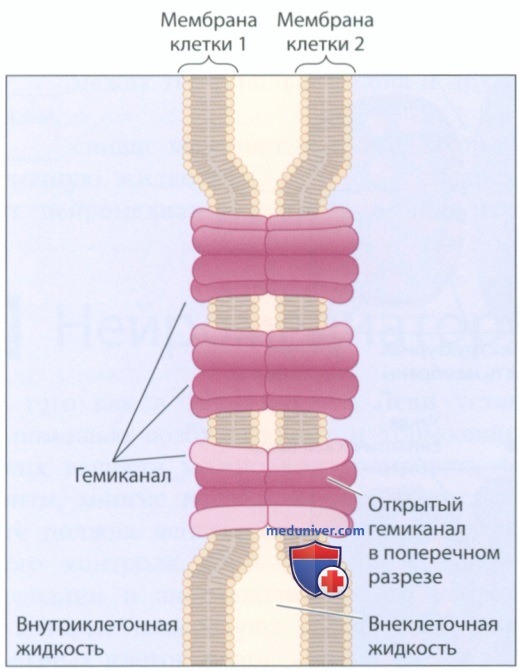
1. Электрические синапсы. Химические синапсы наиболее часто встречаются в нервной системе млекопитающих, однако это не единственный тип синапсов. Некоторые нейроны взаимодействуют друг с другом с помощью электрических сигналов, образуя электрические синапсы, или щелевые контакты, которые обеспечивают непосредственный контакт между цитоплазмами двух нейронов (рис. 6). Щелевой контакт образуется благодаря мембранным белкам коннек-синам, которые образуют гемиканал (полуканал), соединенный с гемиканалом на мембране соседней клетки. Пересекающий мембраны обеих клеток канал позволяет ионам свободно течь из одного нейрона в другой в обоих направлениях.
Щелевые контакты состоят из гемиканалов, которые могут находиться как в открытом, так и в закрытом состоянии. Щелевые контакты обеспечивают передачу информации без задержки, свойственной химической синаптической передаче (около 5 мс на каждый синапс) — вы можете сравнить расстояние между пресинаптической терминалью и дендритным шипиком на рис. 2 со схемой на рис. 3. Например, щелевые контакты речного рака обеспечивают движение хвоста, то есть ответ, позволяющий животному ускользнуть от хищника. Щелевые контакты также присутствуют в мозге млекопитающих — в некоторых областях они отвечают за синхронизацию ритмических разрядов вставочных нейронов. Щелевые контакты также позволяют нейронам обмениваться химическими веществами с глиальными клетками (Dere & Zlomuzica, 2012).
Щелевые контакты могут быть разными. Различные субъединицы коннексинов образуют поры разного размера, способные избирательно пропускать специфические мелкие молекулы. Крупные биомолекулы, такие как нуклеиновые кислоты и белки, не могут проникнуть через поры щелевого контакта.
Щелевые контакты еще больше увеличивают разнообразие сигналов, которыми обмениваются нейроны. Такой обмен информацией обеспечивают дендро-дендритные и аксо-аксональные щелевые контакты. Следует отметить, что щелевые контакты синаптических соединений между терминалями аксонов и дендритами или телами нейронов позволяют одновременно обмениваться химическими и электрическими сигналами. Такие синапсы «смешанного» типа были обнаружены совсем недавно, и их функция в ЦНС млекопитающих пока не изучена (Nagy et al., 2017).
Если химические синапсы передают информацию медленнее, почему же у млекопитающих они обладают над щелевыми контактами? Ответ состоит в том, что химические синапсы обладают пластичностью — они могут усиливать или ослаблять сигнал, передаваемый нейроном другому нейрону. Кроме того, они могут менять сигналы в зависимости от пережитого опыта, таким образом участвуя в обучении. Щелевые контакты не обладают такой пластичностью, они предназначены для быстрого и эффективного обмена информацией.
д) Возбуждающие и тормозные сигналы. Нейромедиатор может влиять на функционирование нейрона посредством огромного разнообразия механизмов. Однако, воздействуя напрямую на электрическую активность нейрона через рецепторы, нейромедиатор может вызывать только один из двух эффектов. Он влияет на поток ионов через мембрану, увеличивая или уменьшая вероятность формирования потенциала действия клеткой, с которой он контактирует. Таким образом, несмотря на большое разнообразие типов синапсов, все они обеспечивают передачу сигналов только двух типов — возбуждающих и тормозных. Строго говоря, нейромедиаторы сами по себе не определяют, будет сигнал возбуждающим или тормозным. Как уже было сказано в начале этого раздела, все зависит от связанного с рецептором ионного канала.
P.S. Каждый нейрон ежесекундно принимает тысячи возбуждающих и тормозных сигналов. Принцип 10 гласит: «Нервная система функционирует благодаря чередованию процессов возбуждения и торможения».
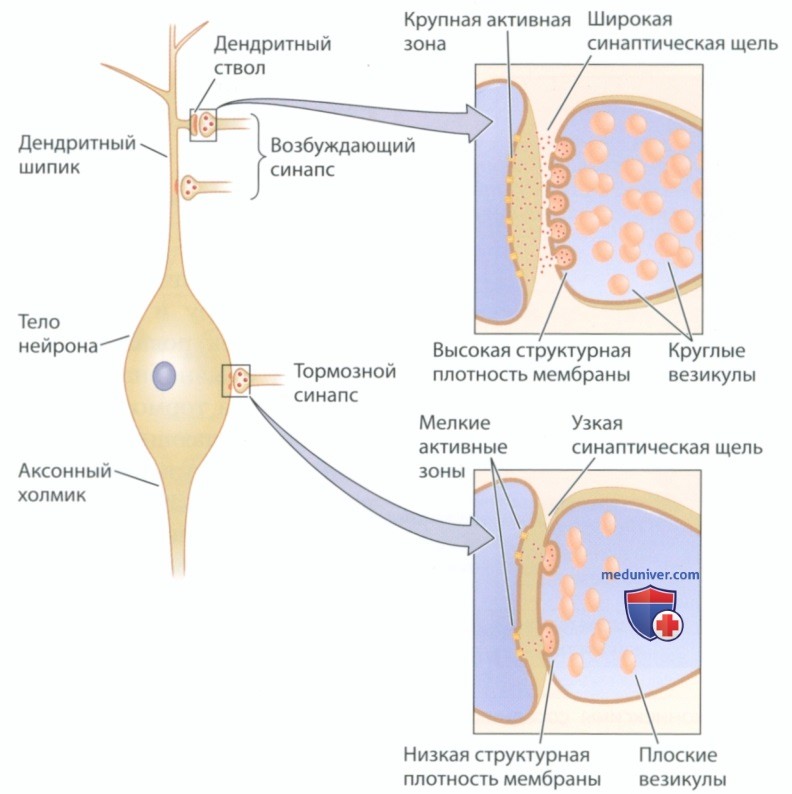
Возбуждающие и тормозные синапсы имеют разную структуру и располагаются в разных отделах нейрона. Как показано на рис. 7, возбуждающие синапсы обычно находятся на стволах и шипиках дендритов, а тормозные синапсы — на телах нейронов. Возбуждающие синапсы содержат круглые синаптические пузырьки, а в тормозных синапсах они плоские. Структурная плотность пресинаптической и постсинаптической мембран в возбуждающем синапсе выше, чем в тормозном. Кроме того, для возбуждающего синапса характерна более широкая синаптическая щель, а активная зона возбуждающего синапса крупнее активной зоны тормозного синапса.
Различия в расположении возбуждающих и тормозных синапсов делят нейрон на две зоны -обеспечивающее возбуждение дендритное дерево и обеспечивающее торможение тело нейрона. Давайте рассмотрим взаимодействие возбуждающих и тормозных сигналов с двух точек зрения. Если рассматривать его с точки зрения торможения, можно представить, как возникающее на дендритах возбуждение распространяется за аксонный холмик, чтобы создать потенциал действия на начальном сегменте. Если передачу сигнала необходимо остановить, это лучше всего осуществить путем торможения тела нейрона рядом с начальным сегментом. В такой модели взаимодействия процессов возбуждения и торможения торможение подавляет возбуждение, используя стратегию «задержим его на выходе».
Согласно другой концепции взаимодействия процессов возбуждения и торможения, возбуждение преобладает над торможением. В действительности, возбуждающие синапсы, расположенные вдали от тела нейрона, достаточно крупные, чтобы противостоять затуханию сигнала по мере его распространения (Magee & Cook, 2000).
P.S. К утрате определенной формы поведения приводит связанное с заболеванием нарушение процессов возбуждения, а неконтролируемые формы поведения возникают из-за нарушения процессов торможения.
Если тело нейрона обычно находится в состоянии торможения, единственный способ сформировать потенциал действия — нейтрализовать торможение тела нейрона. Стратегия «откроем ворота» позволяет представить себе возбуждающий сигнал в виде скаковой лошади, которая готова стартовать, но только после того, как откроются мешающие ей стартовые ворота.
е) Эволюция сложных систем синаптической передачи. Рассмотрев все биохимические процессы, необходимые для передачи информации через синапс, и различные типы синапсов, мы можем задаться вопросами: почему и, главное, как в процессе эволюции сформировалась такая сложная система коммуникации? Откуда берутся нейромедиаторы?
Чтобы понять, как образуются необходимые для нейронной коммуникации вещества, давайте вспомним, как питаются примитивные одноклеточные организмы. Древнейшие одноклеточные организмы выделяли секрет, облегчающий иммобилизацию и переваривание бактерий. Такой пищеварительный секрет выделялся из клетки посредством эк-зоцитоза — вакуоль или везикула прикреплялась к клеточной мембране, а затем выбрасывала содержимое во внеклеточное пространство. Захват иммобилизованной добычи осуществлялся посредством эндоцитоза.
Механизм экзоцитоза при выделении пищеварительного секрета одноклеточным организмом аналогичен процессу выброса необходимого для коммуникации нейромедиатора у более сложно устроенных организмов. Вполне возможно, что в процессе эволюции такой примитивный вариант переваривания пищи трансформировался в процессы нейронной коммуникации у сложно устроенных многоклеточных организмов.
ж) Вопросы для самоконтроля. Прежде чем продолжить, проверьте себя.
1. У млекопитающих обмен информацией между нейронами осуществляется преимущественно посредством _______, несмотря на то что они медленнее передают сигнал и обладают более сложной структурой, чем.
2. Основным преимуществом химических синапсов по сравнению с электрическими является то, что они могут меняться _______, меняя сигналы и таким образом участвуя в.
3. В процессе эволюции в нервной системе возникло множество типов синапсов:
_______ между терминалью аксона и дендритом,
_______ между терминалью аксона и телом нейрона,
_______ между терминалью аксона и мышечным волокном, _______ между терминалью аксона и другим аксоном,
_______ между терминалью аксона и другим синапсом.
_______ синапс выделяет нейромедиатор во внеклеточную жидкость, _______ синапс выделяет нейромедиатор в кровь в виде гормона, а _______ синапс обеспечивает соединение дендрита с другим дендритом.
4. Возбуждающие синапсы обычно располагаются на _______, а тормозные синапсы - на _______.
5. Опишите пять этапов синаптической передачи для химического синапса.
з) Ответы на вопросы для самоконтроля:
1. Химических синапсов; щелевые контакты.
2. В зависимости от пережитого опыта; обучении.
3. Аксо-дендритический; аксо-соматический; нервно-мышечный; аксо-аксональный; аксо-синап-тический; аксо-внеклеточный; аксо-вазальный; дендро-дендритический.
4. Дендритах; телах нейронов.
5. 1) Синтез нейромедиатора внутри нейрона.
2) Упаковка нейромедиатора в везикулы и его хранение в области терминали аксона.
3) Транспорт нейромедиатора к пресинаптической мембране и его выделение в синаптическую щель в ответ на потенциал действия.
4) Связывание нейромедиатора с рецепторами на постсинаптической мембране, приводящее к их активации.
5) Расщепление или удаление нейромедиатора из синаптической щели.
Видео строение синапса
- Читать далее "Нейромедиаторы и их рецепторы"
Редактор: Искандер Милевски. Дата публикации: 19.7.2023
