Нейронные механизмы сна - с точки зрения нейрофизиологии
На протяжении многих лет природу сна пытаются объяснить присутствием в мозге вызывающего сон вещества. В поддержку этой гипотезы говорит способность многих химических веществ вызывать сон. К таким веществам относят седативные и снотворные препараты, а также морфин.
Однако имеющиеся данные о циркадных ритмах указывают на то, что свой вклад в формирование цикла сон—бодрствование вносят как различные нейрохимические вещества и гормоны, так и метаболическая активность большинства клеток организма.
Секретируемый эпифизом в темное время суток гормон мелатонин вызывает сонливость. Синтетический мелатонин можно использовать как снотворное; таким образом, мелатонин можно рассматривать как вызывающее сон вещество. Однако удаление эпифиза не приводит к исчезновению сна. Мелатонин и многие другие химические вещества могут вносить свой вклад в формирование сна, но не вызывать сон.
Ряд наблюдений говорит о том, что сон вызывает не циркулирующее в крови вещество. У дельфинов и птиц одновременно спит только одно полушарие. Вероятно, такая особенность позволяет второму полушарию оставаться настороже. Это указывает на то, что сон обусловлен активностью определенной зоны мозга в каждом из полушарий. Если бы сон вызывало некое циркулирующее в крови химическое вещество, то оба полушария засыпали бы одновременно, поскольку за кровоснабжение полушарий отвечает одна и та же кровеносная система.
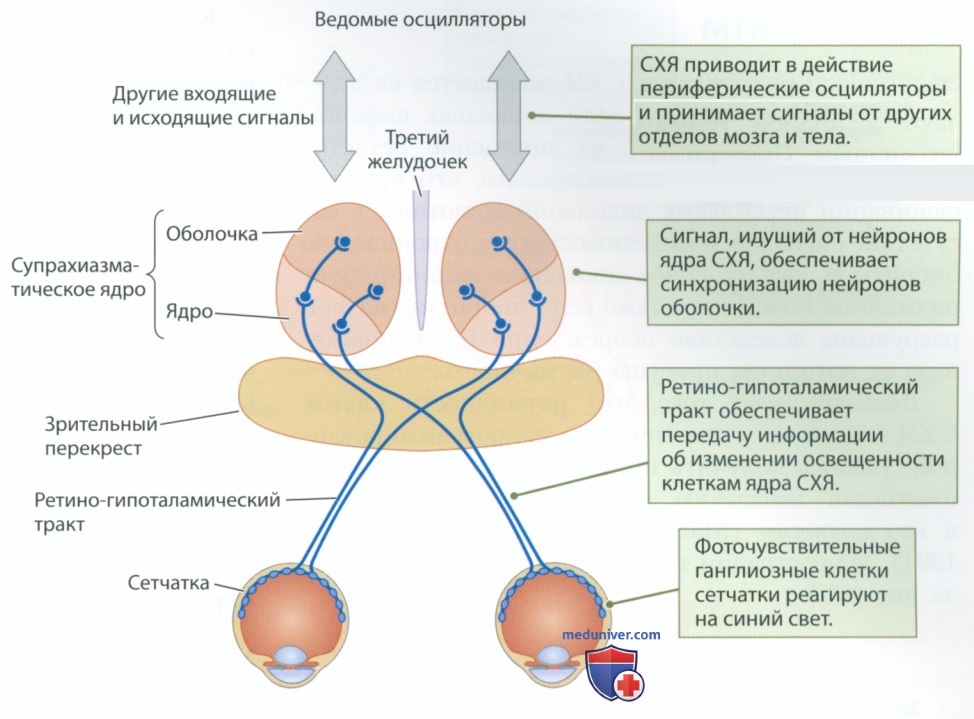
В этом разделе мы рассмотрим регулирующие сон нейронные механизмы. Сначала мы расскажем о доказательствах участия в организации сна ведомого осциллятора супрахиазматического ядра (см. рис. ниже). Затем мы обсудим данные о том, что различные связанные со сном события регулируют ядра ствола мозга, отдельные области которых участвуют в организации медленноволнового и быстроволнового сна.
а) Ретикулярная активирующая система и сон. Новаторский эксперимент, проведенный Джузеппе Моруцци и Горацием Мэгуном (Giuseppe Moruzzi, Horace Magoun, 1949), позволил ответить на вопрос, какие области мозга участвуют в регуляции сна. Исследователи регистрировали ЭЭГ коры головного мозга у наркотизированных кошек во время электростимуляции ствола мозга. К их удивлению, они обнаружили, что в ответ на электростимуляцию типичные для наркоза высокоамплитудные медленные колебания сменялись характерным для состояния бодрствования быстрым бета-ритмом.
ЭЭГ бодрствования сохранялась и после завершения стимуляции. Это означало, что данный эффект не был обусловлен текущей активностью нейронов в области стимулирующего электрода — нейроны могли обеспечивать такой эффект независимо от стимуляции. Во время «периода бодрствования» у находившейся под наркозом кошки не возникали поведенческие признаки бодрствования, однако ритм ЭЭГ соответствовал состоянию бодрствования.
У обычной спящей кошки такая стимуляция приводила к пробуждению.
Последующие эксперименты показали, что за формирование ЭЭГ бодрствования и соответствующего бодрствованию поведения отвечает обширная область, идущая вдоль оси ствола мозга. Данная область образована ядрами клеток и образующими сеть нервными волокнами. Моруцци и Мэгун назвали эту область ствола мозга ретикулярной активирующей системой (РАС), или ретикулярной формацией, и предположили, что она отвечает за поведение, связанное со сном и бодрствованием. Расположение ретикулярной формации представлено на рис. 1.
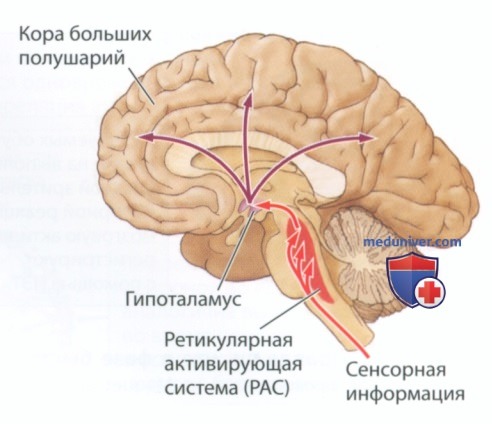
Если кто-то потревожит вас во время сна, вы, скорее всего, проснетесь. Чтобы удостовериться, что этот выявленный в процессе эксперимента эффект не был вызван сенсорной стимуляцией, Моруцци и Мэгун перерезали ствол мозга непосредственно под ретикулярной формацией, таким образом обрывая подходящие к нему сенсорные проводящие пути. Стимуляция РАС, по-прежнему, приводила к десинхронизации ритма ЭЭГ, показывая, что именно она отвечает за пробуждение. Из этого следует, что в норме причиной пробуждения является активация ретикулярной формации.
Гипотеза о том, что за бодрствование отвечает ствол мозга, позволяет объяснить, почему повреждения ствола мозга могут приводить к коме — напоминающему сон устойчивому нарушению сознания. Широко известен случай 21-летней девушки по имени Карен Энн Куинлен (Karen Ann Quinlan), которая приняла небольшую дозу транквилизатора и выпила несколько порций алкоголя на вечеринке по случаю дня рождения, после чего впала в кому из-за повреждения РАС (Quinlan & Quinlan, 1977).
Ее госпитализировали, подключили к аппарату ИВЛ; кормление осуществляли через зонд. Ее семья затеяла долгую судебную тяжбу, добиваясь отключения девушки от системы жизнеобеспечения. В конце концов Верховный суд Нью-Джерси вынес положительное решение. Однако после отключения от аппарата ИВЛ Карен Энн прожила еще 10 лет, продолжая находиться в коме и по-прежнему получая питание через зонд.
б) Нейронные механизмы связанных с бодрствованием изменений ритма ЭЭГ. Эксперименты, в основу которых легли новаторские исследования активирующих функций ретикулярной формации, позволили обнаружить в стволе мозга другие системы, которые участвуют в регуляции связанного со сном и бодрствованием поведения. Кейс Вандервольф (Case Vanderwolf, 2002) установил, что за формирование ЭЭГ бодрствования отвечают как минимум две системы ствола мозга. Их расположение в мозге крысы представлено на рис. 2.
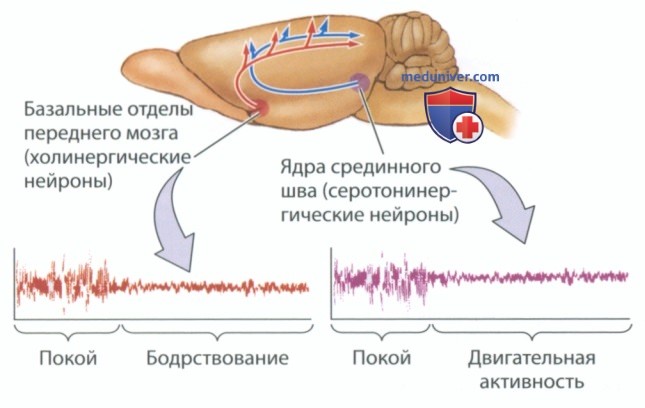
В базальных отделах переднего мозга располагаются крупные холинергические нейроны. Терминали таких нейронов высвобождают воздействующий на нейроны коры больших полушарий ацетилхолин, обеспечивая формирование соответствующего бодрствованию бета-ритма в ЭЭГ. Такая активность обычно связана с бодрствованием и неподвижностью, например с поведением, которое связано с концентрацией внимания. Одна из структур среднего мозга — срединный шов, включающий ядра серотонинергического нейрона, диффузно рассредоточенные аксоны которых проецируются на кору больших полушарий.
Там они стимулируют клетки коры, обеспечивая формирование бета-ритма ЭЭГ. Такая активность обычно связана с движением, например с ходьбой.
Несмотря на то что оба пути обеспечивают формирование схожих паттернов ЭЭГ бодрствования, они по-разному связаны с поведением. Если активность холинергических волокон блокирована вследствие воздействия препарата или повреждения нейронов базальных отделов переднего мозга, ЭЭГ бодрствования, в норме регистрируемая у неподвижной крысы, сменяется ЭЭГ-ритмом, напоминающим ритм, характерный для фазы медленноволнового сна. ЭЭГ бодрствования, отведенная от коры, может быть получена только в том случае, если крыса ходит или совершает какие-либо другие действия.
Такие результаты, представленные на рис. 2, показывают, что активация холинергической системы отвечает за появление ЭЭГ-ритма, соответствующего бодрствованию в состоянии неподвижности, а активация серотонинергической системы отвечает за формирование связанного с движением ЭЭГ-ритма.
Базальные отделы переднего мозга и ядра срединного шва не отвечают за формирование поведения. В действительности после фармакологической или хирургической деструкции обеих структур крыса по-прежнему может стоять и ходить. Однако регистрируемый у крысы ритм ЭЭГ всегда остается похожим на ЭЭГ-ритм спящего животного.
Пока активирующая система обеспечивает формирование ЭЭГ бодрствования, крыса сохраняет способность обучаться выполнению простых заданий. Однако в случае разрушения обеих систем животное по-прежнему может ходить, но теряет способность к обучению и разумному поведению. В некотором смысле кора больших полушарий похожа на дом, в котором система освещения питается от двух отдельных источников. Для того чтобы в доме стало темно, должны выйти из строя оба источника. Если работает хотя бы один источник, свет продолжает гореть.
Экспериментальные данные показывают, что РАС генерирует возбуждение, влияя на активность двух рассмотренных выше путей, которые, в свою очередь, обеспечивают формирование связанных с бодрствованием паттернов ЭЭГ. У человека базальные отделы переднего мозга и ядра срединного шва по-видимому обеспечивают десинхронизацию ЭЭГ, как и у крыс. Соответственно, когда мы бодрствуем и находимся в состоянии неподвижности, у нас происходит активация холинергических нейронов; когда мы двигаемся, у нас также активируются серотонинергические нейроны.
Вероятно, когда вы чувствовали сонливость (например, на уроке или за рулем), вам удавалось бороться со сном с помощью движения — покачивания головой или потягивания. По-видимому, когда вы сидели неподвижно, ваш уровень бодрствования снижался вследствие инактивации холинергических нейронов. Когда вы двигались, активация ваших серотонинергических нейронов обеспечивала восстановление уровня бодрствования. Когда мы засыпаем, у нас наблюдается снижение активности как холинергических, так и серотонинергических нейронов, что позволяет коре больших полушарий генерировать медленные волны.
в) Нейронные механизмы быстрого сна. Барбара Джонс (Barbara Jones, 1993) и ее коллеги описали называемое перибрахиальной областью (ядром) скопление отвечающих за быстрый сон холинергических нейронов. Эта структура расположена в дорсальной части ствола мозга непосредственно перед мозжечком (рис. 3). Джонс выборочно разрушала перибрахиальные нейроны, орошая их нейротоксином — каиновой кислотой. Она обнаружила, что после разрушения этих нейронов доля быстрого сна резко уменьшилась. Результаты эксперимента позволяют предположить, что пери-брахиальное пространство отвечает за быстрый сон и связанные с этой стадией сна формы поведения.
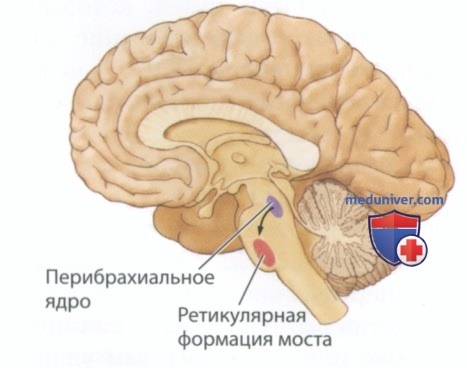
Перибрахиальное ядро простирается вентрально до медиальной ретикулярной формации моста (MPRF; от англ, medial pontine reticular formation), изображенной на рис. 3. Поражение данной структуры приводит к нарушению быстроволнового сна, а впрыскивание в эту область агониста холинергических рецепторов (препарата, действующего как ацетилхолин) индуцирует переход в фазу быстрого сна.
Если за быстрый сон отвечают и перибрахиальное ядро, и медиальная ретикулярная формация моста, из-за чего возникают другие связанные с быстрым (парадоксальным) сном явления: картина на ЭЭГ как при бодрствовании, быстрые движения глаз (БДГ) и атония? Ответ на этот вопрос представлен на рис. 4, демонстрирующем, как происходит индукция связанных с быстрым сном событий:
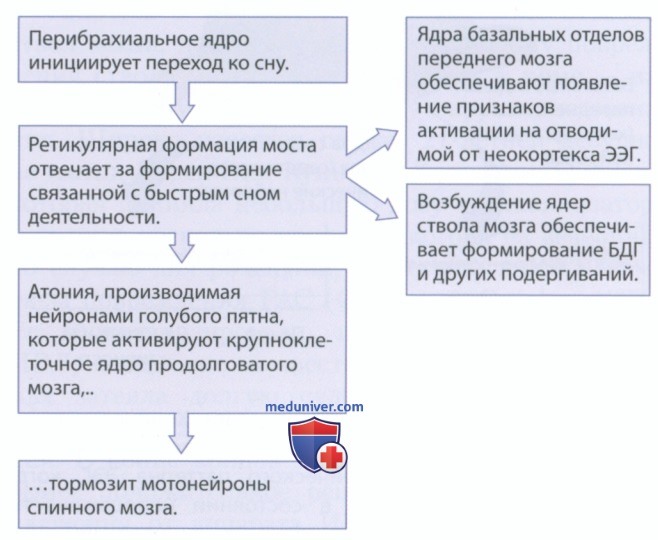
• перибрахиальное ядро инициирует переход в фазу быстроволнового сна, активируя нейроны медиальной ретикулярной формации моста;
• ретикулярная формация обеспечивает возбуждение холинергических нейронов базальных отделов переднего мозга, которое приводит к появлению признаков активации на отводимой от коры ЭЭГ;
• ретикулярная формация также возбуждает двигательные ядра ствола мозга, обеспечивающие генерацию быстрых движений глаз и других подергиваний;
• атония в фазе быстрого сна возникает при возбуждении ядра, прилежащего к голубому пятну (nucleus subcoeruleus), которое активируется через входы от медиальной ретикулярной формации моста и располагается непосредственно за ней;
• ядро, прилежащее к голубому пятну (nucleus subcoeruleus), обеспечивает возбуждение крупноклеточного ядра продолговатого мозга, которое проецируется на мотонейроны спинного мозга и тормозит их — это приводит к параличу мышц в фазе быстрого сна.
Получить доказательства существования такого нейронного механизма удалось Мишелю Жуве (Michel Jouvet, 1972), который обнаружил, что кошки с повреждениями голубого пятна демонстрируют необычное поведение в фазе быстрого сна. Вместо того чтобы лежать, вытянувшись из-за атонии, которая обычно возникает в фазе быстрого сна, кошки вставали, смотрели по сторонам и двигались, пытаясь поймать воображаемую мышь или убежать от воображаемой опасности. По-видимому, когда кошкам с повреждениями в этой области мозга снится, что они ловят мышей или убегают от опасности, они воспроизводят сюжеты своих сновидений.
Мы вернемся к описанному Жуве феномену в следующем разделе, который рассказывает о расстройствах сна.
г) Закрепление изученного. Прежде чем продолжить, проверьте себя.
1. ______ , расположенная в стволе мозга, связана с медленым сном и бодрствованием.
2. Повреждение РАС приводит к ______ .
3. Перибрахиальное ядро и медиальная ретикулярная формация моста, а также активирующие нервные пути, идущие к неокортексу и спинному мозгу, отвечают за формирование поведения, связанного с ______ сном.
4. Кошки с повреждениями ______ воспроизводят сюжеты своих сновидений.
5. Почему двигательная активность может поддержать у вас уровень бодрствования, если вас начнет клонить ко сну в неподходящее время?
д) Ответы на вопросы для самоконтроля:
1. Ретикулярная активирующая система (РАС).
2. Коме.
3. Быстроволновым сном.
4. Ядро, прилежащее к голубому пятну.
5. У нас есть отдельные нейронные системы, обеспечивающие поддержание бодрствования, когда мы сохраняем неподвижность (холинергическая система) и двигаемся (серотонинергическая система). Движение возбуждает серотонинергические нейроны, восстанавливая уровень бодрствования.
- Читать далее "Расстройства сна - с точки зрения нейрофизиологии"
Редактор: Искандер Милевски. Дата публикации: 29.10.2023
- Сновидения - с точки зрения нейрофизиологии
- Сон как биологическая адаптация - с точки зрения нейрофизиологии
- Сон как восстановительный процесс - с точки зрения нейрофизиологии
- Сон и сохранение воспоминаний - с точки зрения нейрофизиологии
- Нейронные механизмы сна - с точки зрения нейрофизиологии
- Расстройства сна - с точки зрения нейрофизиологии
- Что сон может рассказать о сознании - с точки зрения нейрофизиологии
- Резюме по нейрофизиологии сна и сновидений
- Коррекция дислексии - с точки зрения нейрофизиологии
- Изучение научения и памяти в лабораторных условиях - с точки зрения нейрофизиологии
