Показания амиодарона, его противопоказания и побочные эффекты
Амиодарон — производное бензофурана. Препарат одобрен FDA для лечения пациентов с жизнеугрожающими ЖТА, когда другие препараты не эффективны или плохо переносятся пациентом. Дронедарон, нейодированное производное амиодарона, рассматривается как возможная и менее токсичная альтернатива амиодарону. Дронедарон обладает похожей эффективностью и более безопасен, чем амиодарон. На момент издания этой книги препарат еще не был одобрен для применения в США.
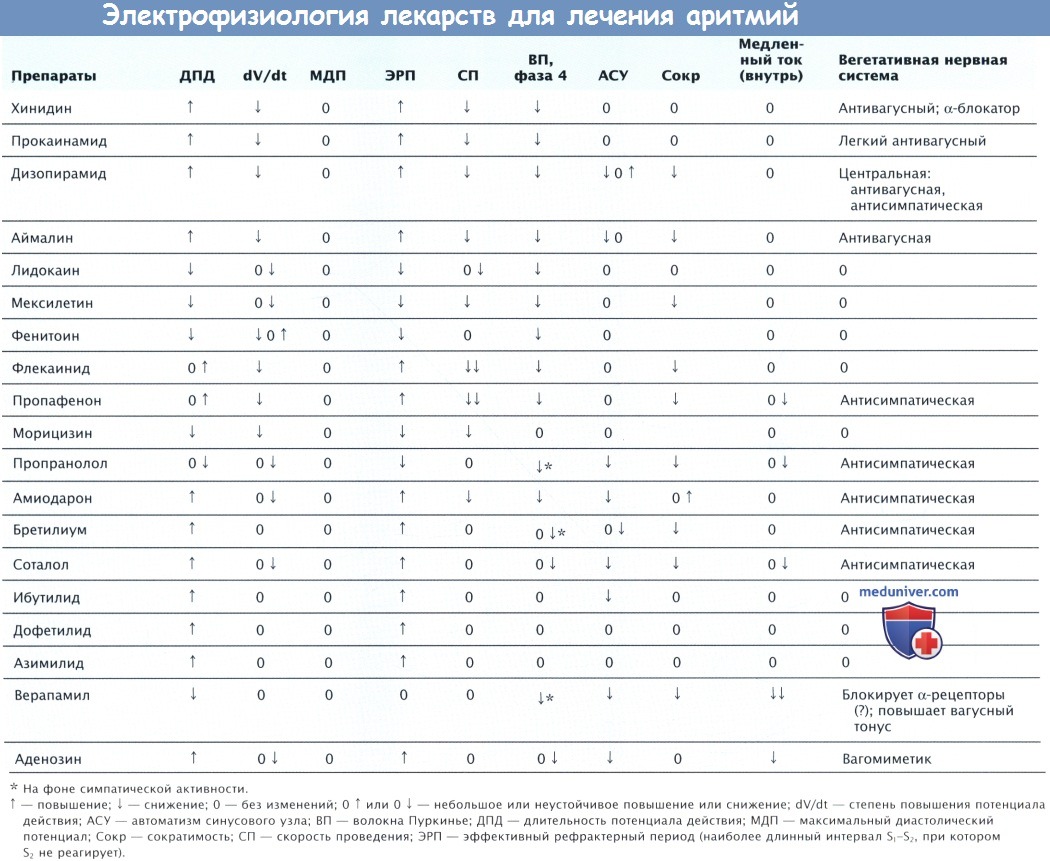
а) Механизм действия амиодарона. При постоянном приеме per os амиодарон удлиняет ДПД и рефрактерность всех сердечных волокон, не влияя на мембранный потенциал покоя. При исследовании немедленного действия амиодарона и его метаболита дезэтиламиодарона было выявлено, что они удлиняли ДПД миокарда желудочков, но укорачивали ДПД волокон Пуркинье. Если ввести амиодарон в артерии СУ и АВ-узла, произойдет снижение синусовой и синаптической скорости импульсов и удлинение проводимости АВ-узла.
Препарат снижает Vmax в миокарде желудочков в зависимости от скорости и частоты, блокируя неактивные натриевые каналы. Это действие усиливается при деполяризации и уменьшается при гиперполяризации МП. Амиодарон уменьшает проводимость при быстрой ЧСС в большей степени, чем при медленной (частотная зависимость), но не только из-за уменьшения Vmax, но и из-за повышения резистентности к пассивному току. Амиодарон не продлевает реполяризацию в основном при медленной ЧСС, чем при быстрой (т.е. отсутствует обратная частотная зависимость), но оказывает зависимое от времени влияние на рефрактерность, что частично объясняет высокую антиаритмическую эффективность и низкую частоту развития тахикардии torsades de pointes.
Дезэтиламиодарон обладает относительно большим влиянием на быстрые тканевые каналы и, возможно, способствует оказанию антиаритмического эффекта. Задержкой в связи с образованием оптимальной концентрации метаболита можно частично объяснить замедление антиаритмического действия амиодарона.
Амиодарон — внеконкурентный антагонист α- и β-АР, который блокирует превращение тироксина (ТД в трийодтиронин (Т3), что может объяснить некоторые его электрофизиологические эффекты. Амиодарон блокирует медленные каналы, а постоянный прием препарата peros замедляет спонтанные импульсы СУ у собак, находящихся под анестезией, даже после первоначального лечения их пропранололом и атропином. При приеме антиаритмического препарата (ААП) per os происходит замедление импульсов скорости СУ на 20-30% и удлинение интервала QT, при этом изменяется конфигурация Т-волны и создается U-волна.
ЭРП во всех тканях сердца увеличен. Время проведения в системе Гиса-Пуркинье увеличивается так же, как и длительность комплексов QRS, особенно при высокой ЧСС. Амиодарон при в/в введении удлиняет рефрактерный период миокарда предсердий и желудочков. Интервал PR и время АВ-узлового проведения увеличиваются. Длительность комплекса QRS увеличивается при повышенной ЧСС, но в меньшей степени, чем при приеме препарата per os. Таким образом, при в/в введении препарата меньше увеличивается время проводимости (за исключением АВ-узла), длительность реполяризации и рефрактерность по сравнению с приемом per os.
Исходя из этого становится ясно, что амиодарон обладает эффектами класса I (блокирование INa), класса II (антиадренергическим) и класса IV (блокирование ICa.L) помимо влияния класса III (блокирование IK). Амиодарон по своим свойствам близок к теоретически идеальному препарату, который блокирует натриевые каналы в зависимости от частоты с быстрым диастолическим восстановлением после блокады и пролонгирует ДПД в режиме частотной зависимости. Он не увеличивает, а даже уменьшает дисперсию интервала QТ. На некоторые эффекты амиодарона могут влиять катехоламины.
б) Гемодинамические эффекты. Амиодарон является периферическим и коронарным вазодилататором. При в/в введении (150 мг за 10 мин, далее 1 мг/мин) амиодарон снижает ЧСС, ОПСС, силу сокращения ЛЖ и dP/dt ЛЖ. Дозы амиодарона per os, достаточные для контроля сердечных аритмий, не снижают ФВ ЛЖ даже у пациентов со сниженной ФВ; при этом ФВ и СВ могут несколько повышаться. Однако из-за антиадренергического действия и небольшого отрицательного инотропного влияния амиодарон следует назначать с осторожностью, особенно при в/в введении пациентам с критической сердечной декомпенсацией.
в) Фармакокинетика. Амиодарон абсорбируется медленно, разным образом и неполностью, системная биовалентность составляет от 35 до 65%. Пиковая концентрация в плазме достигается через 3-7 час после одной дозы per os. Первичная инактивация минимальна, что свидетельствует о малом выведении через печень. Препарат выводится из организма путем печеночной экскреции в желчь с небольшой энтерогеиатической рециркуляцией. Выраженный печеночный метаболизм происходит с образованием дезэтиламиодарона как основного метаболита. Оба вещества аккумулируются в печени, легких, жировой клетчатке, «голубой» коже и в других тканях.
В миокарде его можно найти в концентрации в 10-50 раз выше, чем в плазме. Клиренс амиодарона в плазме проходит медленно, а выведение его через почки ничтожно. У пациентов с заболеванием ночек дозу следует снижать. Амиодарон и дезэтиламиодарон не поддаются диализу. Объем распределения велик, но различен (в среднем 60 л/кг). Амиодарон в значительной степени связан с белком (96%), проникает через плаценту (10-50%) и попадает в грудное молоко.
Действовать препарат начинает обычно через 1-2 час после в/в введения. После приема per os действие может начинаться через 2-3 сут, часто даже через 1-3 нед, а иногда и позднее. Нагрузочные дозы могут сократить эти промежутки времени. Концентрация в плазме связана с дозой per os во время постоянного применения и составляет в среднем 0,5 мг/мл на каждые 100 мг/сут при суточной дозе 100-600 мг. Период полувыведения мультифазный, первоначальное уменьшение концентрации в плазме на 50% наступает через 3-10 сут после прекращения приема препарата (что, вероятно, является результатом удаления препарата из хорошо кровоснабжаемых тканей); оставшийся препарат выводи гея за 26-107 сут (в среднем за 53 сут), у большинства пациентов — за 40-55 сут.
Для достижения стабильного сос тояния без нагрузочной дозы должно пройти 265 дней. Из-за различий этих фармакинегических параметров необходимо тщательное мониторирование пациентов. Терапевтическая концентрация в плазме варьирует от 1 до 2,5 мг/мл. Для подавления аритмии чаще всего достаточно концентрации 3,5 мг/мл, но при этом повышается риск развития ПЭ.
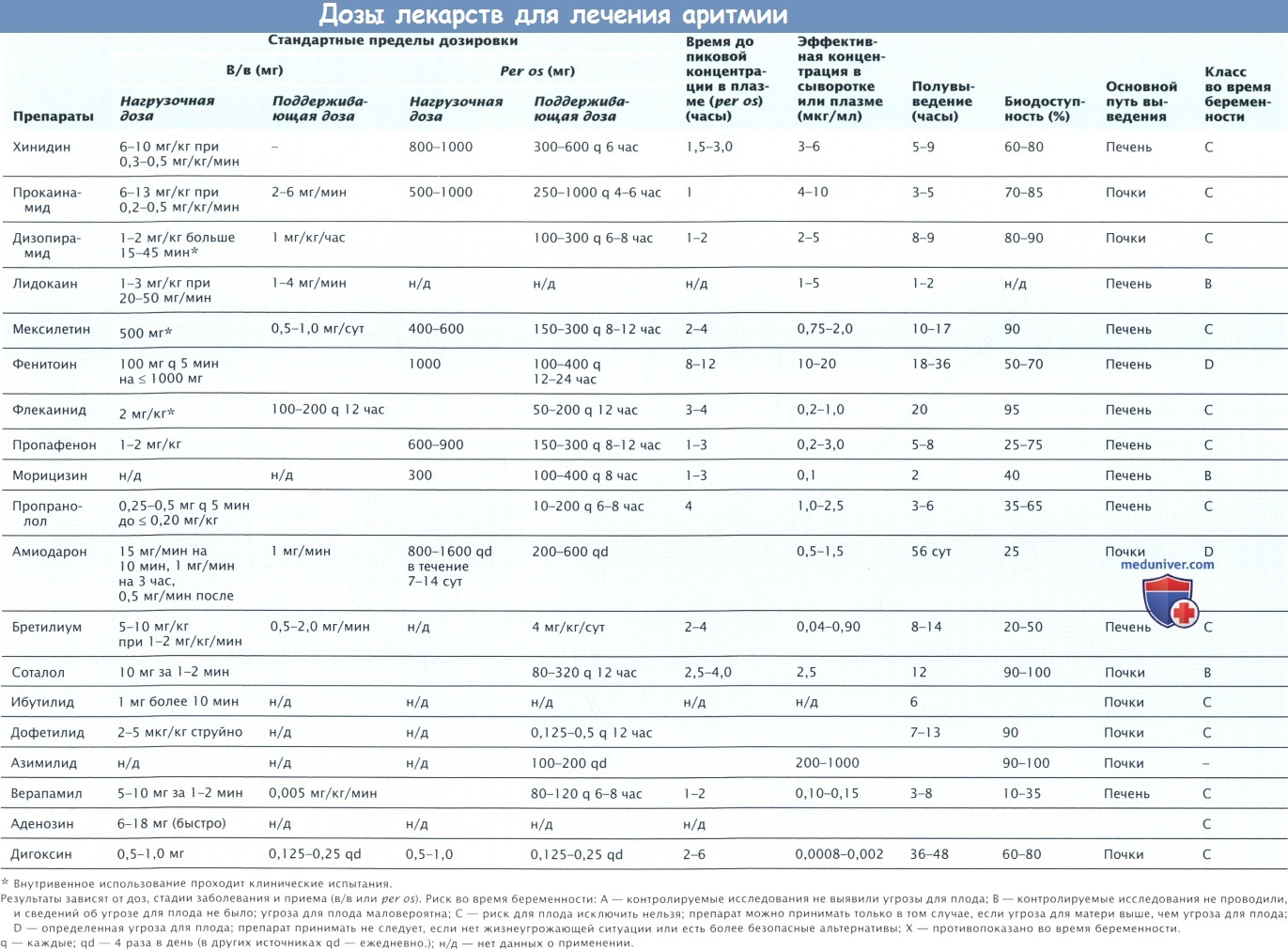
г) Дозы и применение. Оптимальная доза, которая подходила бы всем пациентам, не установлена. Рекомендуемый режим: от 800 до 1200 мг/сут в течение 1-3 нед, далее снизить дозу до 400 мг/сут на несколько недель и после 2-3 мес лечения поддерживающая доза должна составлять < 300 мг/сут. Поддерживающая доза 1-2 раза в день должна быть минимально эффективной, чтобы уменьшить возможность возникновения ПЭ. У некоторых пациентов эффективной может быть доза 100 мг/сут. Режимы можно адаптировать под конкретного пациента и клиническую ситуацию.
Амиодарон для достижения более быстрой нагрузки и эффекта при неотложных состояниях можно назначать в/в в первоначальной дозе 15 мг/мин в течение 10 мин, а затем по 1 мг/мин в течение 6 час, далее в течение оставшихся 18 час и при необходимости в течение следующих нескольких суток по 0,5 мг/мин. Во время приступа ЖТ или ФЖ можно назначить дополнительное введение препарата в дозе 150 мг за > 10 мин. Внутривенное ведение препарата можно безопасно продлевать на 2-3 нед. Обычно амиодарон в/в переносится хорошо даже пациентами с дисфункцией ЛЖ. Из-за гипотензии у пациентов со сниженной ФВ амиодарон в/в следует применять с осторожностью. Высокая нагрузочная доза per os (от 800 до 2000 мг/сут) для поддержания самой низкой концентрации в плазме от 2 до 3 мг/мл может устранить ЖА за 1-2 сут. .
д) Показания. Амиодарон используют для купирования широкого спектра НЖТА и ЖТА у плода, детей и взрослых, а также ТП и ФП, ЖТ и ФЖ, связанных с болезнью сердца, и ГКМП. Процент успешности сильно варьирует и зависит от состояния пациентов, вида аритмии, исходного заболевания сердца, периода наблюдения, определения успешности и других факторов. Однако в целом эффективность амиодарона равна или даже выше эффективности других ААП: 60-80% — при большинстве НЖТА и 40-60% — при ЖТА. Амиодарон может повысить выживаемость пациентов с ГКМП, неишемической ДКМП, бессимптомными ЖТА во время или после реанимационных мероприятий в связи с остановкой сердца.
Назначение амиодарона перед операцией на открытом сердце и после операции снижает частоту возникновения ФП. Амиодарон превосходит ААП класса I и соталол по поддержанию синусового ритма у пациентов с рецидивирующей ФП.
Пациенты с ИКД на фоне лечения амиодароном получают меньшее число разрядов по сравнению с другими ААП. Амиодарон мало влияет на порог ЭКС, но, как правило, повышает порог электрической дефибрилляции.
Некоторые проспективные рандомизированные контролируемые исследования и метаанализы выявили, что на фоне лечения амиодароном повышается выживаемость по сравнению с группой больных, принимавшей плацебо. Однако при сравнении с ИКД-терапией показатели выживаемости после терапии амиодароном были ниже, а, согласно данным исследования SCD-HeFT, среди пациентов с СН II/III ФК NYHA и ФВ 35% выживаемость при приеме амиодарона не отличалась от группы плацебо. Тем не менее препарат можно назначать дополнительно пациентам с ИКД с целью снижения частоты разрядов дефибриллятора вследствие приступов ЖТ и ФЖ или для контроля НЖТА, при которых показано имплантируемое устройство.
Препарат может замедлять частоту спонтанных приступов ЖТ, регистрируемых устройством; необходимо провести тщательный осмотр пациента и, если необходимо, протестировать или перепрограммировать устройство.
В связи с тяжелыми аритмиями, необычной фармакокинетикой препарата и его ПЭ терапию амиодароном следует в большинстве случаев начинать после госпитализации при условии тщательного наблюдения за пациентом в течение но крайней мере нескольких суток. У некоторых больных комбинирование амиодарона с другими ААП может повысить его эффективность.
е) Побочные эффекты (ПЭ). ПЭ были зафиксированы у 75% пациентов, принимавших амиодарон в течение 5 лет, именно это заставляло отменять препарат в 18-37% случаев. Самые распространенные побочные эффекты (ПЭ), из-за которых приходится отменять препарат, относятся к системе дыхания и ЖКТ. Многие побочные эффекты (ПЭ) обратимы при снижении дозы или прекращении лечения. Побочные эффекты (ПЭ) чаще появляются при длительном лечении препаратом в высоких дозах. Среди несердечных ПЭ самыми опасными являются симптомы со стороны системы дыхания. В одном исследовании они появились у 33 из 573 пациентов в период от 6 сут до 60 мес лечения с 3 летальными исходами. Механизм возникновения ПЭ неясен, но может быть связан с гиперчувствительностью, распространенным фосфолипидозом или с тем и другим одновременно.
К распространенным симптомам относятся одышка, непродуктивный кашель и лихорадка, крепитация при аускультации, гипоксия, положительная визуализация с галлием, снижение диффузионной способности и рентгенографические признаки инфильтрации легких. В случае возникновения подобных воспалительных изменений прием амиодарона должен быть прекращен. Можно попробовать назначить кортикостероиды, но соответствующие контролируемые исследования не проводили. Среди пациентов с воспалительными изменениями в легких смертность составляет 10% (в основном среди пациентов с нераспознанной патологией легких). Рекомендуется проводить рентгенографию органов грудной клетки и тестирование легочных функций, включая диффузную способность моноксида углерода, с 3-месячным интервалом в течение первого года и далее 2 раза в год в течение нескольких лет.
При поддерживающей дозе < 300 мг/сут токсичность со стороны органов дыхания возможна, но маловероятна. ФР развития токсичности со стороны дыхательной системы являются пожилой возраст, высокая поддерживающая доза и сниженная начальная диффузная способность легких. Неизмененную диффузную способность моноксида углерода на фоне терапии можно расценивать как отсутствие предрасположенности к нарушениям со стороны легочной системы.
Несмотря на то что у большинства пациентов можно обнаружить повышение уровня печеночных ферментов, препарат не прекращают принимать до тех пор, пока значения не превысят норму в 2 или 3 раза у пациентов с изначально аномальными показателями. Цирроз развивается нечасто, но может быть фатальным. Возможны неврологические нарушения, фоточувствительность (которую целесообразно минимизировать с помощью защитных очков), голубоватая окраска кожи, желудочно-кишечные нарушения и гипертиреоидизм (1-2%) или гипотиреоидизм (2-4%). Амиодарон, по-видимому, ингибирует превращение Т4 в Т3 на периферии, что ведет к изменению химического состава, которое характеризуется небольшим повышением Т4, тиреотропного гормона и небольшим снижением Т3.
Концентрацию превращенного Т3 используют как показатель эффективности препарата. При гипотиреоидизме уровень тиреотропного гормона значительно увеличивается, в то время как при гипертиреоидизме повышается уровень Т3. Функциональное тестирование щитовидной железы при приеме амиодарона следует проводить каждые 3 мес в течение первого года, далее 1-2 раза в год. При появлении симптомов, связанных с дисфункцией щитовидной железы, тест проводят чаще. Почти в 100% случаев при приеме амиодарона в течение > 6 мес у взрослых появляются роговичные микроотложения. Отмечались, хотя и редко, более серьезные офтальмологические реакции: неврит зрительного нерва, атрофия с потерей зрения или то и другое одновременно; их связь с амиодароном не доказана.
К сердечным ПЭ относятся симптоматические брадикардии (2%), ухудшение ЖТА (иногда с развитием тахикардии torsades de pointes) в 1-2% случаев, чаще у лиц женского пола, и утяжеление ХСН (2%). Некоторыми исследователями были отмечены осложнения, которые появляются, возможно, на фоне анестетиков: дисфункция системы дыхания, гипотензия, тяжелая брадикардия, печеночная дисфункция и низкий СВ.
Чтобы избежать выраженных ПЭ, следует применять наименьшую поддерживающую дозу амиодарона, но обязательно эффективную. Большинство НЖА можно успешно контролировать дозой < 200 мг/сут, в то время как для ЖА, как правило, нужна большая доза. Побочные эффекты (ПЭ) при дозе < 200 мг/сут возможны, но маловероятны. Из-за потенциальной токсичности амиодарона для различных органов с целью предотвращения ПЭ используют мультидисциплинарный подход к терапии этим препаратом.
Встречаются выраженные взаимодействия амиодарона с другими ЛС; при сочетанном применении препаратов дозы варфарина, дигоксина и др. ААП следует снизить на 1/3 или даже наполовину и тщательно наблюдать за состоянием пациента. Препараты с синергичными эффектами, такие как β-АБ или антагонисты кальция, следует назначать с осторожностью. Безопасность амиодарона во время беременности не доказана, поэтому им следует пользоваться только при отсутствии альтернативы.
- Читать "Показания бретилиума, его противопоказания и побочные эффекты"
Оглавление темы "Лекарства для лечения аритмии":- Показания β-адреноблокаторов при аритмии, его противопоказания и побочные эффекты
- Показания амиодарона, его противопоказания и побочные эффекты
- Показания бретилиума, его противопоказания и побочные эффекты
- Показания соталола, его противопоказания и побочные эффекты
- Показания ибутилида, его противопоказания и побочные эффекты
- Показания дофетилида, его противопоказания и побочные эффекты
- Показания азимилида, его противопоказания и побочные эффекты
- Показания верапамила, его противопоказания и побочные эффекты
- Показания аденозина, его противопоказания и побочные эффекты
- Показания дигоксина, его противопоказания и побочные эффекты
