Биопленки бактерий как способ существования в окружающей среде и в организме
Развитие биопленочных сообществ — одна из основных стратегий выживания бактерий не только в окружающей среде, но и в организмах инфицируемых хозяев. Биопленки — это высокоорганизованные сообщества, образованные бактериями одного или нескольких видов и состоящие как из активно функционирующих клеток, так и из покоящихся (некультивируемых) форм. В составе биопленок клетки бактерий объединены сложными межклеточными связями, осуществляющими регуляцию экспрессии генов в различных частях биопленок и на разных стадиях их развития, в результате чего популяцию биопленочных бактерий многие стали рассматривать как функциональный аналог многоклеточного организма.
Образование биопленок происходит на поверхностях различного происхождения (биотических и абиотических) как в природе, так и в организмах различных хозяев. Такой способ существования бактерий создает большие проблемы в промышленности (коррозия труб, снижение эффективности работы промышленных установок) и в медицинской практике. В настоящее время установлено, что многие хронические инфекции, а также инфекции, возникновение которых связано с использованием медицинского имплантируемого оборудования (линз, катетеров, протезов, искусственных клапанов сердца) вызываются бактериями, способными расти в виде биопленок.
В составе биопленок бактерии значительно более устойчивы к действию антибактериальных препаратов, включая антибиотики, к факторам иммунной защиты организма, а также к воздействию неблагоприятных факторов окружающей среды, таких как изменения температуры, pH среды, осмолярности.
а) Определение биопленок и их структурная организация. До 1990 г. биопленки воспринимались как неструктурированные наросты из бактериальных клеток, окруженные экзополисахаридным матриксом. Такое представление основывалось на результатах изучения биоиленок при электронном и световом микроскопировании, дающем артефакты в первом случае из-за полной обезвоженности препаратов, а во втором — из-за внефокусных эффектов. Конфокальный лазерный сканирующий микроскоп (ЛСМ), изобретенный еще в 50-х годах XX века, никогда ранее не применялся для изучения бактерий, поскольку считалось, что у них преобладает планктонная форма жизни.
По мере накопления данных о распространенности биопленок в природе и их роли во многих природных процессах, а также медицине и промышленности, возобновились поиски методов, которые способствовали бы расшифровке природы биопленок.
Выше уже указывалось, что при помощи ЛСМ было выяснено, что биопленки могут быть образованы бактериями как одного, так и нескольких видов. Сочетание ЛСМ и эпифлюоресцентной микроскопии позволило за счет комбинации красителей и специально разработанных компьютерных программ выявлять одновременно общее количество клеток в исследуемой биопленке, а также процентный состав мертвых, живых, некультивируемых и активно метаболизирующих клеток. Независимо от состава бионленки, развивающиеся в природных экосистемах, обладают универсальной сложной структурой с некоторыми незначительными вариациями.
Они образуются на твердых поверхностях, имеют характерную архитектуру (трехмерные грибовидные или похожие на колонны образования), включающую микроколонии, заключенные в экзополимерный матрикс, окруженные наполненными жидкостью каналами. По каналам осуществляется приток питательных веществ и кислорода и выведение конечных продуктов метаболизма бактериальных клеток. За образование и сохранение каналов в активном состоянии несут ответственность специальные механизмы, в которых важную роль играют особые поверхностные структуры — рамнолипиды. При их помощи каналы остаются открытыми, изменяются межклеточные взаимоотношения и взаимодействие клеток с поверхностью, в результате чего сохраняется архитектура биопленок, приток питательных веществ и кислорода, вывод продуктов распада, а также предотвращается попадание в каналы бактерий извне и их колонизация.
Одним из ключевых структурных компонентов биопленок является внеклеточное полимерное вещество, или матрикс. Последний состоит из смеси таких компонентов, как экзополисахариды, белки, нуклеиновые кислоты и другие вещества. Наиболее изученным компонентом матрикса являются экзополисахариды (ЭПС), играющие, по-видимому, различные роли в структуре и функциях биопленочных сообществ в зависимости от условий окружения. Одна из важнейших функций экзополимерного матрикса — обеспечение защиты бактерий от различных стрессовых ситуаций, возникающих в окружающей среде, таких как УФ-облучение, изменения в pH среды, осмотический шок, высыхание, воздействие антибактериальных препаратов и механизмов защиты хозяина.
Сложная архитектура биопленок обеспечивает возможность метаболической кооперации клеток внутри пространственно хорошо организованных систем, создает условия, благоприятствующие установлению симбиотических взаимоотношений между бактериями разных видов.
С целью экспериментального изучения процесса образования биопленок в настоящее время разработаны специальные аппараты и методики для получения биопленок в лабораторных условиях. В качестве субстратов для формирования биопленок используются пластиковые, тефлоновые и металлические пластины. В качестве модельных организмов при исследованиях биопленок используются представители как грамотрицательных, так и грамположительных бактерий, такие как псевдомонады, кишечная палочка, холерный вибрион, некоторые виды бацилл, стафилококков и стрептококков.
б) Стадии образования биопленок. Началом развития биопленок является переход бактерий от планктонного существования к биопленочному, связанному с прикреплением клеток к биотической или абиотической поверхности. Процесс перехода из одного состояния в другое инициируется определенными сигналами, поступающими из окружающей среды, которые могут сильно отличаться не только для разных организмов, но и в случаях прикрепления одного организма к разным поверхностям. Например, штамм Escherichia coli 0157:117 образует биопленки только при недостатке питательных веществ, а некоторые штаммы Е. coli К12 способны образовывать биопленки на минимальной среде только при добавлении в ее состав аминокислот.
Штаммы псевдомонад и холерного вибриона образуют биопленки при выращивании на различных средах, способствующих росту, т.е. реагируют на разные сигналы окружающей среды, инициирующие прикрепление к субстрату. При переходе к сидячему образу жизни большую роль у ряда бактерий играют поверхностные органеллы-флагеллы, или пили. Часто именно они определяют взаимодействие с различными поверхностями. Так, при колонизации кишечника холерные вибрионы используют Тср пили, а в случае прикрепления к абиотическим поверхностям — пили, кодируемые локусом msh, не относящиеся к факторам патогенности. Эти и накопленные к настоящему времени другие факты, полученные при изучении различных видов бактерий, свидетельствуют о существовании у них разных способов перехода к сидячему образу жизни.
На примере холерных вибрионов можно продемонстрировать, насколько важную роль в их выживаемости в водной экосистеме играет способность к формированию высокоорганизованной имеющей трехмерную структуру биопленки. В настоящее время повсеместно происходит замена биовара классических вибрионов холерными вибрионами биовара Эль-Тор, вызвавшими седьмую пандемию холеры — самую длительную из всех известных (более 40 лет), продолжающуюся до сегодняшнего дня. В числе некоторых геномных различий между этими биоварами есть те, которые имеют отношение к способности формировать биопленки. Сохранение Эль-Тор-вибрионов в водных экосистемах в межэпидемические периоды седьмой пандемии холеры, возможно, связано с присутствием в их геноме чужеродного участка ДНК размером 16,7 тысяч пар нуклеотидов (т.п.н.), содержащего 16 генов, необходимых для биосинтеза пилей Msh А и их секреции на поверхность клеток.
Фланкирование его прямыми повторами нуклеотидных последовательностей из 7 пар позволяет предполагать, что гены пилей Msh имеют организацию, характерную для мигрирующих генетических элементов. Возможно, что эти гены исходно имелись у общего предшественника холерных вибрионов обоих биоваров, но в процессе эволюции и дальнейшей дивергенции классические вибрионы утратили значительную их часть и перестали образовывать пили этого типа. Результатом такой утраты явилась меньшая способность сохраняться во внешней среде, поскольку пили Msh участвуют в процессе образования биопленок, обеспечивая возможность прикрепления клеток не только к биотическим, но и абиотическим поверхностям. Более того, у вибрионов Эль-Тор обнаружен еще один дополнительный ген mbaA (от maintenance of biofilm architecture), продукт которого регулирует образование трехмерной структуры биопленки. Таким образом, в процессе эволюции у Эль-Тор-вибрионов возник механизм, дающий этому патогену возможность занимать множество экологических ниш и обеспечивать его устойчивость к условиям внешней среды, высокую жизнеспособность и конкурентоспособность.
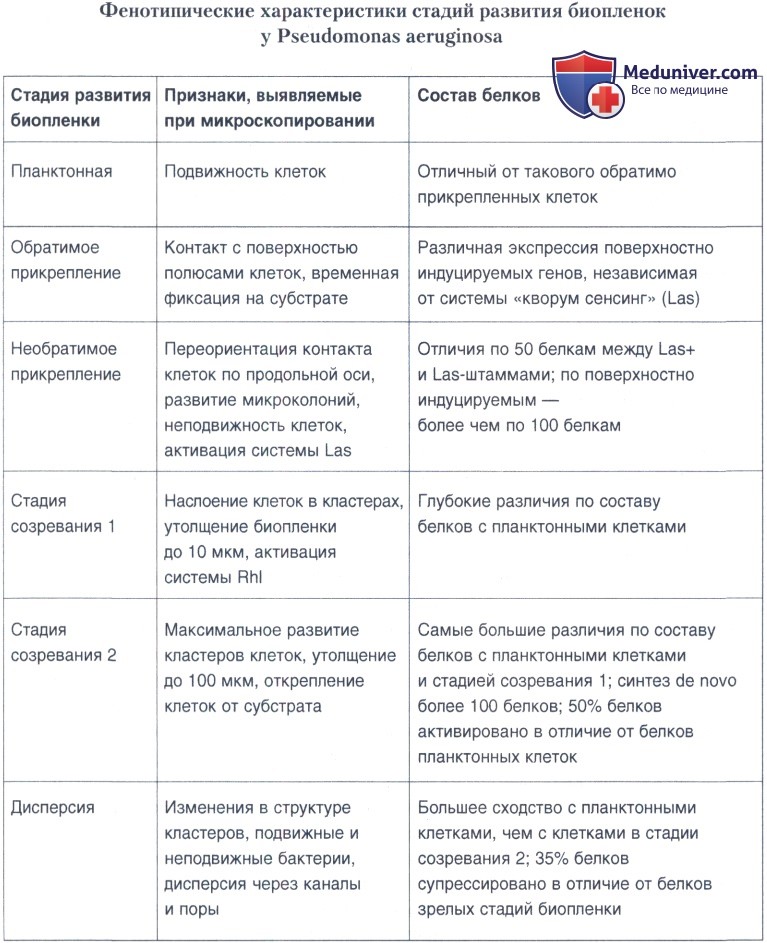
Одним из важных аспектов в исследовании бактериальных биопленок являются изменения в метаболизме бактерий в процессе их перехода от планктонного образа жизни к сидячему и развитию биопленок. Для его решения изучают мутанты бактерий, у которых нарушен процесс инициации и развития биопленок, а также используют другие подходы, включающие непосредственное микроскопическое наблюдение и сравнительные анализы состава мРНК и белков в клетках планктонных и биопленочных бактерий на разных стадиях развития биопленки. Применение таких методов позволило выделить и охарактеризовать несколько стадий развития биопленок, включающих прикрепление бактерий к субстрату, образование микроколоний и каналов, созревание биопленок и дисперсию клеток. У широкого круга бактерий стадии развития биопленок являются, по-видимому, консервативными.
Во время начального прикрепления планктонные бактерии контактируют с субстратом и временно фиксируются. Это прикрепление обратимо — некоторые клетки способны снова открепляться. Как уже обсуждалось выше на примере холерного вибриона, в этом процессе важную роль играют пили, или флагеллы. У псевдомонад мутанты, не способные синтезировать флагеллы, прикрепляются к поверхности с меньшей эффективностью, чем клетки дикого типа; разница в этих случаях достигает 2-3 порядков. Следующая стадия развития биопленок (стадия созревания) у псевдомонад подразделена на две — стадию созревания 1 и стадию созревания 2. Во время стадии созревания 1 клетки теряют подвижность, прикрепление становится необратимым, активируется первая система регуляции активности генов «кворум сенсинг», о чем свидетельствует активация гена lasB, образуются микроколонии, слой биопленки утолщается.
К этому времени зарегистрирована активация второй системы «кворум сенсинг», Rhl. Во время стадии созревания 2 образуются кластеры микроколоний, достигающие максимальной плотности.
Большинство клеток начинает открепляться внутри кластеров, происходит отделение кластеров от поверхности. Через 9 дней после начала образования биопленки кластеры изменяются в структуре, начинается последняя стадия — процесс дисперсии, или распада, во время которого бактерии способны активно покидать биопленку. Он инициируется координированным распадом окружающего внеклеточного матрикса, осуществляемым при помощи секретируемых (например, полисахаридлиаз) или связанных с поверхностью ферментов и активации функций подвижности. Бактерии выплывают через открытые каналы. Цикл развития биопленки завершается, бактерии вновь возвращаются к планктонному образу жизни с тем, чтобы при необходимости вновь его повторить.
При помощи ряда современных молекулярно-биологических методов были выявлены значительные отличия в составе и уровне белков, синтезируемых планктонными, биопленочными бактериями и бактериями, находящимися на разных стадиях развития биопленок. Установлено участие в этих стадиях различных регуляторных систем. В таблице ниже представлены данные исследования биопленок Р. aeruginosa, находящихся на разных стадиях развития. Они получены при сравнительном анализе грубых экстрактов белков и микроскопических наблюдений. Подобные данные получены также для биопленочных бактерий кишечной палочки, холерного вибриона, стафилококков и стрептококков. Все это свидетельствует, что развитие биопленок — сложный высоко регулируемый генетически запрограммированный процесс.
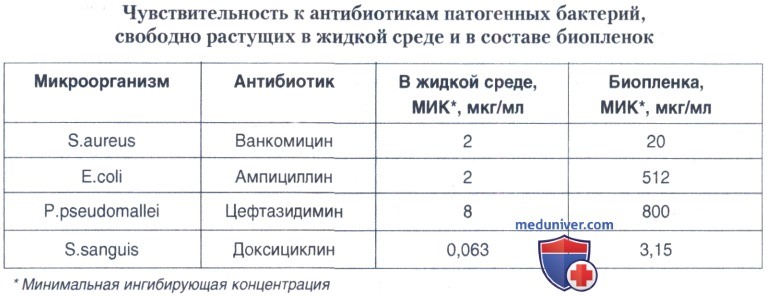
в) Резистентность биопленок к действию антибактериальных препаратов и иммунных механизмов инфицируемых макроорганизмов. Одним из величайших достижений медицины минувшего века явилось открытие антибиотиков и совершенствование антибиотикотерапии инфекционных заболеваний. Однако увеличение числа антибиотиков и повышение частоты их использования при лечении различных заболеваний привело к возникновению ряда проблем, связанных со снижением эффективности антибиотикотерапии. Одна из них — чрезвычайно быстрое распространение множественной лекарственной устойчивости среди бактерий благодаря существованию мигрирующих генетических элементов (плазмид, бактериофагов, транспозонов, интегронов, генных кассет), содержащих гены лекарственной устойчивости и имеющих специализированные механизмы их распространения среди бактерий как одного, так и разных видов. Другая проблема — способность бактерий объединяться в сложно организованные сообщества — биопленки, в составе которых они оказываются защищенными от различных стрессовых воздействий, включая лекарственные препараты и средства защиты хозяина.
В таблице ниже представлены данные, полученные при изучении сравнительной антибиотикорезистентности планктонных и биопленочных бактерий.
Повышенная резистентность биопленочных бактерий к стрессовым воздействиям обусловлена рядом факторов: а) снижением проникновения внутрь биопленки антибактериальных препаратов. Бактерии в биопленке окружены биополимерным матриксом, продуцируемым самими бактериями, который может влиять на эффективность проникновения извне антибактериальных препаратов и других стрессовых факторов. Например, в случае пседомонад показано, что аминогликозидные антибиотики медленнее проникают в образуемые ими биопленки, так как они связываются с внеклеточным полимерным веществом, таким как полисахарид альгинат; б) различиями в метаболической активности клеток бактерий, образующих биопленку. Такие различия возникают благодаря тому, что в пределах биопленки создается градиент по содержанию питательных веществ и кислорода, в результате которого на периферии биопленок находятся активно метаболизирующие, а внутри биопленок — метаболически неактивные клетки.
Известно, что мишенями для действия антибиотиков являются активно растущие клетки, так что внутри биопленок бактерии оказываются защищенными от воздействия антибиотиков; в) фенотипической вариабельностью клеток внутри биопленки. В настоящее время получены достоверные данные, что даже при гибели большей части биопленочной популяции бактерий после воздействия антибиотиков сохраняется очень небольшой процент жизнеспособных клеток, способных персистировать, но не передающих по наследству эту способность своему потомству. Специально проведенные исследования показали, что гомогенная популяция выращенных в жидкой культуре клеток содержит такие персистирующие клетки. Этим фенотипом обладает метаболически менее активная субпопуляция, которая всегда присутствует в каждой культуре клеток.
Существуют также генетические факторы, ответственные за уровень устойчивости биопленочных бактерий к стрессовым факторам по сравнению с планктонными клетками. Так, мутация в гене ndvB делает биопленки, образуемые Pseudomonas aeruginosa, более чем на порядок чувствительнее по сравнению со штаммом дикого типа. Причем показано, что ген ndvB экспрессируется только биопленочными клетками и ответствен за синтез периплазматических циклических гликанов. В образовании биопленки и устойчивости к антибиотикам принимает участие также ген pvrR, кодирующий регулятор транскрипции ряда генов. Из проб, взятых от больных кистозным фиброзом легких, были выделены мутанты с повреждениями в этом гене, образующие мелкие шероховатые колонии и отличающиеся гипертрофированной способностью образовывать биопленки и устойчивостью к антибиотикам. На устойчивость к антибиотикам у кишечной палочки оказывают влияние F-плазмиды и ряд других конъюгативных плазмид, кодирующих антиген, гомологичный антигену 43.
Все вышесказанное свидетельствует о необходимости более детального исследования процессов формирования биопленок, чтобы разрабатывать новые стратегии борьбы с инфекциями.
В настоящее время доказано участие биопленок в контаминации медицинского имплантируемого оборудования. Проведенные электронно-микроскопические исследования медицинских имплантантов выявили следы биопленок на их абиотических поверхностях. Очевидно, что бактериальные биопленки на искусственных клапанах сердца являются основной причиной эндокардитов у пациентов, подвергавшихся хирургическим операциям на сердце. Каждый год для лечения больных используются миллионы катетеров (сердечных, внутривенных, мочевыводящих и др.), и эти имплантанты служат потенциальными поверхностями для формирования биопленок. Последние образуются и на контактных линзах, часто являясь причиной кератитов. Считается, что в среднем около 60% внутрибольничных инфекций обусловлено биопленками.
Если роль биопленок в инфекциях, связанных с имплантацией, несомненна, то при инфекциях, не связанных с имплантацией, она еще не совсем ясна. Пока известен только один вид легочной инфекции у больных с кистозным фиброзом (КФ), вызываемой Pseudomonas aeruginosa и Burkholderia cepacia, при которой доказана роль образуемой этими родственными бактериями биопленки.
Лица, страдающие этим наследственным заболеванием, очень чувствительны к хроническим легочным инфекциям, вызываемым данными патогенами. Механизм такой чувствительности не известен, но прямым следствием инфекции является сверхактивный воспалительный процесс в легких, который приводит к нарушению их функции и служит причиной высокой смертности пациентов.
Электронно-микроскопические исследования препаратов легких больных, умерших от инфекции, выявили наличие биопленок, образованных бактериями Р. aeruginosa. Как правило, изоляты Р. aeruginosa из легких больных КФ характеризуются повышенным синтезом альгината, или ЭПС, который, как было показано выше, является ключевым компонентом экзополимерного матрикса биопленки, защищающим образующие биопленку бактерии от антимикробного воздействия.
Известно, что изменения в уровне и спектре экспрессии генов возбудителя инфекции в ответ на сигналы организма-хозяина является необходимым атрибутом инфекции. Инфекционные заболевания часто являются результатом сложного взаимодействия между патогеном и хозяином, примером которого является и очень тяжелая легочная инфекция у больных КФ. Как правило, при инфекции на фоне кистозного фиброза из мокроты больных выделяют не только В. cepacia и Р. aeruginosa, но и разных представителей индигенной (непатогенной) флоры.
Для того чтобы понять роль взаимодействия между патогенами и резидентной микрофлорой и его влияние на характер экспрессии генов патогенных бактерий, было исследовано взаимодействие между патогенными штаммами Р. aeruginosa и непатогенными штаммами орофарингиальной флоры (ОФ), выделенными из мокроты больных КФ, на модели легочной инфекции у крыс и in vitro. Эксперименты, выполненные на лабораторных крысах, показали, что микробы ОФ сами не вызывают повреждений легочной ткани, но могут усиливать повреждения при совместном заражении легких бактериями Р. aeruginosa вне зависимости от концентрации последних.
Этими же исследователями была сконструирована библиотека промоторов генов P.aeruginosa, содержащая люминесцентный ген-репортер, что позволило следить за генной активностью в таких образцах. В результате было показано, что в присутствии в исследуемых образцах непатогенной флоры происходит индукция экспрессии некоторых генов Р. aeruginosa и в частности генов эластазы и экзотоксина, являющихся факторами патогенности этого возбудителя. Более того, было показано, что автоиндуктор АИ-2, сигнальная молекула регуляторной системы бактерий «кворум сенсинг», обеспечивающая межвидовой сигнал, также индуцирует экспрессию генов вирулентности. И хотя бактерии Р. aeruginosa не синтезируют АИ-2, представители ОФ синтезируют его в достаточных количествах. Таким образом, было получено двойное доказательство того, что бактерии ОФ вносят вклад в патогенез КФ за счет межвидовых регуляторных сигналов.
Ранее было показано, что добавление АИ, синтезируемых Р. aeruginosa, к клеткам В. cepacia индуцирует у последних экспрессию факторов вирулентности. Эти данные, наряду с представленными выше, показывают, что межвидовое общение помогает смешанным популяциям патогенных В. cepacia и Р. aeruginosa координированно регулировать продукцию факторов вирулентности и способствует прогрессированию заболевания как при одиночной, так и при совместной инфекции.
Для контроля за вспышками легочной инфекции больные КФ обычно получают профилактический курс макролидных антибиотиков, который, как правило, облегчает течение инфекции, несмотря на резистентность к ним бактерий Р. aeruginosa. С позиций вышеприведенных данных терапевтический эффект может быть объяснен действием макролидов на нормальную ОФ в легких, что приводит к подавлению синтеза АИ-2 этими бактериями и соответственно транскрипционного сигнала к синтезу факторов патогенности бактериями Р. aeruginosa.
г) Заключение. О существовании бактерий в составе биопленок, прикрепленных к твердым поверхностям, известно давно, но только в последние годы благодаря осознанию значения такого сообщества бактерий в медицине и других хозяйственных областях его исследованию стало уделяться большое внимание. Накопленные к настоящему времени знания о социальных взаимоотношениях бактерий позволили взглянуть на них с позиций поведения многоклеточных организмов, что по существу изменило наши представления о микробиологии.
Биопленки оказались высоко организованными бактериальными сообществами, образуемыми бактериями одного или нескольких видов как активно функционирующих, так и покоящихся, или некультивируемых клеток. Для формирования и существования биопленок, состоящих из бактерий одного или нескольких видов, необходимы сложные межклеточные взаимодействия, контролируемые различными регуляторными системами, включающимися в ответ на сигналы внешней среды и направленными на сохранение их структуры, ответственной за коммуникацию бактериальных клеток. Таким образом, для бактерий, входящих в состав биопленок, характерно социальное поведение.
Сравнение профилей информационной РНК и белков, образующихся в клетках одних и тех же планктонных и биопленочных бактерий, а также бактерий, находящихся в составе биопленки на разных стадиях ее развития, выявило значительные различия в числе активированных и ингибированных генов между группами бактерий, т.е. показало, что экспрессия генов является дифференцированной. Более того, было установлено, что такая дифференцированная экспрессия генов наблюдается в клетках бактерий, находящихся в разных участках биопленки, а это свидетельствует о способности отдельных членов бактериального сообщества выполнять разные функции, обеспечивая повышенную выживаемость всего сообщества.
Изучение биопленок и сигнальных генетических систем, регулирующих их формирование, направлено на поиск мер профилактики и защиты от патогенных микроорганизмов, создание новых классов антибактериальных препаратов. Например, в экспериментах, проведенных на Е. coli, Р. aeruginosa и В. cepacia, уже выявлены некоторые ингибиторы сигнальных систем, при действии которых бактерии не способны образовывать биопленочные структуры. Другой путь — создание модифицированных аналогов автоиндукторов систем QS, которые легко могут быть синтезированы, так как их структура хорошо известна. Такие модифицированные автоиндукторы должны быть неактивными как индукторы генов, но эффективны, как ингибиторы.
Преимущества создания такого типа препаратов заключаются в том, что все известные к настоящему времени автоиндукторы являются низкомолекулярными соединениями, которые легко модифицировать. Автоиндукторы высоко специфичны во взаимодействии с мишенью — белками-сенсорами, синтезирующимися в патогенных бактериях. Благодаря высокой специфичности и легкому проникновению через мембрану таких препаратов облегчается задача их адресной доставки.
- Читать далее "L-формы бактерий (L-трансформация)"
Редактор: Искандер Милевски. Дата публикации: 8.11.2019
