Некультивируемые формы патогенных бактерий: характеристика, способы выявления
Микробиологам давно было известно, что количество бактерий, высевающихся на чашки из образцов, взятых из естественных источников, значительно ниже того, что можно определить прямым микроскопическим анализом. В конце 70-х годов было разработано несколько методов, позволивших определить количество жизнеспособных клеток в популяции бактерий без их культивирования на питательных средах. Эти методы позволили количественно подтвердить несоответствия при разных способах оценки титра бактерий и продемонстрировать, что многие из таких некультивируемых клеток в действительности являются живыми и способными к активному метаболизму. Разработка этих методов стимулировала дальнейшие исследования, которые и привели к пониманию того, что многие бактерии в ответ на разные стрессовые условия окружающей среды могут терять способность расти на привычных для них питательных лабораторных средах, но, при этом, сохранять жизнеспособность. Окружающая среда, в которой могут существовать многие патогенные бактерии вне организма хозяина, может сильно ограничивать рост клеток.
Это бывает связано с неоптимальными для размножения бактерий физико-химическими характеристиками: температурой, pH, осмотическим давлением, концентрацией ионов металла, а также с низкой концентрацией питательных веществ, необходимых для синтеза органических веществ клетки. При общем дефиците питательных веществ и отсутствии возможности переключения метаболизма с одного субстрата на другой у бактерий работают специальные регуляторные механизмы генной активности, дающие им возможность выживать в подобных условиях. Но что происходит, если крайне неблагоприятные условия сохраняются и индукция стрессовых генов не в состоянии спасти клетку? До недавнего времени считалось, что у грамотрицательных бактерий следующей стадией является гибель клетки. Но к 90-м годам прошлого века появилось достаточно экспериментальных данных, позволивших утверждать, что это не так. Оказалось, что грамотрицательные бактерии так же, как и грамположительные, для которых уже был известен процесс спорообразования, способны к переходу в состояние «покоя», выражающееся во временной потере воспроизводимости клеток. Первое экспериментальное доказательство способности патогенных бактерий находиться в таком «некультивируемом» состоянии было получено в лаборатории R. Colwell в США.
Авторы использовали один из методов подсчета бактерий, не требующий культивирования, и показали, что клетки Vibrio cholerae и Escherichia coli после инкубации в морской воде сохраняют свою жизнеспособность, хотя и теряют способность к образованию колоний на средах, рутинно используемых для культивирования этих бактерий. С тех пор подобное состояние покоя с временной потерей воспроизводимости у грамотрицательных бактерий, впервые обнаруженное в лаборатории R. Colwell в 1982 году, было предложено называть «некультивируемым» (НС), а сами бактерии в таком состоянии «некультивируемыми формами» (НФ). Таким образом, НС можно определить как состояние бактерий, клетки которых сохраняют низкую метаболическая активность, недостаточную для непрерывного клеточного деления, необходимого для роста в жидких или на плотных средах, в норме поддерживающих рост этих бактерий. Определение явления некультивируемости обязательно подразумевает обратимость этого процесса, то есть восстановление способности к активному метаболизму и размножению при смене неблагоприятных условий существования бактерий на благоприятные. Несмотря на то, что подобное состояние покоя (спорообразование) уже давно было показано для грамположительных бактерий, для грамотрицательных бактерий оно было неизвестно — считалось, что отсутствие высеваемости бактерий говорит об их отмирании.
После того, как стало ясно, что многие представители патогенных бактерий, вызывающие в том числе и особо опасные заболевания, могут находиться в гаком состоянии, феномен образования бактериями некультивируемых форм стал привлекать пристальное внимание исследователей.
Стало ясно, что способность к образованию некультивируемых форм патогенными бактериями, по-видимому, обеспечивает им сохранение вида в межэпидемические и межэпизоотические периоды. В настоящее время способность к переходу в некультивируемое состояние уже обнаружена у широкого круга патогенных бактерий и в таблице представлен их перечень.
Долгое время велась дискуссия о том, сохраняют ли бактерии в НФ свой исходный патогенный потенциал. Наилучшим доказательством сохранения и жизнеспособности, и патогенного потенциала является заражение некультивируемыми формами бактерий чувствительных лабораторных животных. Прямые доказательства вирулентности НФ получены при введении инокулята V. cholerae и энтеротоксигенных Е. coli в перевязанную петлю кишечника кролика. НФ Legionella pneumophila, как и нормальные вегетативные клетки, высевались из желточного мешка при инокулировании их в куриные эмбрионы. Введение некультивируемых клеток V. vulnificus мышам, приводило к гибели животных, что также позволило заключить, что НФ V. vulnificus остаются вирулентными и способны вызывать фатальную инфекцию после рекультивации in vivo. Суспензией Campylobacter jejuni, находящегося в НС в течение 6 мес., были напоены мыши, в результате чего был зарегистрирован инфекционный процесс с летальным исходом и без него, с выделением культуры С. jejuni из органов подопытных животных, не отличающиеся от исходных штаммов в культивируемой форме.
Главной трудностью при моделировании инфекционного процесса такого рода является доказательство того, что в животную систему инокулируются действительно некультивируемые клетки, а не смесь НФ и отдельных неучтенных клеток, не перешедших в НС. В каждом случае авторами предпринимались различные способы доказательства того, что заражение осуществлялось суспензией, состоящей из некультивируемых форм. Способность НФ сальмонелл к рекультивации в организме чувствительного хозяина и сохранение патогенного потенциала у покоящихся форм была доказана и нами путем внутрибрюшинного введения суспензий НФ мышам, приводившего к гибели животных или размножению бактерий в селезенке и печени лабораторных животных (Романова Ю.М. 1998).
Таким образом, представленные выше данные по переходу бактерий различных таксономических групп в покоящееся (некультивируемое) состояние демонстрируют универсальность этого механизма адаптации патогенных бактерий к воздействию неблагоприятных факторов внешней среды. Сегодня можно утверждать, что обратимый переход бактерий в покоящееся некультивируемое состояние в окружающей среде (почвах, водоемах и пр.) есть адаптивная изменчивость, вызванная сезонными или непериодическими изменениями условий существования бактерий. Неблагоприятные экологические факторы (абиотические, биотические) в определенных условиях и сочетаниях являются причиной перехода бактерий от активной жизнедеятельности (вегетативные формы) к состоянию анабиоза (покоящиеся формы - споры сиоробразующих или некультивируемые формы неспорообразующих бактерий). Покоящиеся формы как спорообразующих так и неспорообразующих бактерий характеризуются морфологическими изменениями, выражающимися в уплотнении клеточной оболочки и цитоплазмы, принятии клетками кокковидной формы, резко сниженным уровнем метаболизма, утратой способности к размножению при полном или частичном сохранении патогенного потенциала. Благоприятные условия существования стимулируют обратный процесс.
Благоприятствующие факторы среды — абиотические (оптимальная температура, достаточность питательных субстратов и др.) и биотические (наличие хозяев, симбионтов и др.) — стимулируют реверсию покоящихся форм в вегетативное состояние с восстановлением активной жизнедеятельности и размножения бактерий. После разработки и применения новых микроскопических, микробиологических и молекулярно-биологических методов исследования, было показано, что большинство бактерий существует в окружающей среде в виде микробиологических сообществ (биопленок), образуемых на самых разных биотических и абиотических поверхностях. Господство биопленок было установлено во всех природных экосистемах за исключением глубоких подземных вод и глубоководных океанов. В составе таких сообществ, состоящих из представителей различных видов микроорганизмов, обнаружены и некультивируемые формы членов сообщества.
Таким образом, экологическая мотивация и генетические механизмы обратимого перехода бактерий в покоящееся состояние в принципе сходны у спорообразующих и неспорообразующих бактерий. То, что обычно трактовалось как отмирание патогенных бактерий, если они переставали бактериологически выявляться, зачастую оказывается переходом в покоящееся состояние. Экологический смысл и адаптивный характер такой изменчивости бактерий, особенно при резкой смене условий существования в почвах и водоемах умеренных или высоких широт, вполне очевидны.

Эпидемиологическая (эпизоотологическая) значимость обратимого перехода патогенных бактерий в покоящееся состояние несомненна, учитывая цикличность и дискретность эпидемий (эпизоотий). Покоящиеся (некультивируемые) формы обеспечивают сохранение популяции возбудителя инфекции в почвах и водоемах на протяжении межэпидемических (межэпизоотических) периодов — сезонных и даже многолетних, когда его активная циркуляция среди людей или естественных хозяев в природных очагах невозможна или крайне затруднена. Можно полагать, что переход в покоящееся состояние — один из основных механизмов, обеспечивающих сохранение возбудителя инфекций в окружающей среде на протяжении межэпизоотических и межэпидемических сезонов (периодов), а значит, эндемичность очаговых территорий.
Выявление и обнаружение некультивируемых форм бактерий различных видов стало возможным благодаря разработке и применению ряда методов, позволяющих определять жизнеспособные клетки в популяции без их культивирования на питательных средах. Одним из первых разработанных методов является метод прямого подсчета клеток при окрашивании их красителем акридиновым оранжевым и просмотре в флюоресцентном микроскопе, предложенный HobbieJ.E. с соавт. в 1978 году. Наиболее широко распространенным методом для определения клеток в НС является метод прямого подсчета жизнеспособных клеток (DVC — direct viable count, англ.), разработанный К. Kogure с соавт. в 1979. При этой процедуре к исследуемой бактериальной популяции на несколько часов инкубации добавляются в небольших количествах питательные вещества, обычно дрожжевой экстракт, и ингибитор синтеза ДНК — налидиксовая кислота. Если клетки реагируют на добавление питательных веществ, они начинают увеличиваться в размере, но поскольку деление их непосредственно связано с синтезом ДНК, который подавляется налидиксовой кислотой, они не делятся. В результате при микроскопическом исследовании можно четко видеть и подсчитать количество таких укрупненных клеток.
Проведенные в последнее время исследования по сравнению некоторых методов определения жизнеспособности клеток позволили выявить хорошую корреляцию между методом «прямого подсчета», гетеротрофной активностью клеток из природных образцов и метаболической активностью, определенной путем микроауторадиографии (Roszak, Colwell, 1987). Надо учитывать лишь то, что бактерии ряда видов устойчивы к налидиксовой кислоте, как, например, Aeromonas salmonicida и Legionella pneumophila.
Следующий метод для демонстрации жизнеспособности клеток основан на использовании INT (p-iodonitrotetrazolium violets) — акцептора электронов, извлекающего их из активной электронно-транспортной цепи (Zimmerman et al., 1978). Восстановление растворимого INT в метаболизирующих клетках приводит к образованию нерастворимого INT-формазана, вызывающего видимую преципитацию в клеточной мембране. Этот метод позволяет значительно быстрее получить результат, так как в отличие от DVC не требуется длительной инкубации клеток с INT. Однако при длительном пребывании клеток в НС и уменьшении их размеров, иногда довольно затруднительно идентифицировать INT-преципитаты, и необходимо переходить на другие методы, например UVC.
Наиболее перспективным в исследовании НФ в объектах внешней среды может быть метод, комбинирующий метод DVC с добавлением специфических моноклональных антител (МA) (Roszak et ah, 1987). Применение этого метода позволяет определить количество жизнеспособных клеток наряду с идентификацией видовой принадлежности бактерий. Но антигенные изменения в клеточной стенке, происходящие в процессе образования НФ, иногда искажают картину специфического взаимодействия бактерий с МА.
Для идентификации НФ природно люминесцентных бактерий, например, Vibrio harveyi, Pseudomonas fluorescens, Erwinia carotovora стал широко применятся метод люминометрии (Duncan et al., 1994). Этот метод можно использовать и для тестирования бактерий, которым генно-инженерными методами переданы гены, кодирующие комплекс ферментов люцеферин-люцеферазы.
В настоящее время разработан и, по-видимому, будет получать повсеместное распространение метод жидкостной флюороцитометрии, позволяющий за счет комбинации красителей и специально разработанных компьютерных программ выявлять одновременно общее количество клеток в исследуемой популяции, а также процентный состав мертвых, живых и некультивируемых, но жизнеспособных клеток (G.Nebe-von-Caron, 2000). Несмотря на предположение, что этот метод должен заменить в ближайшем будущем столь любимые микробиологами чашки Петри, повсеместному его распространению в микробиологических исследованиях разного типа мешает огромная дороговизна необходимого оборудования и не менее дорогостоящих реактивов.
В последнее время для выявления бактерий в любой форме существования широко применяются молекулярно-генетические методы, и, в первую очередь, полимеразная цепная реакция (ПЦР). Методический подход на основе ПЦР позволяет обойти основную трудность, связанную с тестированием бактерий, находящихся в НС, так как дает возможность заменить размножение бактерий как таковых, амплификацией видоспецифичного для данной бактерии фрагмента ДНК. В качестве исследуемых образцов для выявления НФ методом ПЦР можно брать любые биологические жидкости, клетки, ткани и пробы из внешней среды (водных источников и почвы), причем содержащие не только свежую ДНК, но и высушенные и мумифицированные ткани, содержащие фрагментированную ДНК. Используя данный подход, успешно выявляли НФ V. vulnificus, L. pneumophila, S. dysenteriae, H. pylori, V. cholerae, Y. pestis, L. monocytogenes, S. typhimurium.
Однако, некоторые исследователи считают не вполне правомочным использование метода классической ПЦР для выявления НФ бактерий из-за возможности индикации не только жизнеспособных некультивируемых клеток, но и мертвых клеток, содержащих генетический материал. Методом, исключающим этот недостаток, является сочетание ПЦР с обратной транскрипцией (ОТ-ПЦР). Маркером присутствия и жизнеспособности бактерий в этом случае является коротко живущая специфичная для каждого гена молекула мРНК, наличие которой в клетках является показателем его активности. По наличию информационной мРНК изучаемого гена в полученном из образца суммарном препарате всей клеточной РНК можно судить о его активности, а, следовательно, о жизнеспособности искомых бактерий. С помощью метода ОТ-ПЦР успешно выявляли НФ V cholerae, L. monocytogenes, Е. faecalis, Enterococcus spp., S. typhimurium. При этом, можно использовать те же самые тест-системы, которые используются и для идентификации бактерий в нормальном активном состоянии.
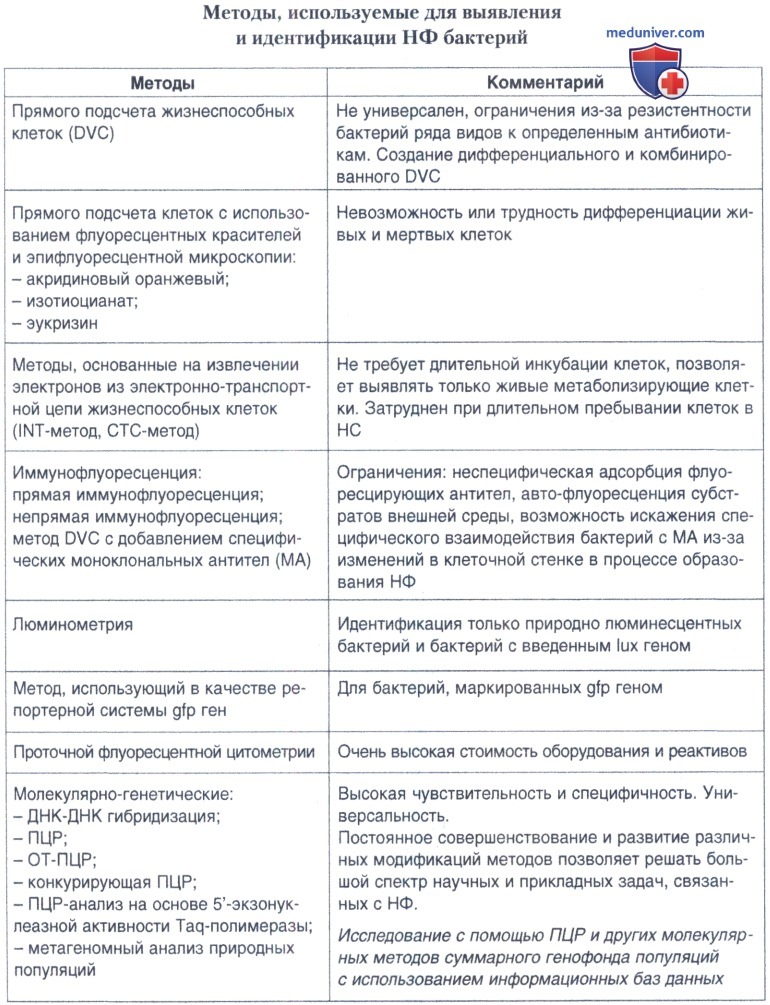
Молекулярно-генетические методы постоянно совершенствуются и в настоящее время стало возможным оценивать разнообразие микроорганизмов в различных средах обитания не только без предварительного культивирования, но и без поиска видоспецифических фрагментов. Такой метод получил название метагеномного анализа состава бактериального сообщества, существующего как в окружающей среде, так и в организме хозяина, например, при исследовании нормальной микрофлоры кишечника. В таких случаях из образца выделяется суммарная ДНК и амплифицируются гены, кодирующие рибосомальные РНК (рРНК). В настоящее время признано, что рРНК являются лучшими мишенями как для изучения филогенетических взаимоотношений, так и для идентификации микроорганизмов. Это объясняется тем, что они присутствуют во всех бактериях, находящихся в активном и в некультивируемом состояниях, и в большом количестве копий на клетку. Они функционально константны и состоят как из высоко консервативных, так и из сильно вариабельных доменов. В настоящее время для подавляющего большинства представителей микроорганизмов уже существуют банки данных для многих известных последовательностей самих рРНК и генов, их кодирующих. К примеру, секвенирование 16S РНК с помощью консервативных праймеров и обратной транскриптазы дало большой толчок исследованиям филогении и затем идентификации микроорганизмов.
В настоящее время эта техника практически полностью заменена прямым секвенированием части или практически полных 16S или 23S рДНК молекул с использованием техники ПЦР и соответствующих праймеров. В международных базах данных представлены все опубликованные и даже неопубликованные частичные или полные последовательности генов для рРНК. Сегодня выполнены сотни подобных работ, исследованы различные экологические ниши, такие как биопланктон, морские осадки, почвы, горячие источники, пресные озера и т.п. При этом во многих случаях обнаруживаются новые филотипы, т.е. последовательности рРНК, принадлежащие к новым видам и типам микроорганизмов, большинство из которых еще не описано. Эти микроорганизмы можно назвать истинно некультивируемыми, так как для них действительно не описано еще сред, на которых можно продемонстрировать их рост в лабораторных условиях. Такие микроорганизмы надо отличать от некультивируемых форм хорошо известных бактерий, перечень которых представлен в таблице. Общее число прокариотических организмов, обитающих в почвах, водах и океанах, по предварительным оценкам составляет 150-200 тысяч различных видов, однако описано к настоящему времени не более 5000 видов. На основании этих данных получается, что нам вообще удается культивировать примерно 1% микроорганизмов из природных источников. По-видимому, природная популяция микроорганизмов представлена как пока неизвестными нам видами микроорганизмов, которые не могут расти на тех средах и в тех условиях, в которых мы хотели бы их культивировать, так и известными, описанными видами, находящимися в естественных условиях обитания в активном вегетативном или некультивируемом состояниях.
В НИИЭМ им. Гамалеи проводилось системное исследование феномена образования некультивируемых форм патогенными бактериями и получены результаты, отличающиеся принципиальной новизной и значимостью: описаны покоящиеся (некультивируемые) формы у многих неспорообразующих бактерий, в том числе патогенных для человека, дана разносторонняя характеристика условий, способствующих образованию некультивируемых форм, разработаны методы их идентификации, основанные на ПЦР и ОТ-ПЦР, показан генетический контроль их образования, доказана возможность сохранения вирулентности покоящимися формами, а также их реверсии в вегетативное состояние (Гинцбург, Романова, 1997; Литвин и др., 1998, 2000).
- Читать далее "Золотистый стафилококк (Staphylococcus aureus): морфологические и культурально-биохимические свойства"
Редактор: Искандер Милевски. Дата публикации: 8.11.2019
