Низкомолекулярные метаболиты микрофлоры (НММ)
Рассмотрим это явление на примере дистанционных отношений макроорганизма и его микрофлоры.
а) Дистанционные взаимодействия в системе микрофлора/макроорганизм поддерживаются, в частности, за счет обмена низкомолекулярными энергометаболитами и «сигнальными молекулами» микробного и организменного происхождения, играющими роль регуляторов метаболизма, а также иных процессов.
Спектр синтезируемых метаболитов — непосредственных продуктов синтетической деятельности аутохтонной микрофлоры, весьма широк. Он охватывает: газообразные соединения, моно- и дикарбоновые алифатические кислоты, ароматические кислоты, алифатические и ароматические спирты (фенолы), оксикислоты, аминокислоты, алифатические и ароматические амины, различные классы витаминов и коферментов.
Такое разнообразие метаболитов обеспечивается наличием мощного ферментативного аппарата, ответственного как за катаболические, так и анаболические превращения разнообразных субстратов, эффективных систем энергообеспечения, различных систем трансмембранного транспорта молекул и ионов.
Низкомолекулярные метаболиты (НММ) играют важную роль в эндосимбиозе. При этом они могут действовать не только на фронтальные структуры и ткани макроорганизма, но и попадать во внутреннюю среду. Предполагается существование как неспецифических (диффузия), так и специфических механизмов прохождения НММ во внутренние системы организма. В зависимости от их количества и мест локализации, НММ могут играть как физиологическую, так и патофизиологическую роль.
У ряда микроорганизмов обнаружены не только специфические рецепторы с высоким сродством (аффинностью), связывающие сигнальные вещества организма человека, но и соединения, идентичные или аналогичные его гормонам (инсулин, кортикотропин, прогестерон и др.), нейромедиаторы (нейротрансмиттеры) — передатчики нервных импульсов от клетки к клетке в нервной системе (серотонин, норадреналин, дофамин, окись азота, аспарагиновая и гамма-аминомасляная кислоты и др.), иные медиаторы (ЛЖК, амины и меркаптаны). Подобные агенты являются факторами микробной коммуникации и дифференцировки, определяют социальное поведение микроорганизмов, опосредуют взаимодействие макро- и микроорганизма в ходе инфекционного процесса.
В этой связи особое внимание стоит обратить на аминокислоты и ароматические амины — нейромедиаторы.
Фактически, мы имеем дело с целой областью нейромикроэкологии. Бактериальные метаболиты способны влиять не только на проведение нейросигналов, но и на поведенческие реакции человека. Это явление нуждается в серьезнейшем изучении.
Как происходит прохождение НММ во внутреннюю среду? В клинических ситуациях вторжение высоких доз микробных метаболитов в системный кровоток может достигаться несколькими путями:
• при функциональных нарушениях печени и почек, например, в связи с циррозом вследствие вирусного гепатита, алкогольного перерождения, гломерулонефрита и пр.;
• при значительном увеличении трофической олигосахаридной базы индигенной микрофлоры и последующего роста продукции ЛЖК, водорода, аммиака, аминов, в меньшей степени — МК;
• при значительном увеличении трофической пептидной базы индигенной микрофлоры и последующего роста продукции аминов, ЛЖК и МК с разветвленным углеродным скелетом;
• при селективной ферментативной недостаточности тонкого кишечника, например лактазной недостаточности и попадании в толстую кишку легко метаболизируемых р-гликанов (лактозы, лактулозы);
• при повреждении эпителия проксимальных отделов толстой кишки, например, антибиотиками, и компенсаторном усилении всасывания микробных метаболитов через эпителий толстой кишки;
• при гиперколонизации тонкого кишечника (синдроме «bacrerial overgrowth» в англоязычной литературе).
Таким образом, в одних ситуациях НММ играют важную физиологическую роль, поддерживая эндосимбиоз, с другой — напротив, выступают в качестве агентов агрессии, инициируя и поддерживая конфликт между хозяином и микробиотой.
Бактериями синтезируется большое количество классов и конкретных НММ. Какие из них играют фундаментальную роль, а какие значимы в меньшей степени? В таблице ниже наиболее важные классы НММ выделены полужирным шрифтом.
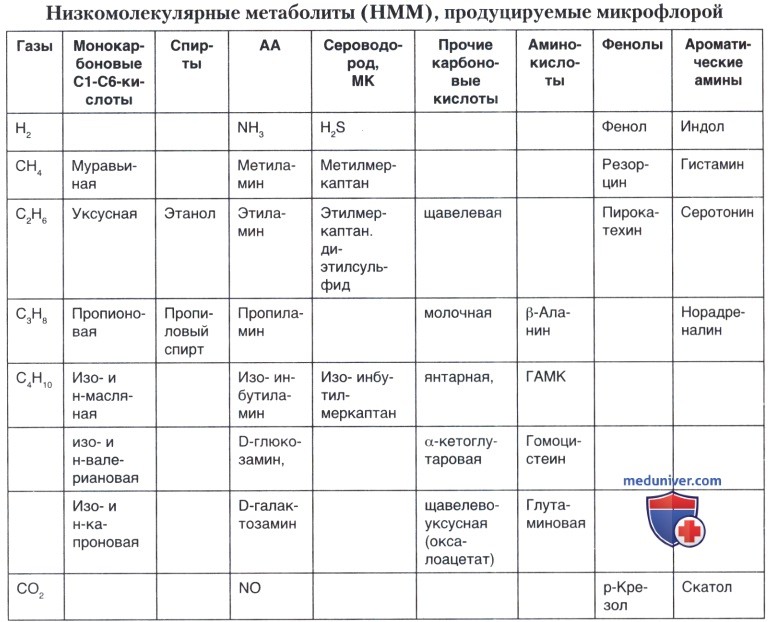
В последнее время много пишут о ЛЖК. К классу ЛЖК относят монокарбоно-вые кислоты С2-С6, с линейной и разветвленной цепью, продуцируемые анаэробной микрофлорой в процессе брожения сахаров и аминокислот. ЛЖК: уксусная, про-пионовая, масляная, валериановая, капроновая и изоформы последних трех кислот считаются наиболее важными в физиологическом и патофизиологическом плане. ЛЖК в значительных количествах образуются в кишечнике сахаролитической микрофлорой (бактероидами, бифидо-, фузо- и эубактериями, пептострептококками, пептококками, клостридиями и др.) как конечные продукты ферментации, преимущественно, растительных полисахаридов.
Действительно, ЛЖК — один из важных классов НММ, отправляющих множественные функции, как для организма, так и для микрофлоры. ЛЖК участвуют не только в осуществлении энергообеспечения эпителия и организма, но и большинства других физиологических функций аутохтонной микрофлоры: поддержании гомеостаза физико-химических параметров приэпителиальных зон, иммунорегуляции, антибактериальной, противовирусной защите и т.д. ЛЖК способствуют регуляции ионного и водного баланса в кишечнике, детоксикационной функции печени, влияют на рециркуляцию липидов и желчных кислот, участвуют в метаболических процессах, служат пластическими и энергетическим субстратами, предупреждают опухолевую трансформацию колоноцитов и т.д.
Возможно, что снижение продукции провоспалительных цитокинов эпителиальными клетками, а также усиление их дифференцировки может быть механизмом защитного действия ЛЖК при язвенном колите и онкологических заболеваниях кишечника.
б) На примере трофических связей кишечной микрофлоры и макроорганизма рассмотрим одну из важнейших функций НММ — функцию энергообеспечения организма и некоторые аспекты нарушения этой функции.
В физиологии принято различать полостное, пристеночное, мембранное, то есть эндогенное пищеварение, осуществляемое собственными ферментами организма, и симбионтное пищеварение, происходящее при содействии аутофлоры. У человека доминирует эндогенное пищеварение, связанное, в первую очередь, с функционированием собственных ферментов. Симбионтное пищеварение имеет место в толстой кишке, прежде всего, в восходящем ее отделе.
Следует подчеркнуть принципиальное различие этих двух типов пищеварения. Ферменты первой системы «разбирают» на элементарные составные части (мономеры) биополимеры субстратов, поступающих в форме пищи, затем тем или иным путем «затаскивают» эти мономеры в портальный кровоток.
Бактериальные ферменты вначале действуют так же, т.е. проводят разборку биополимеров на элементарные «кирпичики», которые, однако, затем поступают не к ор-ганизму-хозяину, а внутрь бактериальных клеток, где подвергаются вторичной переработке, меняя свою первоначальную химическую природу.
Например, полисахариды, такие как целлюлоза или гемицеллюлоза, расщепляются на мономеры глюкозы, но затем в процессе анаэробного брожения превращаются в СО2, водород и ЛЖК. Таким образом, хозяин получает уже не глюкозу, а совершенно иные молекулы, в частности уксусную, пропионовую, масляную и другие жирные кислоты. Следовательно, микрофлора является источником (продуцентом) новых НММ, непосредственно не поступающих в организм с пищей. Число этих метаболитов весьма велико, однако в количественном отношении лидируют продукты анаэробного брожения. В частности, ЛЖК, диоксид углерода, водород, алифатические амины (и аммиак), меркаптаны (и сероводород) и молочная кислота. Преобладание этих классов метаболитов среди НММ связано с низким парциальным давлением кислорода в пищеварительном тракте.
Соответственно, микрофлора нижних отделов желудочно-кишечного тракта представлена в основном облигатными и факультативными анаэробами, которые получают энергию путем неполного окисления (брожения) органических соединений, конечным результатом которого оказывается продукция названных классов метаболитов. Подчеркнем, что ЛЖК образуются не только при различных типах брожения углеводов, но и при распаде гликопротеинов, белков, липидов и нуклеиновых кислот. Важно, что весьма существенным источником исходных субстратов брожения является сам организм за счет гликопротеидов слизи, специфической оболочки эпителия — гликокаликса, отмерших и отделившихся от основного пласта (десквамированных) клеток эпителия и белков. Уровень всасывания ЛЖК значительно выше, чем абсорбция других НММ аутофлоры, в частности, молочной кислоты.
Меньший в количественном отношении вклад вносят дикарбоновые кислоты (например, янтарная) и некоторые специфические аминокислоты (гамма-аминомасляная кислота — ГАМК, бета-аланин, глутаминовая и эпсилон-аминокапроновая кислоты). Эти метаболиты также используются для нужд хозяина — главным образом, в роли регуляторных молекул.
НММ продуцируются также и в других биотопах организма, в частности, в ротоглотке человека. В отличие от кишечника, эпителий которого относится к однослойному цилиндрическому типу, поверхностные ткани ротоглотки покрыты плоским многослойным неороговевающим эпителием. Вопрос о всасывании бактериальных метаболитов многослойным эпителием такого типа в настоящее время изучен достаточно слабо. Однако установлено, что существует определенная связь между патогенезом ангин, фарингитов, хронических тонзиллитов и уровнем метаболитов бактериального происхождения в слюне. Выяснилось также, что препараты на основе бактериальных метаболитов обладают существенным бактериостатическим и противовоспалительным эффектом при лечении ангин, отитов и хронических тонзиллитов.
Суть трофических связей между сахаролитическими анаэробами и эпителием толстой кишки состоит в равновесном обмене пищевыми субстратами.
Анаэробы, представленные, по-видимому, непатогенными сахаролитическими видами, а также факультативными анаэробами, поставляют эпителию толстой кишки ЛЖК (уксусную, пропионовую, масляную, а также изомасляную и валериановую кислоты). Метаболизм колоноцитов характеризуется сочетанием активного гликолитического пути и цикла Кребса. Как уже упоминалось выше, специфика биохимических процессов в эпителиальных клетках толстой кишки состоит в том, что их основными дыхательными субстратами являются ЛЖК бактериального происхождения.
Другая важная особенность эпителиальных клеток — наличие у них двух источников лактата, так как анион молочной кислоты имеет как эндогенное (гликолитическое), так и бактериальное происхождение. Таким образом, микрофлора создает для эпителия энергетическую и сырьевую базу для синтетической деятельности.
На этой основе строится метаболическая активность эпителиальных, в частности, бокаловидных клеток, синтезирующих муцин, являющийся одним из компонентов слизи. Муцин выделяется в просвет кишечника. Он представляет собой гликопротеиды, к полипептидному остову которых прикреплены полисахаридные фрагменты. Последние, в свою очередь, являются пищевым источником для сахаролитических анаэробов, которые, как известно, располагают внеклеточным ферментативным аппаратом, обеспечивающим гидролиз гликозидных связей. Образующиеся в этом процессе моносахариды транспортируются в цитоплазму бактерий, подвергаются ферментации до ЛЖК. Следовательно, происходит циркуляция углерода (от сахаролитических анаэробов к эпителию и обратно) в рамках единого трофического цикла.
Микрофлора осуществляет восстановительный этап этого цикла, а эпителий — окислительный. Углеродный цикл не имеет замкнутого характера. Часть углерода «сгорает» до С02 и освобождает воду. Превращение претерпевает не весь углерод, поступающий в эпителий в форме ЛЖК. Часть его возвращается в просвет кишки в виде бикарбонат-ионов. Окислительное элиминирование углерода из кишечной циркуляции компенсируется поступлением из верхних отделов кишечника субстратов — в частности, полисахаридов различных пищевых волокон. Углеродное равновесие может испытывать «возмущения», направленные как на эпителий толстой кишки, так и на микрофлору. Очевидно, что вызывать такие возмущения могут факторы, непосредственно или косвенно действующие на сахаролитические анаэробы. Например, метаболическая активность последних зависит от окислительно-восстановительного потенциала среды: выраженное повышение его приводит к ингибированию метаболизма анаэробов.
Отсюда следует, что функциональные нарушения деятельности толстой кишки часто могут быть связаны с воздействием именно на эту группу бактерий.
Другим «входом» для возмущений трофического равновесия между эпителием и сахаролитическими анаэробами является группа воздействий на эпителий — например, стресс. Особенность метаболической организации эпителиальных клеток состоит в том, что при стрессе происходит переключение метаболизма с цикла Кребса и глюконеогенеза на анаэробный вариант гликолиза, активизацию гексозомонофосфатного шунта. Совершенно очевидно, что переключение приводит к выраженному изменению трофической базы колонодитов. Последние перестают потреблять ЛЖК и начинают использовать для своего дыхания эндогенный метаболит — глюкозу. Происходит «автономизация» эпителиальной подсистемы от микроценоза.
Это порождает ряд факторов, приводящих не только к изменению метаболизма колонодитов, но и к нарушению метаболических взаимоотношений с сахаролитическими анаэробами, а затем — к нарушению метаболических взаимосвязей внутри микроценоза. Прежде всего, развивается гипоксическое состояние колоноцитов, что приводит к снижению плотности эпителиального пласта, уровня продукции и ухудшению качества слизи. Тем самым сужается пищевая база сахаролитических анаэробов. Блокировка цикла Кребса частично или полностью приводит к уменьшению продукции бикарбонат-ионов. Это, в свою очередь, разрушает нормальный процесс фиксации водорода метаногенными бактериями. Наконец, активизация гексозомонофосфатного шунта у колоноцитов приводит к тому, что они становятся продуцентами токсических метаболитов кислорода, таких, как супероксид-ион, синглетный кислород, перекись водорода.
Таким образом, в ответ на стрессорные воздействия эпителий может не только «автономизировать» свой метаболизм, но и, переходя к агрессивной форме взаимоотношений, способствовать подавлению нормальной анаэробной микрофлоры. Очевидно, что поступление в гликокаликс токсичных форм кислорода приводит отчасти к гибели, отчасти к переходу в споровое состояние, отчасти к изменению мест обитания анаэробных сахаролитических резидентных видов. Следовательно, стресс порождает такой вариант дисбактериоза, при котором страдают, в первую очередь, строгие анаэробы. В ответ эпителий слизистой оболочки толстой кишки почти полностью лишается экзогенного источника метаболизма — ЛЖК. Взаимная изоляция эпителиальной и бактериальной подсистем углубляется. Происходит полное нарушение нормальных трофических связей и переход к состоянию взаимной агрессии.
Таков первый этап дисбактериоза, индуцируемого стрессом. Источники и пусковые механизмы стресса могут быть различными.
Все эффекты НММ, и в частности, ЛЖК концентрационно зависимы: их гиперпродукция, изменение спектров чреваты неприятностями для организма человека, так же как и их недостаток.
В частности, для ЛЖК, особенно масляной кислоты, отмечена способность подавлять фагоцитарную активность макрофагов и нейтрофилов, оказывать цитотоксическое действие, в том числе и на иммунокомпетентные клетки, влиять на процессы образования фибрина, выброс гормонов, накопление гистамина, экспрессию генетических элементов, вызывать деполяризацию мембран клеток, повышать проницаемость тканевых барьеров и т. д.
Другой пример: пребывание в среде ЛЖК является одним из стрессоров для Salmonella typhimurium. Ее вирулентность может быть увеличена за счет нарастания резистентности путем контакта с ЛЖК в процессе жизненного цикла, а также в анаэробных условиях, при низком значении pH и при увеличении экспозиции. Этот эффект ЛЖК дозозависим. Голодание не только защищает клетки этого микроба при лимите субстрата, но и обеспечивает перекрестную резистентность к другим стрессорам окружающей среды.
Изоформам ЛЖК — конечным продуктам микробной ферментации белков и протеолитического брожения аминокислот, в большей степени, чем нормальным, могут быть свойственны перечисленные эффекты (в силу разветвленности их молекул).
в) ЛЖК — модуляторы деятельности иммунной системы макроорганизма. Существует мнение, что «безобидные» анаэробы, выделяя иммуносупрессивные факторы, способствуют развитию вирулентных микроорганизмов.
Локализация иммунорегулирующего действия ЛЖК во взаимоотношениях макроорганизма и микрофлоры не ограничивается слизистыми, а проявляется также и в паренхиме печени, через которую ежеминутно проходит большое количество молекул бактериального происхождения из микробного резервуара толстого кишечника. Масляная кислота играет роль сдерживающего фактора, не позволяющего ретикулоэндотелиальной системе бурно реагировать на присутствие чужеродных молекул до их утилизации гепатоцитами.
Словом, ЛЖК многолики и многофункциональны. Перечисленные выше эффекты бесспорно важны для организма. Однако огромное значение они приобретают, когда возникает синергизм ЛЖК с другими классами НММ, особенно, с алифатическим аминами и меркаптанами. Всегда присутствующие в желудочно-кишечном тракте (ЖКТ), в ротоглотке МК, аммиак, ЛЖК оказываются тройной синергетной системой, вызывающей функциональные нарушения деятельности печени и почек, а затем развитие других системных поражений. В этом случае обычные дозовые зависимости перестают работать, и решающее значение могут иметь уже сравнительно малые дозы, как это часто имеет место при синдроме критических состояний (СКС).
При этом может нарушаться барьерная функция эпителия. Происходит снижение pH просвета кишечника, снижение доли диссоциированных молекул кислот и увеличение их вклада в свободную трансэпителиальную диффузию. Этот процесс не сопровождается встречным транспортом бикарбонат-ионов, что приводит к деполяризации плазматических мембран и увеличению проницаемости эпителиального пласта. Триада ЛЖК, АА, МК в этом случае не только абсорбируются эпителием и печенью, но также способны проходить через гематоэнцефалический барьер (ГЭБ), вызывать развитие наркотического состояния, сопора, быстро переходящего в кому. ЛЖК легко попадают в системный кровоток и, деполяризуя мембраны клеток гематотканевых барьеров, в частности, ГЭБ (клеток нейроглии — астроцитов), «открывают дорогу» в печень, почки и мозг для высоких доз АА и МК, которые в норме не могут преодолеть ГЭБ. Таким образом, ЛЖК, не обладая сами по себе высокой токсичностью (даже изомерные разветвленные ЛЖК, исключая изокапроновую кислоту), могут выступать в роли «проводников» через гематотканевые барьеры токсичных метаболитов, высокомолекулярных токсинов.
Можно полагать, что синергетное взаимодействие бактериальных метаболитов способно вызвать развитие не только гепатоэнцефалического синдрома, но даже комы, приводя к летальному эффекту. За счет переполнения кишечника микробами и из-за прорыва микробиологического и иммунного барьеров (М-клетки, пейеровы бляшки и пр.), а также за счет изменения метаболической активности микрофлоры, в энтерогепатический кровоток могут поступать бактериальные токсины и сами бактерии. Считается, что тройные системы ЛЖК, АА и МК играют ключевую роль в инициировании тяжелых патологических состояний, предшествуя атаке токсинов, бактериемии, дисбалансу цитокинов и возникновению острых состояний.
г) Эндотоксином обычно называют липополисахарид (ЛПС) в комплексе с липидом А, который может высвобождаться в среду при лизисе бактериальных клеток. Грамотрицательные микроорганизмы семейства Bacteroidaceae являются одним из главных компонентов резидентной анаэробной микрофлоры и носителей эндотоксина.
Как и другие структуры собственной микрофлоры, он ведет себя двояким образом. Количественным критерием является его содержаниие в системном кровотоке. Если эта доза благодаря согласованному векторному действию ЛЖК, АА, МК становится достаточно большой, то его высвобождение воспринимается организмом как «очень плохая новость», и защитные силы оказываются полностью отмобилизованными в ответ на проникновение ЛПС во внутреннюю среду (в кровяное русло). Эта реакция, не будучи ограниченной во времени, приводит к глубоким системным нарушениям — некроз тканей, диссеминированное внутрисосудистое свертывание крови (ДВС), тяжелая интоксикация, вызываемым собственными защитными системами организма и завершающимся сепсисом и гибелью организма. Общее содержание эндотоксина в фекалиях (т.е. примерно в 1000,0 г кишечного содержимого) составляет в среднем 1,0 мг. Это очень большая величина.
С другой стороны, эндотоксин как компонент клеточной стенки является не наступательным «оружием», а средством защиты бактерий от воздействия среды. Кроме того, его поступление в физиологических дозах в организм оказывает стимулирующий эффект на иммунную систему. Всасываясь в толстом кишечнике и поступая через портальную вену в печень, большая его часть в норме элиминируется купферовскими макрофагами, но часть проникает и в системный кровоток, вызывая ряд физиологических эффектов. К настоящему времени выявлено участие эндотоксинов грамотрицательных представителей микробиоты в стимуляции лимфоидной ткани и эффекторных клеток печени, усилении митогенной активности В- и Т-лимфоцитов, реализации противоопухолевого иммунитета (в частности, секреции фактора некроза опухолей — TNF-альфа), активации системы полиморфно-ядерных лейкоцитов (нейтрофилов), в физиологических условиях являющихся важными элементами антибактериальной и отчасти противоопухолевой защиты организма.
Обычно печень справляется с эндотоксином и иными токсическими продуктами, высвобождающимися при распаде бактериальных клеток. Однако ситуация резко меняется, если к действию эндотоксинов на печень присоединяются НММ.
Существует мнение, что высвобождение бактериальных токсинов, в частности, эндотоксина и токсических соединений, может произойти в результате захвата бактерий эпителиоцитами и неполного их переваривания. Таким образом, эпителиальный фагоцитоз, индуцированный токсическими веществами, может привести не только к развитию бактериемии, но и эндотоксемии.
Универсальный механизм развития патологий при посредстве НММ бактериального происхождения представляется следующим образом:
• возникновение по тем или иным причинам (воздействие токсических агентов химической природы, физических полей, неправильного питания, активных фармпрепаратов, экотоксикантов и пр.) конфликта между хозяином и микрофлорой, инициирующего взаимные атаки;
• усиление проникновения в системный кровоток разветвленных низших кислот из-за снижения функциональных возможностей печени;
• увеличение проницаемости гематотканевых (в том числе гематоэнцефалического) барьеров для меркаптанов и аминов;
• лизис клеточных стенок бактерий под влиянием биологически активных факторов организма-хозяина, высвобождение эндотоксинов или/и бактериальных пептидогликанов и проникновение их в системный кровоток;
• далее процесс развивается по известным схемам ДВС, бактериальный шок, сепсис.
При согласованной атаке НММ, эндотоксинов и последующей бактериальной агрессии происходит гиперактивация цитокинопродуцирующих клеток, приводящих к высвобождению огромного количества медиаторов воспаления, возникает дисбаланс в продукции про- и противовоспалительных цитокинов. Повреждающее действие медиаторов воспаления начинает преобладать над защитным, они оказывают деструктивное действие на клетки не только в очаге поражения, но и в других тканях, развивается системный воспалительный ответ организма на возмущение.
Вероятно, такие или подобные им механизмы работают в этиопатогенезе самых разнообразных патологий, обусловленных неуправляемым воспалением (не только у животных, но и людей), в частности, при синдромах терминальных состояний — ДВС, сепсисе, синдроме полиорганной недостаточности и т.д.
В этой связи уместно вспомнить, что в последние годы наблюдается рост сепсиса, вызванного представителями условно-патогенной микрофлоры, составляющей часть нормальной микрофлоры организма человека, которая прошла селекцию в организме больного, либо попала в него в ходе лечения (нозокомиальная инфекция). Ее представители обладают не только повышенной контагиознос гью и вирулентностью, но и высокой устойчивостью к действию большинства антибактериальных средств, которые они приобрели в условиях широкого назначения антибиотиков.
Если атака НММ и эндотоксемия не имеют массивного системного характера, то острый дисбаланс про- и антивоспалительных цитокинов не возникает. Воспалительный процесс, хотя и идет, но сначала — в ограниченном масштабе.
В этом случае мы сталкиваемся с вялотекущими хроническими воспалениями и дисфункциями: неспецифическим язвенным колитом в форме проктосигмоидита, начальными стадиями синдрома хронической почечной недостаточности, стартовыми стадиями развития атеросклероза.
Вернемся теперь к вопросу о двойственности эффектов НММ. АА, МК бактериального происхождения традиционно и, как видно из вышеизложенного, небезосновательно относят к токсическим метаболитам. Рассмотрим ситуацию, в которой МК, сульфиды и амины играют позитивную роль. При синдромах критических состояний (СКС) процессы высвобождения токсичных форм кислорода и азота (ТФК, ТФА) приобретают массивный характер. Свободно-радикальное цепное окисление играет роль ведущего химического эффектора в СКС.
Образующиеся при усилении генерации ТФК и ТФА гидроперекиси неустойчивы; их распад приводит к накоплению вторичных и конечных продуктов перекисной природы, высокотоксичных, обладающих повреждающим действием, прежде всего на мембраны клеток и субклеточные структуры. Они разрушают вещества, обладающие антиоксидантной активностью — хиноиды, изофлавоноиды, витамины, стероидные гормоны, убихинон и др. Их накопление способствует образованию трансмембранных перекисных кластеров, являющихся каналами патологической проницаемости для ионов, в частности ионов кальция.
Сложная схема массивных окислительно-восстановительных превращений, идущих при СКС, по сути дела — описание тотальной окислительной атаки на организм. В принципе, это понятно, поскольку организм погружен во враждебную агрессивную среду, обладающую огромным окислительным потенциалом, вполне способным обеспечить термоокислительную деструкцию («горение») биоструктур. В норме это «горение» не инициируется, поскольку для молекулы кислорода, находящейся в триплетном состоянии, существуют симметрийные запреты. Поэтому для инициирования цепных реакций окисления биоструктур необходимо преодолевать большие кинетические барьеры.
Если же такие барьеры преодолены, например, в результате одноэлектронного восстановления кислорода, и эти процессы приобретают массивный системный характер, как это имеет место при СКС, с такой финальной атакой уже не могут справиться естественные антиоксиданты. В сущности, происходит убийство организма кислородом, который полностью реализует свой огромный окислительный потенциал, уже не сдерживающийся никакими триплетными запретами.
P.S. Молекула кислорода имеет два неспаренных электрона, создающих однонаправленные магнитные поля. Именно их «неспаренность» порождает магнитные свойства кислорода и его неспособность напрямую взаимодействовать («запрет по симметрии» и барьер для прохождения реакций окисления) с биополимерами, имеющими «замкнутую» электронную конфигурацию, т.е. сформированную спаренными электронами. Поэтому, несмотря на высокий окислительный потенциал, кислород может его реализовать только «обходными путями», например, через присоединение одного электрона и превращение в супероксид-ион.
Откуда получить организму защиту от тотальной окислительной атаки?
Такой атаке необходимо противопоставить столь же большой резервуар восстановителей. Именно таким резервуаром является анаэробная микрофлора и ее НММ, в частности, МК и амины. Восстановительные возможности МК хорошо известны. С другой стороны, амины, особенно разветвленные, образуя стабильные нитроксильные радикалы, способны выступать в роли спиновых ловушек для ТФК и ТФА.
Только макропул восстановителей способен удержать окислительную лавину. Именно поэтому организму выгодно держать на своих границах большое количество хоть и токсичных, в принципе, но восстановительных метаболитов.
- Читать далее "Контактные взаимодействия аутохтонной микрофлоры и организма"
Редактор: Искандер Милевски. Дата публикации: 22.6.2020
- Динамический характер взаимоотношений в системе хозяин — микрофлора
- Низкомолекулярные метаболиты микрофлоры (НММ)
- Контактные взаимодействия аутохтонной микрофлоры и организма
- Внутриклеточные взаимодействия между микрофлорой и макроорганизмом
- Определение содержания бактериальных метаболитов в биологических субстратах
