Метаболизм прокариотических микроорганизмов
В живом теле микроорганизмов постоянно происходят сотни тысяч биохимических реакций, которые составляют в совокупности метаболизм (обмен веществ), направленный на сохранение, воспроизведение жизни и обеспечивающийся за счет процессов питания и дыхания.
Вся совокупность процессов метаболизма подчиняется «принципу биохимического единства», сформулированному голландским микробиологом Клюйвером (1926). По этому принципу, все живые существа на Земле в биохимическом отношении сходны. У них обнаружено сходство строительных блоков, единая энергетическая валюта — АТФ, универсальный генетический код и идентичные в своей основе главные метаболические пути.
Особенностью метаболизма микроорганизмов являются:
• голофитный способ питания, при котором питательные вещества должны быть растворены в жидкости;
• поступление питательных веществ по всей поверхности тела клетки, которая очень велика по сравнению с величиной самого микроорганизма;
• необычайная интенсивность процессов обмена веществ (за 1 сутки при благоприятных условиях 1 клетка потребляет пищи в 30-40 раз больше массы своего тела);
• многообразие источников энергии и пластических материалов;
• высокая адаптация к меняющимся условиям среды.
Клетку можно сравнить с миниатюрной лабораторией, в которой осуществляются расщепление и синтез множества разнообразных веществ. Питательные вещества, поступившие в микробную клетку, подвергаются внутриклеточным превращениям в энергоемкие и сложные структурные соединения. Они расходуются по двум основным направлениям. Часть их используется в реакциях расщепления и окисления с получением энергии и запасанием ее в форме АТФ или других энергоемких соединений — энергетический обмен (катаболизм). Другая часть расходуется по путям конструктивного, биосинтетического обмена (анаболизма). Эти процессы являются сопряженными и лишь отражают разные стороны метаболизма. При этом из сравнительно небольшого числа простых молекул-предшественников образуется в конечном итоге широкий набор разнообразных макромолекул, свойственных данному организму. Реакции анаболизма и катаболизма находятся в тесной взаимосвязи и взаимозависимости. Конечные продукты этих реакций называются метаболитами. На определенных этапах метаболизма протекают промежуточные реакции перестройки одних веществ в другие. Они получили название реакций амфиболизма, а их продукты — амфиболиты могут использоваться как в процессах анаболизма, так и катаболизма.
Обычно центральным амфиболитом считают глюкозу, так как она первая из органических веществ образуется при фотосинтезе и может вступать в катаболизм для получения энергии. Существуют три основных пути окисления глюкозы:
• гликолиз, или путь Эмбдена — Мейергофа — Парнаса, характеризуется образованием из одной молекулы глюкозы двух молекул пирувата, синтезом трех молекул пиридиннуклеотидов и двух — АТФ;
• пентозофосфатный путь (гексозомонофосфатный, или путь Варбурга — Диккенса — Хорвкера) у микроорганизмов играет вспомогательную роль. В результате его реакций образуются пентозы для последующих синтезов, пируват, три молекулы пиридиннуклеотидов и две —АТФ;
• кетодезоксифосфоглюконатный путь (КДФГ, или путь Энтнера—Дудорова) присущ исключительно микроорганизмам и приводит к образованию двух молекул пирувата, одной — АТФ и одной — НАДФН на одну молекулу глюкозы.
Далее пируват различными способами преобразуется в активированную уксусную кислоту (ацетил-КоА), которая поступает в окислительные циклы.
Все процессы жизнедеятельности микробной клетки сопряжены с тратой энергии и требуют ее возобновления, что осуществляется за счет экзотермических биохимических реакций окисления различных органических и неорганических веществ. Эти процессы энергетического обмена (катаболизма), восстанавливающие энергию клетки, обусловлены дыханием. При этом потребляются те же соединения, которые идут на построение структурных компонентов клетки, — сахара, спирты, органические кислоты, жиры и др.
Окисление веществ может происходить разными путями:
• прямым, когда к веществу присоединяется кислород. В этом случае при помощи оксидаз происходит непосредственное окисление атмосферным кислородом неорганического субстрата — молекулярного водорода, окиси углерода или серы. Прямое окисление регистрируется у большинства сапрофитов;
• непрямым — отнятием от субстрата двух атомов водорода или двух электронов (е-). Этот процесс называется дегидрогенированием. Отнятый от окисляемого субстрата — донора водород (е-) переносится на другое вещество, которое при этом восстанавливается. Вещество, присоединяющее водород (е-), называют акцептором. Перенос водорода и электронов — эквивалентный процесс. Он сопровождается высвобождением энергии, которая утилизируется клеткой и аккумулируется в макроэргических фосфатных соединениях (преимущественно АТФ).
У бактерий в этом процессе участвует несколько дегидрогеназ. Их называют по донору водорода (например, лактат дегидрогеназа). Они переносят водород на один из двух коферментов — никотинамидадениндинуклеотид (НАД+) или никотинамидадениндинуклеотидфосфат (НАДФ). Эти кофермеиты легко отделяются от дегидрогеназы и переносят водород на другой акцептор.
АТФ (аденозинтрифосфат) является основным носителем биологически используемой энергии (его называют «энергетической валютой» клетки). Все энергозависимые процессы в живых клетках прямо или косвенно сопряжены с превращением АТФ в АДФ и неорганический фосфат (Р). При разрыве фосфатных связей в АТФ выделяется большое количество энергии, которая и запасается в продуктах реакции.
Существует два основных механизма образования АТФ в клетках:
• мембранное окислительное фосфорилирование, осуществляющееся путем отнятия электронов от органического или неорганического субстрата (его окисление) и передачи их конечным акцепторам, которые при этом восстанавливаются. Конечными акцепторами являются неорганические соединения-кислород (у аэробов), сульфаты, нитраты, карбонаты и др. (у анаэробов). Эта передача электронов осуществляется в мезосомах — мембранных структурах клетки, где локализованы ферменты дыхания, и происходит путем переноса электронов в электроннотранспортной (дыхательной) цепи (ЭТЦ). Классическим примером такого механизма образования АТФ является цикл Кребса (цикл трикарбоновых кислот). За один оборот такого цикла выделяется две молекулы углекислоты, восемь — восстановительных эквивалентов и одна — АТФ. Цикл Кребса выполняет функцию не только конечного окисления питательных веществ, но и обеспечивает организм многочисленными предшественниками для процессов биосинтеза;
• субстратное фосфорилирование (брожение). При этом пути донорами и акцепторами электронов являются органические соединения (чаще всего гексозы), окисление которых происходит в циклических процессах (цикле трикарбоновых кислот и его вариантах, пентозофосфатном цикле и др).
У бактерий наиболее частым путем окисления является дегидрогенирование. Перенос водорода (e-) осуществляется окислительно-восстановительными ферментами (оксидоредуктазами). Конечным акцептором H2 (е-) может быть кислород или другое вещество, способное восстанавливаться:

В соответствии с путями биологического окисления бактерии объединяют в несколько групп:
• облигатные аэробы — бактерии, у которых конечным акцептором водорода (е-) является свободный молекулярный кислород воздуха;
• микроаэрофилы — бактерии-аэробы, у которых рост и размножение оптимальны при сниженном парциальном давлении кислорода. К ним относятся лептоспиры, боррелии, актиномицеты и др. Некоторые из бактерий — микроаэрофилов (например, нейссерии, бруцеллы) лучше растут при повышенном содержании СO2. Их относят к «капнофильным» микроорганизмам;
• облигатные анаэробы — бактерии, которые получают энергию при окислении органических или неорганических (водород, сера, железо, сероводород и др.) веществ без доступа свободного кислорода воздуха или анаэробным фотосинтезом. Некоторые из таких бактерий способны размножаться при минимальных остаточных количествах кислорода в среде (например, С. welchii). Их относят к аэротолерантным микроорганизмам;
• факультативные анаэробы, способные извлекать энергию из субстратов аэробным и анаэробным путями биологического окисления в зависимости от источника кислорода.
В энергетическом отношении аэробный тип дыхания является наиболее эффективным. Считают, что эволюция процессов запасания энергии шла от субстратного фосфорилирования (без мембран) через анаэробное дыхание (на мембранах, но без кислорода) к аэробному дыханию с формированием специализированных органелл — мезосом, митохондрий (у эукариотов). В аэробных условиях происходит окисление субстрата до С02 и воды или перекиси водорода. Процесс этот многоэтапный, протекает при участии ряда ферментов (цитохромоксидазы и системы геминовых ферментов цитохрмов) с образованием различных промежуточных продуктов. Отнятые при этом электроны передаются по дыхательной цепи через ряд окислительных стадий до активированного кислорода. Свободный кислород выполняет функцию конечного акцептора отнятых электронов. Этот процесс идет с выделением энергии и сопровождается образованием АТФ.
Аэробные микроорганизмы широко распространены в природе. Они составляют значительную часть представителей нормофлоры теплокровных и возбудителей инфекционных заболеваний. К ним относят микобактерии, вибрионы, бациллы и др. Для культивирования аэробов используют питательные среды с высокой аэрацией. При идентификации бактерий определяют наличие ферментов дыхания: оксидаз, каталазы, пероксидазы, цитохромов и др.
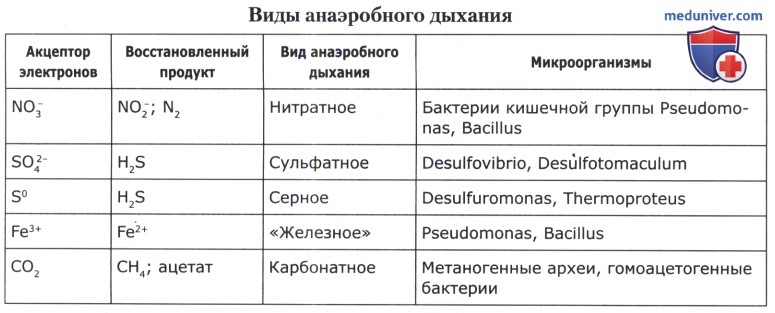
Под анаэробным дыханием понимают такие пути биологического окисления, при которых конечными акцепторами электронов являются органические (фумарат) или неорганические вещества (нитраты, сульфаты, сера, железо, карбонаты), но не свободный кислород воздуха. Анаэробное дыхание сопряжено с функционированием электронно-транспортной цепи (ЭТЦ). Все виды анаэробного дыхания подразделяются по используемому конечному акцептору электронов.
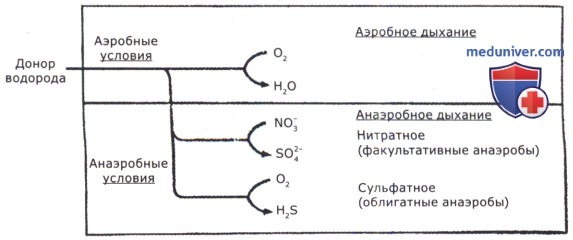
Акцептором электронов при нитратном дыхании являются нитраты, при сульфатном — сульфаты. Они же играют роль носителей кислорода. Водород, отщепленный от органического субстрата, переносится на «связанный» кислород. Легко соединяясь с водородом, нитраты восстанавливаются до аммиака (нитратное дыхание), а сульфаты — до сероводорода (сульфатное дыхание).
Нитратное дыхание осуществляется двумя путями:
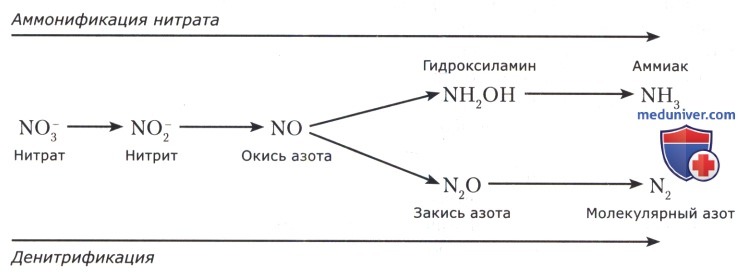
• аммонификацией нитрата с образованием аммиака, который, накапливаясь в питательной среде, идет на синтез аминокислот и других азотсодержащих соединений; такой тип дыхания известен у Е. coli, В. subtilis, Р. vulgaris и др.;
• денитрификацией нитрата с образованием молекулярного азота (бактерии родов Esherichia, Staphylococcus, Pseudomonas и др.).
Органические субстраты при нитратном дыхании полностью окисляются до углекислого газа и воды. Синтез ферментов, участвующих в восстановлении нитрата (нитрат-, нитрит-редуктазы), индуцируются только в анаэробных условиях. Кислород подавляет их образование. Возможный выход энергии с нитратом в качестве акцептора водорода приблизительно на 10% ниже, чем при аэробном дыхании.
Нитратное дыхание характерно для факультативных анаэробов.
Сульфатное дыхание выявлено у небольшой группы облигатных анаэробов (сульфатредуцирующие бактерии и археи), которые используют сульфат в качестве конечного акцептора водорода. При этом образуется сероводород:
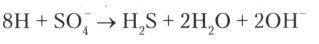
В качестве доноров водорода эти микроорганизмы используют органические кислоты или спирты (хемоорганогетеротрофы), или молекулярный водород (хе-молитотрофы). При этом органические субстраты окисляются не всегда до конца. Конечным продуктом обычно является уксусная кислота. Поэтому такие бактерии можно использовать в качестве анаэробных продуцентов уксусной кислоты.
Сульфатредуцирующие бактерии в естественных условиях встречаются в сероводородном иле, где происходит анаэробный распад органических веществ. Эти бактерии считают ответственными за высокое содержание сероводорода в глубинных слоях Черного моря. Большое экономическое значение имеет анаэробная коррозия металла и бетона, являющаяся косвенным результатом деятельности сульфатредуцирующих бактерий.
Серное дыхание может происходить в местообитаниях, связанных с вулканической деятельностью, где много абиогенной элементарной серы в анаэробных условиях. Большинство серных бактерий являются облигатными хемолитотрофами.
При «железном» дыхании происходит восстановление Fe3+ в Fe2+, при этом теоретически обоснована возможность синтеза около 11 молекул АТФ. Однако соединения трехвалентного железа практически нерастворимы и выпадают в осадок вне клетки. Поэтому в процессе переноса такого железа задействованы комплексообразователи — сидерофоры. Считают, что «железное» дыхание возникло раньше, чем сульфатное, нитратное и аэробное.
Карбонатным дыханием называют анаэробное дыхание, где конечным акцептором электронов служит углекислота (или СО). Такой тип дыхания известен у микроорганизмов, образующих метан (метаногены) и у гомоацетогенных бактерий. Считают, что метаногены — древнейшие организмы на Земле, история которых уходит в период, когда атмосфера состояла из СO2, Н2 и СО. По морфологии они варьируют от простых палочек, кокков и сарцин до спиральных форм. Это метаногенные археи — анаэробы, окисляющие Н2. Метанообразующие археи обитают в болотах, где они образуют «болотный» газ, в илах, отстойниках очистных сооружений. Источники метана — это рубец жвачных животных, кишечник лошадей и других млекопитающих (примерно у 70% людей в кишечной микробиоте имеются метаногены). Метан попадает в атмосферу при разработке угольных шахт, через разломы на дне океанов и при вулканической деятельности. Метан — это газ, ответственный за «парниковый» эффект. Время жизни метана в атмосфере — 8-10 лет.
При фумаратном дыхании конечным акцептором электронов является органическое вещество фумарат — промежуточный продукт окисления ацетил-КоА в цикле трикарбоновых кислот. К такому типу дыхания способны практически все микроорганизмы, имеющие электронно-транспортную цепь с сукцинатдегидрогеназой: 2H+ + фумарат → сукцинат. При этом цепь переноса электронов очень короткая, при восстановлении 1М фумарата образуется 1М АТФ, так как есть только один пункт сопряжения, где происходит окислительное фосфорилирование. К фумаратному дыханию способны энтеробактерии, вибрионы, пептострептококки, пропионовые бактерии и некоторые другие.
Энергетические процессы, при которых органические соединения служат одновременно и донорами, и акцепторами электронов, называют брожением. Кислород в процессах брожения не участвует. Термин «брожение» был впервые введен Л. Пастером. Последний считал, что «брожение — это жизнь без воздуха». АТФ при брожении образуется только путем субстратного фосфорилирования в темноте, без участия дыхательной цепи.
Бактерии, вызывающие брожение, относятся к факультативным или облигатным анаэробам. Факультативные анаэробы (например, энтеробактерии) в присутствии кислорода растут, как аэробные гетеротрофы. В процессе аэробного дегидрогенирования в качестве конечных продуктов могут образовываться два токсичных соединения: пероксид водорода и пероксидный радикал. Они моментально разрушаются ферментами — каталазой и пероксид-дисмутазой. У таких бактерий в анаэробных условиях обмен переключается на брожение.
В клетках облигатных анаэробов отсутствуют каталаза и пероксид-дисмутаза, поэтому они не выносят присутствия кислорода в среде и погибают на воздухе. К облигатным анаэробам относятся клостридии — возбудители газовой гангрены, столбняка, ботулизма и др.
Энергетическим материалом при брожении чаще всего являются углеводы. Акцептором водорода служат промежуточные продукты распада образующихся органических веществ, которые восстанавливаются и накапливаются в среде. Водород может частично выделяться в свободном виде. В зависимости от преобладающих или наиболее характерных конечных продуктов различают спиртовое (осуществляется дрожжами и мукоровыми грибами), молочно-кислое (вызывается бактериями семейства Lactobacteriaceae), масляно-кислое (вызывается родом Clostridium) и пропионово-кислое (вызывается родом Propionibacterium) брожение. При спиртовом брожении глюкозы образуются две молекулы этилового спирта, две молекулы углекислоты и 27 ккал энергии. При молочно-кислом брожении из глюкозы клетки получают две молекулы молочной кислоты и 18 ккал энергии.
Основное количество энергии, полученной микроорганизмами в процессах дыхания, выделяется во внешнюю среду в виде тепла и только часть используется в жизненных процессах, аэробы полезно используют около 50% энергии и столько же теряют. Анаэробы — значительно меньше. Некоторые микроорганизмы выделяют неиспользованную энергию в световой форме — светящиеся микроорганизмы.

Микроорганизмы расходуют часть потребляемой энергии для последовательного синтеза макромолекул собственных клеток (процессы анаболизма). Эти макромолекулы представляют собой полимеры низкомолекулярных органических предшественников и строятся из соответствующих субъединиц: белки — из аминокислот, полисахариды — из моносахаридов, липиды — из жирных кислот и глицерина, нуклеиновые кислоты — из нуклеотидов, фосфорной кислоты и рибозы (дезоксирибозы). В таблице ниже приведены типичные данные по количеству макромолекул у бактерий. Однако надо помнить, что состав клеток несколько различен у разных видов и варьирует в зависимости от условий выращивания.
Для синтеза этих основных макромолекул необходимо около 70 различных предшественников. Помимо этого клетка должна синтезировать ряд соединений, играющих каталитическую роль. К ним относятся приблизительно 20 коферментов и ряд переносчиков электронов. Как установлено, всего для образования новой клетки необходимо около 150 различных малых молекул, которые синтезируются из основных промежуточных метаболитов, образующихся в ходе катаболизма у гетеротрофов или при ассимиляции СO2 у автотрофов. Важнейшими такими интермедиатами считаются фосфорные эфиры сахаров, пировиноградная, уксусная, щавелевоуксусная, янтарная и а-кетоглутаровая кислоты.
Биосинтез аминокислот и белков. Бактериальная клетка способна синтезировать несколько тысяч различных белковых молекул. Для синтеза такого количества этих макромолекул необходимо всего 20 аминокислот. Все аминокислоты делятся на группы в соответствии со своим биосинтетическим происхождением.
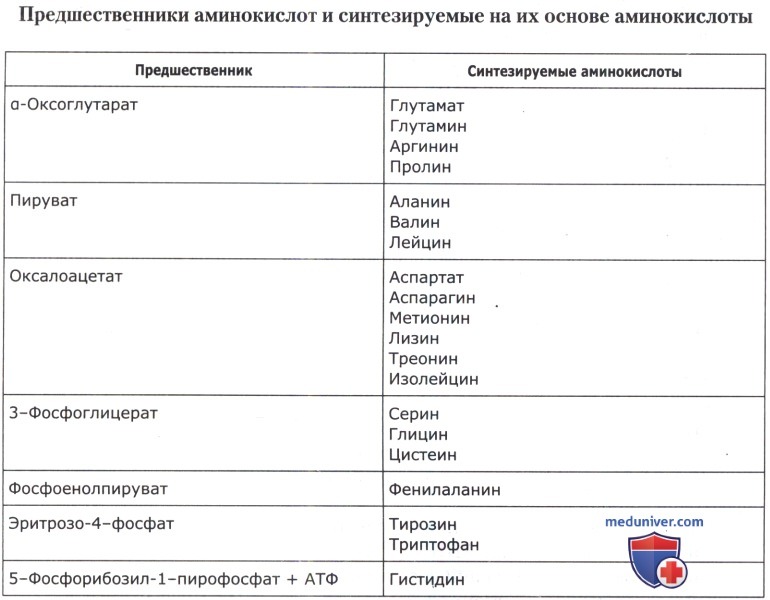
Синтез аминокислот группы глутаминовой кислоты (глутаминовая кислота, глутамин, аргинин, пролин) берет начало от α-оксоглутарата — интермедиата цикла трикарбоновых кислот. Другой интермедиат цикла трикарбоновых кислот — оксалоацетат дает начало цепи реакций, приводящих к образованию аспарагиновой кислоты, аспарагина, метионина, треонина, изолейцина и лизина (группа аспарагиновой кислоты). Синтез группы ароматических аминокислот (триптофана, фенилаланина и тирозина) начинается с конденсации фосфоенолпирувата (ФЕП) из гликолитического пути и эритрозо-4-фосфата — из пентозофосфатного пути. Другие интермедиаты гликолиза — 3-фосфоглицерат и пируват дают начало реакциям, приводящим к синтезу аминокислот группы серина (серин, глицин, цистеин) и группы пировиноградной кислоты (аланин, валин, лейцин). Биосинтез гистидина сильно отличается от синтеза других аминокислот и тесно связан с путями образования пуринов. Он синтезируется из 5-фосфорибозил-1-пирофосфата и АТФ в сложных сериях реакций под действием 9 ферментов.
С путями биосинтеза аминокислот связано образование ряда важных азотсодержащих соединений клетки. Так, пара-оксибензойная и пара-аминобензойная кислоты образуются на пути биосинтеза группы ароматических аминокислот, полиамины (путресцин, спермидин, спермин) —на пути биосинтеза глутаминовой кислоты, диаминопимелиновая и дипиколиновая кислоты — аспарагиновой кислоты, пантотеновая кислота — пировиноградной кислоты, а пурины и порфирины — на пути биосинтеза серина.
Биосинтез белков для своего осуществления требует присутствия не только ферментов и мономеров (аминокислот), но и матрицы (молекулы мРНК), задающей последовательность присоединения аминокислот к растущей цепи, а также специфического переносчика для активирования мономера и отбора его в соответствии с заданным кодом (тРНК). Реакция образования новой пептидной связи происходит на рибосоме и катализируется ферментом пептидилтрансферазой.
В биосинтезе нуклеиновых кислот строительными блоками являются пуриновые и пиримидиновые нуклеотиды.
Пуриновые нуклеотиды построены на основе рибозофосфатной цепи фосфорибозилпирофосфата. Пиримидиновые нуклеотиды формируются в серии последовательных превращений карбоксилсодержащих интермедиатов, начиная с карбамоилфосфата. Рибозофосфат включается в последовательность позже.
Образование нуклеиновых кислот осуществляется путем матричного синтеза в процессах репликации и транскрипции. Репликация ДНК происходит на каждой цепи двунитевой материнской ДНК, служащей матрицей, при участии ферментов ДНК-полимераз и с дезоксирибоеуклеозид-5-трифосфатами в качестве субстратов. Матрицей для транскрипции служит одна из цепей ДНК, а субстратами — рибонуклеотид-5-трифосфаты. Синтез РНК происходит при помощи ферментов РНК-полимераз.
Синтез липидных компонентов. Липиды — группа соединений, разнообразных по химическому составу, хорошо растворимых в неполярных растворителях (эфир, хлороформ, бензол) и нерастворимых в воде. Липиды являются важными компонентами ЦПМ и клеточной стенки, а также служат запасными веществами. Условно их можно разделить на вещества, содержащие жирные кислоты, связанные эфирной связью (нейтральные жиры, фосфолипиды, гликолипиды, липополисахариды, полиалканоаты и др.), и вещества, содержащие изопреновые фрагменты (полиизопрены, каратиноиды, стеролы, хлорофиллы, хиноны и др.).
В липидах бактерий преобладают длинноцепочечные насыщенные жирные кислоты и ненасыщенные жирные кислоты, имеющие одну двойную связь. Редко встречаются триглицериды. Важную роль в синтезе жирных кислот играет ацилпереносящий белок (АПБ), на котором происходит наращивание углеродной цепи образуемой жирной кислоты.
Синтез жирных кислот с четным числом атомов углерода начинается с образования ацетил-АПБ и малонил-АПБ и их последующей конденсации. Далее следует ряд последовательных реакций восстановления с образованием бутирил-АПБ. Каждый последующий акт взаимодействия с малонил-АПБ приводит к удлинению растущего АПБ-соединения на два атома углерода.
Синтез жирных кислот с нечетным числом атомов отличается только первой реакцией, где происходит конденсация пропионил-АПБ с малонил-АПБ. Двойные связи в молекуле жирной кислоты образуются либо путем десатурации уже полностью синтезированных насыщенных жирных кислот с участием молекулярного кислорода (аэробный путь), либо при помощи реакции дегидратации во время роста цепи жирной кислоты (анаэробный путь).
Большое значение имеют сложные липиды, представляющие собой сложные эфиры глицерина, в которых две спиртовые группы глицерина этерифицированы жирными кислотами, а третья — остатком фосфорной кислоты или сахаром. Остаток фосфорной кислоты, в свою очередь, связан с серином, этаноламином или глицерином и др., образуя фосфатидилсерин, фосфатидилэтаноламин, фосфатидилглицерин, кардиолипин и т.д.
При образовании изопреноидных липидов первые стадии связаны с последовательной конденсацией трех молекул ацетил-КоА в разных положениях и перегруппировкой полученного соединения. В результате синтезируется разветвленная мевалоновая кислота, которая претерпевает два последовательных фосфорилирования и декарбоксилирование с образованием активированного С5-соединения, являющегося предшественником сложных изопреноидных веществ. В основе таких синтезов лежат реакции элонгации линейных изопренов и конденсация молекул с разным числом углеродных атомов в различных положениях («голова к хвосту», «хвост к хвосту» и т. д.).
Синтез полисахаридов осуществляется из глюкозы, ее производных и других сахаров путем соединения друг с другом.
Для самого существования жизни важны как регуляция активности отдельных путей метаболизма, так и координация деятельности этих путей. Дезорганизация без адекватного контроля метаболизма приводит к гибели клетки.
Задача регуляторных механизмов необычайно сложна. Все пути метаболизма должны регулироваться и координироваться так эффективно, чтобы все клеточные компоненты присутствовали в данный момент в точно необходимых количествах. К тому же микробные клетки должны эффективно «отвечать» на изменения окружающей среды использованием имеющихся на данный момент питательных веществ и включением новых кагаболических путей, когда становятся доступными другие вещества. Поскольку композиция химических соединений окружающей среды постоянно меняется, то регуляторные процессы должны постоянно соответствовать новым условиям. Регуляция важна для поддержания баланса между энергодающими и синтетическими реакциями в клетке, она очень сложна и включает несколько взаимодействующих регуляторных механизмов. Среди них:
— локализация метаболитов и ферментов в разных частях клетки — компартментализаця; она делает возможным одновременное, но раздельное регулирование анаболических путей;
— стимуляция или ингибирование активности определенных ферментов, позволяющие быстро менять путь метаболизма;
— контроль количества молекул фермента у микроорганизмов на уровне транскрипции; этот способ более медленный, ферменты синтезируются только тогда, когда в них есть необходимость.
- Читать далее "Рост и размножение микроорганизмов"
Редактор: Искандер Милевски. Дата публикации: 16.05.2019
