Проведение ПЦР на матрице ДНК
ПЦР основана на трехэтапном циклическом процессе, в результате которого многократно увеличивается количество специфического фрагмента ДНК.
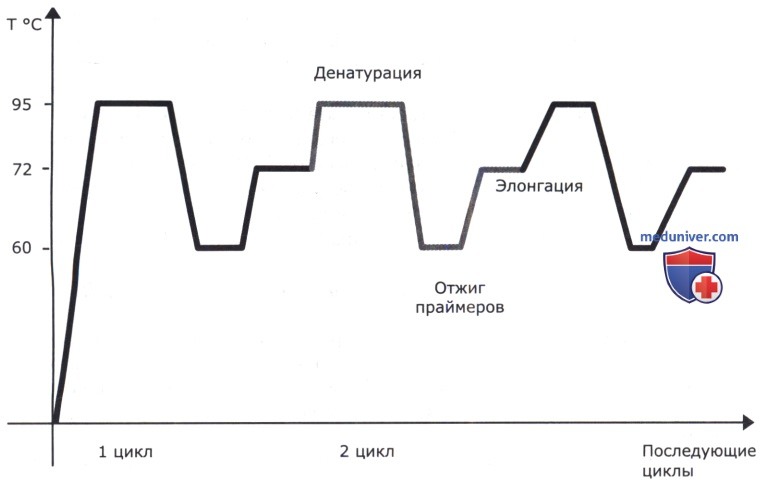
Рассмотрим механизм протекания ПЦР. Каждый цикл ПЦР состоит из трех стадий или трех шагов: денатурации (94-95°С), гибридизации (отжига) праймеров (50-60°С), полимеризации, или элонгации (удлинения), цепи ДНК (72°С).
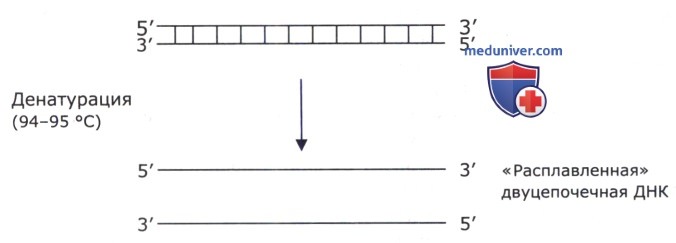
а) Денатурация. Во время денатурации иод действием высокой температуры (94-95 °С) происходит «расплавление» двуцепочечной ДНК, т. е. цепи ее разделяются, и ДНК переходит в однонитевую форму. В результате этого освобождается место для «посадки», или гибридизации, праймеров.
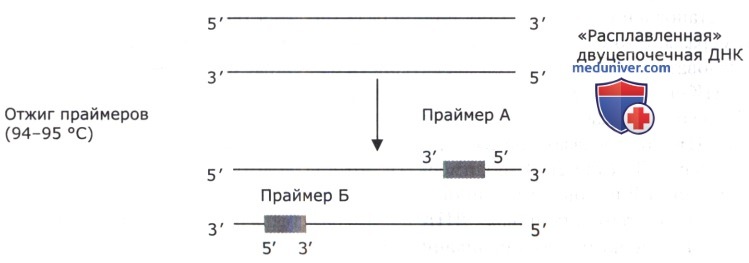
б) Гибридизация (отжиг) праймеров. При понижении температуры до требующейся для гибридизации (50-60 °С) специфические одноцепочечные участки ДНК (праймеры) гибридизуются с комплементарным участком матрицы (исходной расплавленной ДНК), т. е. образуют двунитевую ДНК. Праймеры синтезируются химическим путем и ограничивают исследуемый специфический участок ДНК. В молекулярной биологии гибридизацию праймеров на специфическом участке ДНК называют отжигом. Каждый праймер гибридизуется на двух цепях ДНК таким образом, что их 3’-гидроксильные концы, которые способны удлиняться, направлены навстречу друг другу. После гибридизации праймеры строго ограничивают специфический участок ДНК.
Праймеры и условия отжига подбираются при помощи компьютерных программ. Существует база данных, где приведены первичные структуры всех известных микроорганизмов. Эти данные используются при подборе праймеров к специфическому участку бактерии. Основным критерием подбора праймеров является комплементарность 2-3 нуклеотидов на З’-конце праймеров. При этом исключается неспецифическое праймирование, образование димеров из праймеров. Важным фактором, определяющим эффективность и специфичность амплификации, является подбор оптимальной температуры отжига праймеров на матрице. При пониженной температуре в реакционной смеси может произойти связывание праймеров с неспецифическим участком ДНК и как следствие этого сформироваться ложные неспецифические ампликоны (артефакты). Температура отжига зависит от длины праймеров и CG-содержания. Для олигонуклеотидов длиной 14-70 оснований оптимальную температуру отжига праймеров рассчитывают по формуле, в которой учитывается структура праймеров и условия проведения реакции (температура, ионный состав среды). Приблизительно, температуру отжига праймера можно оценить по эмпирической формуле:
Т (°С) = 4(G+C) + 2 (А+Т) - 3,
где А, Т, G, С — число соответствующих нуклеотидов в одном праймере.
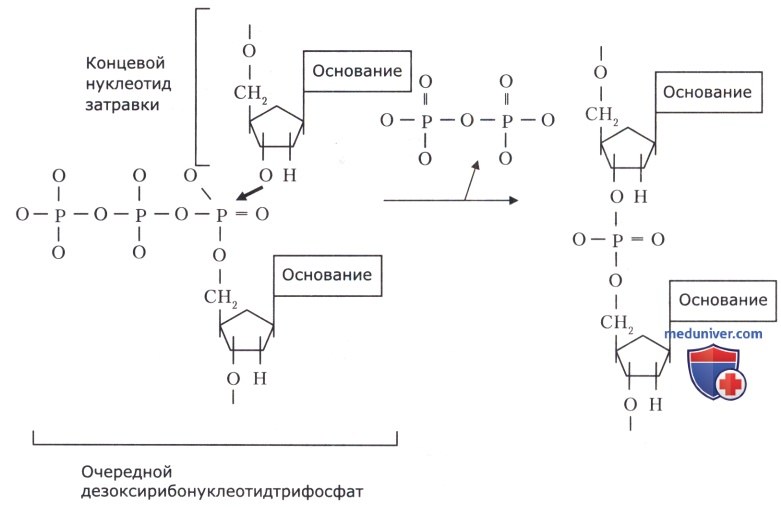
в) Полимеризация, или элонгация. При повышении температуры до 72°С создаются оптимальные условия для эффективной работы термостабильной ДНК-полимеразы. В процессе элонгации происходит реакция, осуществляемая термостабильной ДНК-полимеразой. Термостабильными называются ферменты, работающие при высокой температуре («Жизнь микробов в экстремальных условиях» под ред. Д. Кашнера, 1981). Такие ферменты выделяют из термофильных бактерий; температурный оптимум для полимеризации 72-84°С. Точно не установлено, к какому типу полимераз относятся термостабильные ДНК-полимеразы. Это белки, по молекулярной массе приближающиеся к 80-90 кДа. Следовательно, судя по этой характеристике, данные ферменты приближаются к ДНК-полимеразам I типа. Термостабильные ферменты в большинстве своем обладают 5’-3’экзонуклеазной активностью. Считают, что первая термостабильная ДНК-полимераза была выделена из штамма термофильной бактерии Thermus aquaticus YTl (Taq ДНК-полимераза). Этот штамм был обнаружен в горячих источниках Елостонского национального парка (США). Однако мало кто знает, что в 1980 г. термостабильная ДНК-полимераза была описана и выделена в России С. Городецким. В амплификации наиболее часто используются Taq ДНК-полимераза и Tth ДНК-полимераза. При образовании комплекса праймер — матрица появляются условия для связывания с ним ДНК-полимеразы (двунитевая ДНК с выступающим 5’-концом является субстратом для ДНК-полимераз).
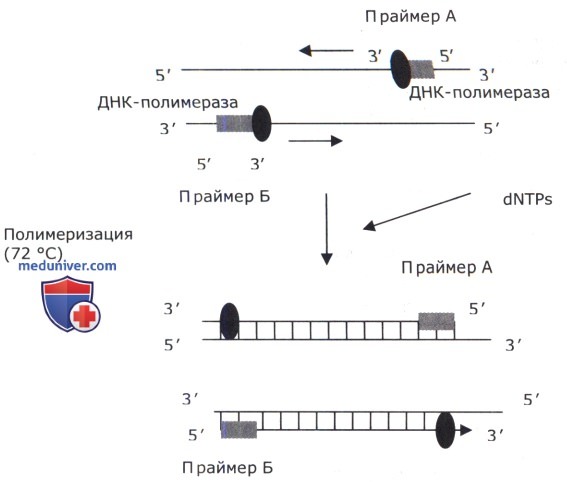
ДНК-полимераза связывается с участком ДНК, в котором одна из цепей непрерывна (матрица), а другая заканчивается 3’-концом и содержит 3’-гидроксил, необходимый для продолжения цепи (праймер). После этого фермент в комплексе с матрицей и праймером связывает соответствующий следующему нуклеотидному звену матрицы субстрат и катализирует реакцию его присоединения. Субстратом полимеразной реакции являются 4 дезоксинуклеотидтрифосфата (dNTP). Процесс удлинения ДНК можно представить в виде формулы:
(pdN)n + P3dN = (pdN)n+1 + РРi,
где (pdN)n — растущая цепь ДНК;
Р3dN — dNTP (дезоксинуклеотидтрифосфат);
(pdN)n+1 —цепь ДНК, удлиненная на один нуклеотид;
РРi — пирофосфат.
Вывели эту химическую формулу, а также выделили первую ДНК-полимеразу А. Корнберг с сотрудниками. Открытие ДНК-полимераз легло в основу теории биосинтеза ДНК. Химическая реакция, обеспечивающая данный процесс, заключается в конденсации растущей цепи ДНК с очередным субстратом.
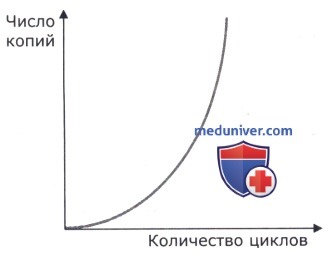
Следующий цикл реакции начинается денатурацией полученной ДНК. В этом случае получается в 2 раза больше молекул, на которых будут гибридизоваться праймеры. Серия повторяющихся циклов позволяет получить экспоненциальное накопление фрагмента ДНК. В идеальном случае наработка специфического фрагмента подчиняется закону 2n-2n раз, где n — число циклов, а 2n — продукт неопределенной длины, полученный в каждом цикле с исходной матрицы ДНК. После проведения 25-30 циклов происходит увеличение фрагмента в 106-108 раз.
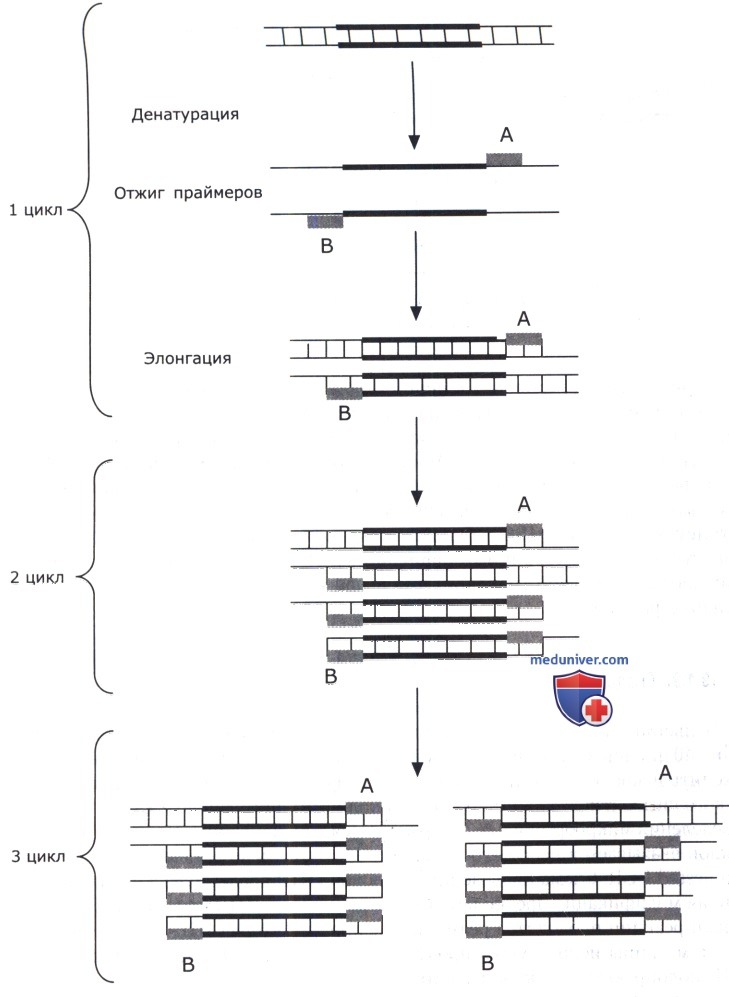
Длина фрагмента, нарабатывающегося в ПЦР, равна сумме длин двух праймеров плюс расстояние на ДНК-матрице между праймерами. На рисунке ниже первый цикл показан подробно. Второй и третий циклы состоят из трех стадий, подобно первому; на схеме показаны лишь их результаты.
ОТ/ПЦР — это модификация ПЦР. Данный метод используют для выявления молекул РНК. Он возник как последовательное проведение двух реакций. В ходе первой стадии — обратной транскрипции при помощи одного праймера, комплементарного исследуемой РНК, субстратов реакции (dNTPs) и матрицы РНК происходит ферментативный синтез копий ДНК (кДНК) с матрицы РНК. Вторая стадия — это классическая ПЦР, подробно описанная выше.
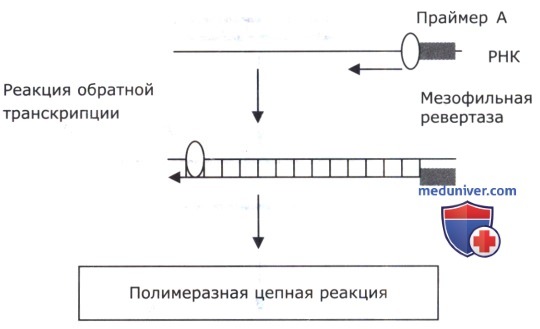
Первую стадию проводят с использованием мезофильной ревертазы (фермента, синтезирующего кДНК на матрице РНК). Существенной проблемой использования РНК в качестве матрицы является наличие сложной вторичной структуры молекул РНК. Часто мезофильные ревертазы не могут синтезировать протяженные кДНК на такой матрице. Некоторые исследователи используют вещества, дестабилизирующие молекулу РНК: метилртуть или диметилсульфоксид (DMSO). Однако добавление таких веществ может снизить эффективность синтеза и амплификации кДНК. Другой подход — повышение температуры обратной транскрипции выше 42 °С, т. е. использование термостабильных ферментов.
- Читать далее "Гнездовая ПЦР (nested)"
Редактор: Искандер Милевски. Дата публикации: 24.08.2019
